
|
|
Appunti delle lezioni, cheat sheet
Terapia ospedaliera. Appunti delle lezioni: in breve, il più importante
Elenco / Appunti delle lezioni, cheat sheet Sommario
CONFERENZA N. 1. Malattie del sistema cardiovascolare. Reumatismi Reumatismo (malattia di Sokolsky-Buyo) è una malattia infiammatoria sistemica del tessuto connettivo con una localizzazione predominante del processo nel sistema cardiovascolare, che si sviluppa in persone predisposte ad esso (di norma, si tratta di giovani) a causa di un'infezione acuta con streptococco β-emolitico di gruppo A. Questa definizione della malattia è stata data nel 1989 da V. A. Nasonov. Riflette tutte le caratteristiche della malattia: 1) danno predominante al sistema cardiovascolare; 2) il ruolo dell'ereditarietà patologica; 3) il significato dell'infezione da streptococco. L'essenza della malattia sta nella sconfitta di tutte le membrane del cuore, ma principalmente del miocardio e dell'endocardio con il verificarsi di deformazione dell'apparato valvolare - malattie cardiache e successivo sviluppo di insufficienza cardiaca. La sconfitta di altri organi e sistemi nei reumatismi è di secondaria importanza e non ne determina la gravità e la successiva prognosi. eziologia. Бета-гемолитические стрептококки группы А являются причиной поражения верхних дыхательных путей. Именно поэтому возникновению ревматизма, как правило, предшествуют ангина, обострение хронического тонзиллита, а в крови у заболевших выявляется повышенное количество стрептококкового антигена и противострептококковых антител (АСЛ-О, АСГ, АСК, антидезоксирибонуклеазы В (анти-ДНКазы В)). Tale connessione con una precedente infezione da streptococco è particolarmente pronunciata nel decorso acuto dei reumatismi, accompagnato da poliartrite. Nello sviluppo dei reumatismi giocano un ruolo l'età e i fattori sociali (condizioni di vita sfavorevoli, malnutrizione), conta anche una predisposizione genetica (i reumatismi sono una malattia a trasmissione poligenica, è ben nota l'esistenza di famiglie “reumatiche”) che consiste in una risposta iperimmune agli antigeni dello streptococco, propensione dei pazienti a processi autoimmuni e immunocomplessi. patogenesi. При ревматизме возникает сложный и многообразный иммунный ответ (реакции гиперчувствительности немедленного и замедленного типов) на многочисленные антигены стрептококка. При попадании в организм инфекции вырабатываются противострептококковые антитела и образуются иммунные комплексы (антигены стрептококка + антитела к ним + комплемент), которые циркулируют в крови и оседают в микроциркуляторном русле. Токсины и ферменты стрептококка также оказывают повреждающее действие на миокард и соединительную ткань. A causa di un difetto geneticamente determinato nel sistema immunitario, gli antigeni streptococcici e gli immunocomplessi non vengono eliminati completamente e rapidamente dal corpo dei pazienti. I tessuti di tali pazienti hanno una maggiore tendenza a riparare questi immunocomplessi. Anche gli anticorpi a reazione incrociata svolgono un ruolo qui, che, essendo formati su antigeni streptococcici, sono in grado di reagire con i tessuti, compreso il cuore, gli antigeni del corpo. In risposta, l'infiammazione si sviluppa su base immunitaria (a seconda del tipo di ipersensibilità immediata), mentre i fattori che attuano il processo infiammatorio sono gli enzimi lisosomiali dei neutrofili che fagocitano gli immunocomplessi e vengono contemporaneamente distrutti. Questo processo infiammatorio è localizzato nel tessuto connettivo, prevalentemente del sistema cardiovascolare, e modifica le proprietà antigeniche di esso e del miocardio. Di conseguenza, i processi autoimmuni si sviluppano in base al tipo di ipersensibilità di tipo ritardato e nel sangue dei pazienti si trovano linfociti che reagiscono con il tessuto cardiaco. Queste cellule sono di grande importanza nell'origine delle lesioni d'organo (principalmente il cuore). Nel tessuto connettivo con reumatismi si verificano cambiamenti di fase: gonfiore mucoide - alterazioni fibrinoidi - necrosi fibrinoide. L'espressione morfologica dei disturbi immunitari sono reazioni cellulari: infiltrazione di linfociti e plasmociti, formazione di granulomi reumatici o Ashoff-Talalayevsky. Il processo patologico termina con la sclerosi. Un altro substrato morfologico del danno cardiaco nella cardiopatia reumatica è una reazione infiammatoria aspecifica simile a quella delle articolazioni e delle membrane sierose: gonfiore del tessuto connettivo intermuscolare, sudorazione di fibrina, infiltrazione di neutrofili e linfociti. La malattia scorre a ondate, aggravata sotto l'influenza di infezioni o fattori non specifici (ipotermia, stress fisico, stress, ecc.), Che è associata alla natura autoimmune del processo patologico. Quando il cuore è danneggiato, il processo infiammatorio può diffondersi a tutte le membrane del cuore (pancardite) o in isolamento a ciascuna delle membrane. I cambiamenti morfologici nei reumatismi si trovano principalmente nel miocardio, quindi è la miocardite nelle prime fasi che determina il quadro clinico. Cambiamenti infiammatori nell'endocardio (valvulite, endocardite verrucosa), danni ai filamenti tendinei e all'anello fibroso vengono rilevati clinicamente 6-8 settimane dopo l'attacco dei reumatismi. La valvola mitrale è più comunemente colpita, seguita dalle valvole aortica e tricuspide. La valvola polmonare nei reumatismi non è quasi mai interessata. Classificazione dei reumatismi. В настоящее время принята классификация и номенклатура ревматизма, одобренная в 1990 г. Всесоюзным научным обществом ревматологов, отражающая фазу течения процесса, клинико-анатомическую характеристику поражения органов и систем, характер течения и функциональное состояние сердечно-сосудистой системы (см. табл. 1). Quadro clinico. Все проявления болезни можно разделить на сердечные и внесердечные. Описывать клиническую картину болезни можно с этих позиций. Stadio I: viene rivelata la connessione della malattia con l'infezione trasferita. In casi tipici, 1-2 settimane dopo un mal di gola o una malattia respiratoria acuta, la temperatura corporea aumenta, a volte fino a 38-40°C, con fluttuazioni durante la giornata entro 1-2°C e forte sudorazione (di solito senza brividi). Con ripetuti attacchi di reumatismi, spesso si sviluppa una recidiva della malattia sotto l'influenza di fattori non specifici (come ipotermia, sovraccarico fisico, chirurgia). Tabella 1 Classificazione dei reumatismi
La manifestazione più comune di reumatismi è il danno cardiaco - cardiopatia reumatica: danno simultaneo al miocardio e all'endocardio. Negli adulti, la cardiopatia reumatica non è grave. I pazienti lamentano un lieve dolore o disagio nella regione del cuore, una leggera mancanza di respiro durante l'esercizio, interruzioni o palpitazioni sono molto meno comuni. Questi sintomi non sono specifici della cardiopatia reumatica e possono essere osservati in altre condizioni cardiache. La natura di tali reclami è specificata nelle fasi successive della ricerca diagnostica. La reumocardite nei giovani pazienti, di regola, è grave: fin dall'inizio della malattia, si notano grave mancanza di respiro durante l'esercizio ea riposo, dolore costante al cuore e palpitazioni. Potrebbero esserci sintomi di insufficienza circolatoria in un ampio cerchio sotto forma di edema e pesantezza nell'ipocondrio destro (a causa di un aumento del fegato). Tutti questi sintomi indicano una miocardite diffusa grave. La pericardite, così come le manifestazioni extracardiache dei reumatismi, sono rare. Con lo sviluppo della pericardite secca, i pazienti notano solo un dolore costante nella regione del cuore. Con la pericardite essudativa, caratterizzata dall'accumulo di essudato sieroso-fibrinoso nel sacco cardiaco, il dolore scompare, poiché gli strati pericardici infiammati vengono separati dall'essudato accumulato. Appare mancanza di respiro, che aumenta con la posizione orizzontale del paziente. A causa della difficoltà del flusso sanguigno al cuore destro, la congestione appare in un ampio cerchio (edema, pesantezza nell'ipocondrio destro a causa di un aumento del fegato). La più caratteristica dei reumatismi è la sconfitta del sistema muscolo-scheletrico sotto forma di poliartrite reumatica. I pazienti notano un dolore in rapido aumento nelle grandi articolazioni (ginocchio, gomito, spalla, caviglia, polso), l'impossibilità di movimenti attivi, un aumento del volume delle articolazioni. C'è un effetto rapido dopo l'uso di acido acetilsalicilico e altri farmaci antinfiammatori non steroidei con sollievo per diversi giorni, spesso diverse ore di tutte le manifestazioni articolari. Anche le lesioni reumatiche dei reni sono estremamente rare, rilevate solo nello studio delle urine. Le lesioni del sistema nervoso nei reumatismi sono rare, principalmente nei bambini. I reclami sono simili a quelli di encefalite, meningoencefalite, vasculite cerebrale di diversa eziologia. Merita attenzione solo la "piccola corea", che si verifica nei bambini (più spesso ragazze) e si manifesta con una combinazione di labilità emotiva e violenta ipercinesia del tronco, degli arti e dei muscoli mimici. La sindrome addominale (peritonite) si verifica quasi esclusivamente nei bambini e negli adolescenti con reumatismi primari acuti. È caratterizzata da esordio improvviso, febbre e segni di disfagia (si verificano dolori crampiformi diffusi o localizzati, nausea, vomito, ritenzione o feci frequenti). Nella fase II della ricerca diagnostica, l'individuazione dei segni di danno cardiaco ha poca importanza. Nella cardiopatia reumatica primaria, il cuore di solito non è ingrandito. L'auscultazione rivela un tono I smorzato, a volte l'aspetto di un tono III, un lieve soffio sistolico all'apice. Questa sintomatologia è dovuta a cambiamenti nel miocardio. Tuttavia, un aumento dell'intensità, durata e persistenza del rumore può indicare la formazione di un'insufficienza della valvola mitrale. È possibile giudicare con sicurezza la formazione del difetto 6 mesi dopo l'inizio dell'attacco, pur mantenendo il quadro auscultatorio sopra. In caso di danno alla valvola aortica si può udire un soffio protodiastolico al punto di Botkin e si può preservare la sonorità del II tono. Solo molti anni dopo, dopo la formazione di una grave insufficienza della valvola aortica, l'indebolimento (o l'assenza) del II tono nel II spazio intercostale a destra si unisce a questo segno auscultatorio. Nei pazienti con poliartrite, si nota una deformità articolare a causa dell'infiammazione della membrana sinoviale e dei tessuti periarticolari, dolore alla palpazione dell'articolazione. Nell'area delle articolazioni colpite possono comparire noduli reumatici, che si trovano sugli avambracci e sugli stinchi, sopra le protuberanze ossee. Queste sono formazioni piccole, dense e indolori che scompaiono sotto l'influenza del trattamento. Gli eritemi anulari (segno quasi patognomonico dei reumatismi) sono elementi a forma di anello rosa, non pruriginosi, localizzati sulla pelle della superficie interna delle braccia e delle gambe, dell'addome, del collo e del tronco. Questo sintomo è estremamente raro (nell'1-2% dei pazienti). La polmonite reumatica e la pleurite hanno gli stessi segni fisici di malattie simili di eziologia banale. In generale, le lesioni non cardiache sono attualmente osservate molto raramente, nei giovani con un decorso acuto di reumatismi (in presenza di alta attività - III grado). Sono espressi in modo non nitido, rapidamente suscettibili di invertire lo sviluppo durante la terapia antireumatica. Nella III fase della ricerca diagnostica, i dati degli studi di laboratorio e strumentali consentono di stabilire l'attività del processo patologico e chiarire il danno al cuore e ad altri organi. Con un processo reumatico attivo, i test di laboratorio rivelano una fase acuta aspecifica e parametri immunologici alterati. Indicatori di fase acuta: neutrofilia con spostamento della formula del sangue dei leucociti a sinistra; un aumento del contenuto di 2-globuline, seguito da un aumento del livello di - globuline; aumento del contenuto di fibrinogeno; la comparsa della proteina C-reattiva; La VES aumenta. Per quanto riguarda i parametri immunologici, aumentano i titoli degli anticorpi anti-streptococcici (anti-ialuronidasi e antistreptochinasi più di 1:300, anti-O-streptolisina più di 1:250). L'ECG a volte rivela disturbi del ritmo e della conduzione: blocco atrioventricolare transitorio (più spesso I grado - prolungamento dell'intervallo P-Q, meno spesso - II grado), extrasistolia, ritmo atrioventricolare. In un certo numero di pazienti, viene registrata una diminuzione dell'ampiezza dell'onda T fino alla comparsa di denti negativi. Questi disturbi del ritmo e della conduzione sono instabili e scompaiono rapidamente nel corso della terapia antireumatica. Se i cambiamenti nell'ECG sono persistenti e rimangono dopo l'eliminazione di un attacco reumatico, allora si dovrebbe pensare al danno organico al miocardio. Durante l'esame fonocardiografico vengono specificati i dati dell'auscultazione: indebolimento del XNUMXo tono, comparsa del XNUMXo tono, soffio sistolico. Nel caso della formazione di una malattia cardiaca, sul PCG compaiono cambiamenti che corrispondono alla natura della lesione valvolare. Raggi X al primo attacco di reumatismi, non vengono rilevati cambiamenti. Solo con una grave cardiopatia reumatica nei bambini e nei giovani è possibile rilevare un aumento del cuore a causa della dilatazione del ventricolo sinistro. Con lo sviluppo della cardiopatia reumatica sullo sfondo di una malattia cardiaca esistente, l'immagine radiografica corrisponderà a un difetto specifico. Uno studio ecocardiografico nella cardiopatia reumatica primaria non rivela alcun cambiamento caratteristico. Solo nella cardiopatia reumatica grave con segni di insufficienza cardiaca sull'ecocardiogramma mostrano segni che indicano una diminuzione della funzione contrattile del miocardio e l'espansione delle cavità cardiache. diagnostica. Распознавание первичного ревматизма представляет большую трудность, так как наиболее частые его проявления, такие как полиартрит и поражение сердца, неспецифичны. В настоящее время наибольшее распространение получили большие и малые критерии ревматизма Американской ассоциации кардиологов. La combinazione di due criteri maggiori o uno maggiore e due minori indica una maggiore probabilità di reumatismi solo nei casi di precedente infezione da streptococco. Con l'esordio graduale dei reumatismi, la diagnosi sindromica proposta da A. I. Nesterov nel 1973 (vedi Tabella 2) conta: sindrome clinica ed epidemiologica (connessione con infezione da streptococco); sindrome clinica e immunologica (segni di convalescenza incompleta, artralgia, aumento dei titoli di anticorpi antistreptococcici, nonché rilevamento di disproteinemia e indicatori di fase acuta); sindrome cardiovascolare (rilevamento di cardite e lesioni extracardiache) (vedere Tabella 3). Tabella 2 Criteri per i reumatismi
Tabella 3 Gradi di reumatismi
Diagnosi differenziale. Ревматический полиартрит необходимо дифференцировать с неревматическими (см. табл. 4). Tabella 4 Poliartrite reumatica e non reumatica
Le seguenti malattie e sintomi sono sospetti in relazione ai reumatismi: 1) endocardite; 2) miocardite; 3) pericardite; 4) difetti cardiaci; 5) disturbi del ritmo e della conduzione; 6) insufficienza cardiaca acuta e cronica; 7) condizione subfebbrile prolungata; 8) eritema nodoso; 9) eritema anulare; 10) noduli sottocutanei; 11) poliartrite allergica acuta; 12) corea. Nessuna delle sindromi cliniche sopra elencate è specifica per questa malattia. Solo una combinazione di patologia cardiaca con almeno un sintomo principale extracardiaco di reumatismi dà motivo di sospettare un reumatismo. Il riconoscimento della cardiopatia reumatica stessa viene effettuato sulla base di sintomi come mancanza di respiro e palpitazioni, affaticamento, dolore nella regione del cuore e disturbi del ritmo cardiaco, mormorii, a volte un ritmo di galoppo e un indebolimento del tono I. Di grande importanza nella diagnosi della cardiopatia reumatica è l'identificazione della patologia sull'ECG. Nei reumatismi è causata da miocardite, pericardite e cardiopatie. L'osservazione dinamica consente di distinguere i cambiamenti irreversibili caratteristici dell'ipertrofia di varie parti del cuore in caso di difetti, da quelli transitori, che indicano l'attuale processo infiammatorio. trattamento. Положительному эффекту при лечении, а также предупреждение развития порока сердца способствует в ранняя диагностика и проведение индивидуального лечения, которое основано на оценке вида течения, активности патологического процесса, степени выраженности кардита, варианта клапанного порока сердца. Имеют значение состояние миокарда, других тканей и органов, профессия больного и др. Pertanto, l'intero complesso del trattamento dei reumatismi consiste nella terapia antimicrobica e antinfiammatoria, misure volte a ripristinare l'omeostasi immunologica. Si raccomanda di utilizzare una dieta equilibrata razionale, concentrarsi sull'adattamento all'attività fisica, sulla preparazione al lavoro, sul trattamento chirurgico tempestivo di pazienti con difetti cardiaci complessi. A tutti i pazienti durante la fase attiva dei reumatismi viene mostrata la penicillina (1-200 UI per 000 dosi al giorno, ogni 1 ore), che ha un effetto battericida su tutti i tipi di streptococco A. Il corso del trattamento è di 500 settimane durante la fase attiva dei reumatismi, in futuro è necessario un trasferimento al farmaco prolungato bicillina-000 (6 unità). Con l'intolleranza alla penicillina, può essere prescritta l'eritromicina 4 mg 2 volte al giorno. I farmaci con effetto antinfiammatorio, che vengono utilizzati nel moderno trattamento della fase attiva dei reumatismi, sono glucocorticosteroidi, salicilici, derivati dell'indolo, derivati dell'acido fenilacetico, ecc. Il prednisolone viene utilizzato a 20-30 mg al giorno (per 2 settimane, quindi la dose viene ridotta di 2,5-5 mg ogni 5-7 giorni, in totale per un ciclo di 1,5-2 mesi) per primari e ricorrenti con III e II attività di grado del processo di cardiopatia reumatica, con poliserosite e corea, con lo sviluppo di insufficienza cardiaca dovuta a cardite attiva. In quest'ultimo caso si preferisce il triamcinolone alla dose di 12-16 mg al giorno, poiché ha poca capacità di perturbare l'equilibrio elettrolitico. Gli agenti corticosteroidi influenzano il metabolismo del sale idrico, pertanto nel trattamento devono essere utilizzati cloruro di potassio 3-4 g / die, panangina e altri, con ritenzione di liquidi - antagonisti dell'aldosterone (veroshpiron fino a 6-8 compresse al giorno), diuretici (lasix 40 -80 mg / die, furosemide 40-80 mg / die, ecc.), con euforia - tranquillanti, ecc. Anche i farmaci antinfiammatori non steroidei sono ampiamente utilizzati per i reumatismi: le dosi medie di acido acetilsalicilico sono 3-4 g al giorno, meno spesso 5 g al giorno o più. Indicazioni per l'uso dei salicilati: 1) grado minimo di attività, lieve gravità della cardite, principalmente miocardite; 2) trattamento a lungo termine dei reumatismi, sospetto di un decorso latente; 3) trattamento prolungato con una diminuzione dell'attività del corso del processo e la cessazione dell'uso di corticosteroidi, nonché dopo il completamento del trattamento in ospedale; 4) cardiopatie reumatiche ricorrenti che si verificano sullo sfondo di gravi difetti cardiaci e insufficienza circolatoria, poiché i salicilati non sono in grado di trattenere i liquidi, prevenire la formazione di coaguli di sangue e sono stimolanti del centro respiratorio; 5) ridurre la probabilità di esacerbazione dei reumatismi nei periodi primaverili e autunnali, nonché dopo aver subito infezioni intercorrenti (insieme agli antibiotici). L'acido acetilsalicilico viene utilizzato 1 g 3-4 volte al giorno dopo i pasti per 1-3 mesi o più con tolleranza normale e soggetto a controllo degli effetti collaterali. L'uso di successo del derivato dell'acido indolacetico - indometacina nei reumatismi da oltre 20 anni. Ha un pronunciato effetto terapeutico: i sintomi soggettivi della cardite (cardialgia, palpitazioni, mancanza di respiro) scompaiono entro l'8-10° giorno di terapia e i segni oggettivi - entro il 14-16° giorno. La scomparsa della poliartrite e della poliserosite avviene ancora più velocemente. Nel trattamento dei reumatismi è importante la combinazione di tre fasi principali: ospedale - clinica - resort. In ospedale, il trattamento viene effettuato con i farmaci sopra elencati. Dopo aver ridotto l'attività dei reumatismi e normalizzato le condizioni del paziente, vengono trasferiti allo stadio II - trattamento in un sanatorio reumatologico. L'obiettivo principale di questa fase è la continuazione del trattamento con farmaci antinfiammatori non steroidei, selezionati individualmente in ospedale, derivati dell'aminochinolina, bicillina-5, riabilitazione. La fase III include l'osservazione del dispensario e il trattamento preventivo. Si tratta dell'attuazione di misure terapeutiche volte all'eliminazione definitiva del decorso attivo del processo reumatico; condurre un trattamento sintomatico dei disturbi circolatori in pazienti con malattie cardiache; risolvere i problemi della riabilitazione, della capacità lavorativa e dell'occupazione; attuazione della prevenzione primaria dei reumatismi e prevenzione secondaria delle recidive della malattia. CONFERENZA N. 2. Malattie del sistema cardiovascolare. Cardiomiopatia. Cardiomiopatia dilatativa 1. Cardiomiopatia Cardiomiopatia - lesioni miocardiche primarie isolate di natura non infiammatoria ad eziologia sconosciuta (idiopatica), non sono associate a difetti valvolari o shunt intracardiaci, ipertensione arteriosa o polmonare, malattia coronarica o malattie sistemiche (quali: collagenosi, amiloidosi, emocromatosi, ecc.), e nella fase finale della malattia si sviluppano grave insufficienza cardiaca congestizia e complessi disturbi del ritmo cardiaco e della pervietà. La classificazione delle cardiomiopatie è la seguente: 1) cardiomiopatia dilatativa: a) idiopatico; b) tossico; c) infettivo; d) con collagenosi; 2) ipertrofico; 3) restrittivo; 4) displasia aritmica del ventricolo destro; 5) una combinazione di uno dei 4 tipi di cardiomiopatie con ipertensione arteriosa. 2. Cardiomiopatia dilatativa La cardiomiopatia dilatativa (DCM) è una malattia del muscolo cardiaco caratterizzata da un'espansione diffusa di tutte le camere del cuore (principalmente il ventricolo sinistro), in cui è in primo piano la patologia della funzione di pompaggio del cuore e, di conseguenza , insufficienza cardiaca cronica (da cui il secondo nome è congestizia, quando il cuore non è in grado di pompare completamente il sangue e "ristagna" nei tessuti e negli organi del corpo). La parete muscolare del cuore rimane invariata o ipertrofica in varia misura. Le malattie ei fattori che hanno preceduto lo sviluppo del DCM sono descritti nella tabella seguente (vedi Tabella 5). Tabella 5 Malattie e fattori che hanno preceduto lo sviluppo del DCMP
Questa è la forma più comune di danno al muscolo cardiaco. L'incidenza è di 5-8 casi ogni 100 persone all'anno. Non esiste una chiara storia familiare per questi pazienti. Gli uomini si ammalano 000-2 volte più spesso delle donne. patogenesi. Come risultato del processo infiammatorio nel muscolo cardiaco (miocardite), si verifica la morte delle singole cellule nelle sue varie parti. In questo caso, l'infiammazione è di natura virale e le cellule colpite dal virus diventano agenti estranei per il corpo. Di conseguenza, quando gli antigeni compaiono nel corpo, si sviluppa un complesso di reazioni immunitarie volte alla loro distruzione. A poco a poco, le cellule muscolari morte vengono sostituite dal tessuto connettivo, che non ha la capacità di estensibilità e contrattilità insita nel miocardio. A causa della perdita delle funzioni miocardiche di base, il cuore perde la capacità di funzionare come una pompa. In risposta a ciò (come reazione compensatoria), le camere del cuore si espandono (cioè si dilatano) e nella restante parte del miocardio si verifica un ispessimento e compattamento (cioè si sviluppa la sua ipertrofia). Per aumentare l'apporto di ossigeno agli organi e ai tessuti del corpo, si verifica un aumento persistente della frequenza cardiaca (tachicardia sinusale). Questa risposta compensatoria migliora solo temporaneamente la funzione di pompaggio del cuore. Tuttavia, le possibilità di dilatazione e ipertrofia del miocardio sono limitate dalla quantità di miocardio vitale e sono individuali per ogni caso specifico della malattia. Con il passaggio del processo allo stadio di scompenso, si sviluppa un'insufficienza cardiaca cronica. Tuttavia, in questa fase, entra in gioco un altro meccanismo compensatorio: i tessuti del corpo aumentano l'estrazione di ossigeno dal sangue rispetto a un corpo sano. Ma questo meccanismo è insufficiente, poiché una diminuzione della funzione di pompaggio del cuore porta a una diminuzione dell'apporto di ossigeno a organi e tessuti, necessario per il loro normale funzionamento, mentre aumenta la quantità di anidride carbonica in essi contenuta. In 2/3 dei pazienti nelle cavità dei ventricoli nelle ultime fasi della malattia si formano trombi parietali (a causa di una diminuzione della funzione di pompaggio del cuore, nonché della contrazione irregolare del miocardio nelle camere del cuore), seguito dallo sviluppo di embolia nella circolazione polmonare o sistemica. Alterazioni patologiche e patomorfologiche del cuore. La forma del cuore diventa sferica, la sua massa aumenta da 500 a 1000 g, principalmente a causa del ventricolo sinistro. Il miocardio diventa flaccido, opaco, con evidenti strati biancastri di tessuto connettivo, c'è una caratteristica alternanza di cardiomiociti ipertrofici e atrofici. Al microscopio viene rilevata la fibrosi diffusa, può essere combinata sia con l'atrofia che con l'ipertrofia dei cardiomiociti, in cui vi è un aumento significativo del volume dei nuclei, il numero di mitocondri, l'iperplasia dell'apparato del Golgi, un aumento del numero di miofibrille , libero e associato ai ribosomi del reticolo endoplasmatico, un'abbondanza di granuli di glicogeno. Quadro clinico. Non ci sono segni specifici della malattia. Il quadro clinico è polimorfico ed è determinato da: 1) sintomi di insufficienza cardiaca; 2) disturbi del ritmo e della conduzione; 3) sindrome tromboembolica. Tutti questi fenomeni si sviluppano nella fase terminale della malattia, e quindi il riconoscimento della DCM prima della comparsa di questi sintomi presenta notevoli difficoltà. Nella maggior parte dei casi, la prognosi della malattia è determinata dalla sconfitta del ventricolo sinistro del cuore. Prima dell'inizio dell'insufficienza cardiaca, il DCM è latente. Le lamentele più frequenti di insufficienza cardiaca già insorta sono lamentele relative a prestazioni ridotte, maggiore affaticamento, mancanza di respiro durante lo sforzo e quindi a riposo. Di notte, ha una tosse secca (l'equivalente dell'asma cardiaco), in seguito - tipici attacchi di asma. I pazienti presentano dolore anginoso caratteristico. Con lo sviluppo della congestione nella circolazione sistemica, appare pesantezza nell'ipocondrio destro (a causa di un ingrossamento del fegato), gonfiore delle gambe. diagnostica. Quando si diagnostica la malattia, un segno importante è un significativo ingrossamento del cuore (non ci sono segni di cardiopatia valvolare o ipertensione arteriosa). La cardiomegalia si manifesta con l'espansione del cuore in entrambe le direzioni, determinata dalla percussione, nonché con uno spostamento dell'impulso apicale verso sinistra e verso il basso. Nei casi più gravi si avvertono ritmo di galoppo, tachicardia e suoni di relativa insufficienza delle valvole mitrale o tricuspide. Nel 20% dei casi si sviluppa fibrillazione atriale. La pressione sanguigna è solitamente normale o leggermente elevata (a causa di insufficienza cardiaca). Gli studi biochimici del sangue e delle urine possono rilevare varie sostanze tossiche e carenze vitaminiche. I metodi di ricerca strumentale consentono di rilevare: 1) segni di cardiomegalia; 2) cambiamenti in indicatori di dinamica haemo centrale; 3) disturbi del ritmo e della conduzione. Non ci sono cambiamenti caratteristici sull'ECG o gli spostamenti non sono specifici. Questi sono segni di un aumento delle dimensioni del cuore, disturbi della conduzione sotto forma di blocco del ramo anteriore della gamba sinistra del fascio atrioventricolare (il suo fascio) o un blocco completo della gamba sinistra (15% dei casi ); così come tachicardia sinusale persistente (la frequenza cardiaca supera spesso i 100 battiti al minuto). Il fonocardiogramma conferma i dati auscultatori sotto forma di ritmo di galoppo, una rilevazione abbastanza frequente di soffio sistolico (a causa della relativa insufficienza della valvola mitrale o tricuspide). Con la congestione nella circolazione polmonare, viene rivelato un accento dell'II tono. I raggi X rivelano un aumento significativo dei ventricoli (spesso in combinazione con un moderato aumento dell'atrio sinistro) e un ristagno di sangue nella (piccola) circolazione polmonare. Le violazioni della circolazione polmonare si manifestano con un aumento del pattern vascolare polmonare, così come la comparsa di trasudato nelle cavità pleuriche, che si forma a causa dell'aumento della pressione nei vasi dei polmoni. Il metodo dell'ecocardiografia è uno dei metodi principali nella diagnosi della malattia. L'ecocardiografia aiuta a rilevare la dilatazione di entrambi i ventricoli, l'ipocinesia della parete posteriore del ventricolo sinistro, il movimento paradosso del setto interventricolare durante la sistole. Inoltre, l'ecocardiografia consente di chiarire l'aumento dell'ampiezza del movimento dei lembi invariati della valvola mitrale. Ulteriori studi strumentali non sono obbligatori per fare una diagnosi, tuttavia, i loro risultati consentono di dettagliare il grado dei disturbi emodinamici e la natura dei cambiamenti morfologici nel miocardio. Viene eseguito uno studio radioisotopico del cuore (scintigrafia miocardica) per chiarire lo stato della funzione di pompaggio del cuore e per determinare le zone del miocardio morto. Lo studio degli indicatori dell'emodinamica centrale rivela un basso volume minuto e sistolico (indici minuti e ictus), un aumento della pressione nell'arteria polmonare. Angiocardiograficamente, vengono rilevati gli stessi cambiamenti dell'ecocardiogramma. La biopsia miocardica viva non è informativa per determinare l'eziologia della cardiomiopatia. In alcuni casi, nella biopsia possono essere rilevati un antigene virale o un aumento del contenuto di LDH, nonché una diminuzione della produzione di energia da parte dei mitocondri. Tuttavia, questo metodo chirurgico può essere utilizzato per chiarire l'eziologia della malattia e l'ulteriore terapia. La manipolazione viene eseguita come segue: in anestesia locale, una grande arteria e vena vengono perforate (perforate), quindi uno strumento speciale con piccole forbici all'estremità viene passato lungo il loro percorso verso il cuore. Quando la biopsia miocardica è combinata con l'angiografia coronarica (iniezione di un agente di contrasto nelle arterie coronarie che forniscono il cuore), diventa possibile escludere la malattia coronarica in un paziente come una delle malattie che presenta sintomi simili alla DCM. Questi due studi sono eseguiti sotto il controllo della televisione a raggi X. Diagnosi differenziale. Si esegue principalmente nelle miocarditi e nelle distrofie miocardiche, cioè in quelle condizioni che talvolta vengono irragionevolmente chiamate cardiomiopatie secondarie. La biopsia miocardica fornisce un aiuto significativo nella diagnosi differenziale della cardiomiopatia dilatativa e delle malattie cardiache, che si verificano con un pronunciato aumento di essa: 1) con miocardite diffusa grave, l'infiltrazione cellulare dello stroma si trova in combinazione con alterazioni distrofiche e necrotiche nei cardiomiociti; 2) con amiloidosi primaria che si manifesta con danno cardiaco (la cosiddetta variante cardiopatica dell'amiloidosi primaria), vi è una significativa deposizione di amiloide nel tessuto interstiziale del miocardio, combinata con l'atrofia delle fibre muscolari; 3) con emocromatosi (una malattia causata da una violazione del metabolismo del ferro), nel miocardio si trovano depositi di pigmento contenente ferro, vari gradi di distrofia e atrofia delle fibre muscolari e si osservano la proliferazione del tessuto connettivo. Come variante del DCM, possono essere considerate cardiomiopatie indotte da farmaci e tossiche. Numerosi agenti possono causare danni tossici al miocardio: etanolo, emetina, litio, cadmio, cobalto, arsenico, isoproterenolo e altri veleni. I cambiamenti istopatologici nei tessuti del muscolo cardiaco appaiono come distrofie focali. In futuro si verifica lo sviluppo di microinfarti, accompagnato da una reazione infiammatoria periferica. L'esempio più eclatante di cardiomiopatia tossica è la cardiomiopatia, che si verifica nelle persone che consumano birra in eccesso. È dovuto alla presenza di cobalto al suo interno, che viene aggiunto alla birra per migliorare la schiuma. Il cobalto blocca l'azione della vitamina B1, e influenza anche direttamente il cambiamento nei processi enzimatici della cellula. Nella fase acuta del decorso della cardiomiopatia da cobalto, si nota la presenza di degenerazione idropica e grassa, distruzione degli organelli intracellulari e necrosi focale dei cardiomiociti. In futuro si sviluppa una fibrosi interstiziale diffusa o a piccola focale, il risultato finale è la formazione di estese cicatrici. La cardiomiopatia da cobalto è più grave della cardiomiopatia alcolica. Se la diagnosi viene effettuata in tempo, si osserva una cura clinica dei pazienti. Cardiomiopatia alcolica. L'etanolo ha un effetto tossico diretto sui cardiomiociti. Inoltre, con l'intossicazione cronica da etile, c'è spesso una mancanza di nutrizione. È stato dimostrato che l'alcol porta alla comunicazione degli acidi grassi nei cardiomiociti, poiché c'è una mancanza di energia, necessaria per la loro attività. L'acetaldeide, formata durante il metabolismo dell'alcol, può essere un fattore di effetti tossici diretti sulla sintesi proteica. L'alcolismo è anche accompagnato dall'attivazione di virus latenti. Macroscopicamente, il miocardio è flaccido, simile all'argilla, a volte si osservano piccole cicatrici. Le arterie coronarie sono intatte. L'esame microscopico mostra una combinazione di distrofia (idropica e grassa), atrofia e ipertrofia dei cardiomiociti, forse la presenza di focolai di lisi e sclerosi dei cardiomiociti. Le aree interessate del miocardio contrastano con quelle invariate. L'esame al microscopio elettronico di campioni di biopsia cardiaca mostra l'espansione cistica del reticolo sarcoplasmatico e del sistema T dei cardiomiociti, caratteristica della cardiomiopatia alcolica. Complicazioni della cardiomiopatia alcolica - morte improvvisa a causa di fibrillazione ventricolare o insufficienza cardiaca cronica, sindrome tromboembolica. trattamento. La terapia delle cardiomiopatie è un compito difficile, poiché le cause specifiche della loro insorgenza non sono note. I principi generali di trattamento della DCM non differiscono significativamente dal trattamento dell’insufficienza cardiaca cronica. Nei casi di DCM secondario, viene trattata ulteriormente la malattia precedente (malattia della valvola cardiaca, ecc.) e vengono adottate tutte le misure per eliminare le cause del DCM. In sostanza, si può parlare di trattamento di pazienti con cardiomiopatia solo quando compaiono i segni clinici. Nell'insufficienza cardiaca, i glicosidi cardiaci sono inefficaci. I pazienti sviluppano rapidamente intolleranza ai farmaci (intossicazione da glicosidi) e quindi è necessario utilizzare glicosidi che vengono rapidamente escreti dal corpo (strofantina, isolanide). I vasodilatatori periferici sono abbastanza efficaci, specialmente con la concomitante sindrome anginosa (nitrong, sustak, nitrosorbide). Questi farmaci dovrebbero essere prescritti per grave insufficienza cardiaca, difficile da trattare con glicosidi e diuretici. Con la sindrome anginosa, diventa necessario utilizzare farmaci antianginosi, preferibilmente nitrati prolungati (sustak, nitrong, nitrosorbide). Gli adrenobloccanti sono efficaci (sono prescritti in assenza di segni di insufficienza cardiaca). Tra i moderni metodi di trattamento chirurgico del DCMP, il più efficace è il trapianto di cuore (trapianto). Tuttavia, le possibilità di effettuare questa operazione sono notevolmente limitate. Per questo, in alternativa al trapianto cardiaco nelle moderne cure, per aumentare l'aspettativa di vita dei pazienti affetti da DCMP, sono stati sviluppati e sono in corso interventi di chirurgia ricostruttiva, volti ad eliminare l'insufficienza delle valvole cardiache mitralica e tricuspide. L'eliminazione operativa dell'insufficienza di queste valvole consente per qualche tempo di "rallentare" l'inizio dello stadio finale della malattia. Un'altra alternativa al trapianto di cuore nei pazienti con DCM è stata l'asportazione parziale del ventricolo sinistro per ridurne le dimensioni (operazione Battista). Non molto tempo fa, per il trattamento dei pazienti con DCMP, sono stati sviluppati modelli speciali di pacemaker che consentono di rendere sincrono il lavoro dei ventricoli del cuore. Ciò porta a un miglioramento del riempimento dei ventricoli del cuore con il sangue e un aumento della funzione di pompaggio del cuore. Un problema separato dovrebbe essere considerato DCM nei bambini, che è 5-10 casi ogni 100 bambini all'anno. È interessante notare che la malattia può svilupparsi in diversi gruppi di età, compresi i bambini. I dati ottenuti nello studio di un gruppo di bambini sono i seguenti: i pazienti hanno ricevuto 000 opzioni terapeutiche (monoterapia con prednisolone, monoterapia con digossina o prednisolone + digossina). L'efficacia del trattamento è stata valutata secondo i seguenti criteri: è stata determinata la frequenza cardiaca prima e dopo il trattamento, la frequenza respiratoria, lo stato della frazione di eiezione e la frazione di contrattilità. L'analisi dei risultati ottenuti mostra che l'effetto maggiore nel trattamento della cardiomiopatia dilatativa nei bambini piccoli si ottiene con una combinazione di corticosteroidi e glicosidi (prednisolone e digossina). Dopo il completamento del ciclo principale del trattamento (prednisolone somministrato 3 mg/kg al giorno per 2 giorni, digossina), si è verificata una marcata diminuzione della frequenza cardiaca, una diminuzione della mancanza di respiro. Sullo sfondo della monoterapia con prednisolone, si verifica una diminuzione della frequenza cardiaca. La monoterapia con digossina porta ad una diminuzione della tachicardia e della dispnea. Data l'impossibilità di prescrivere farmaci citostatici nei bambini piccoli, poiché è stato osservato un numero significativo di complicanze terapeutiche, è più ottimale in pediatria utilizzare glicosidi cardiaci a lunga durata d'azione in combinazione con ormoni corticosteroidi per la cardiomiopatia dilatativa. Профилактика. La prevenzione della DCM prevede l'evitamento di alcol, cocaina e il monitoraggio attento dei parametri cardiaci durante la chemioterapia antitumorale. È utile per indurire il corpo fin dalla tenera età. L'astinenza completa dall'alcol nel DCM alcolico migliora la contrattilità cardiaca e può eliminare la necessità di un trapianto di cuore. Il fatto che nella maggior parte dei casi la diagnosi avvenga nella fase di insufficienza cardiaca può anche portare a risultati negativi nel trattamento. La diagnosi precoce della cardiomiopatia dilatativa può essere effettuata con l'ecocardiografia casuale (di screening), che viene eseguita durante la visita medica annuale, nonché durante l'esame di persone con ereditarietà gravate da questa malattia. È in questo caso che è possibile aumentare l'efficacia del trattamento farmacologico del DCM. CONFERENZA № 3. Malattie del sistema cardiovascolare. Cardiomiopatia ipertrofica La cardiomiopatia ipertrofica (HCM) è una malattia non coronarica del miocardio ventricolare (principalmente di sinistra), caratterizzata da una massiccia ipertrofia delle loro pareti con protrusione del setto interventricolare (IVS) nella cavità del ventricolo destro, che può essere notevolmente ispessita , una diminuzione del volume interno dei ventricoli, una contrattilità normale o aumentata del miocardio ventricolare e un rilassamento alterato (disfunzione diastolica). La più comune è l'ipertrofia isolata del setto interventricolare (stenosi subaortica ipertrofica isolata - IHSS) o della parte apicale dei ventricoli. Classificazione. Classificazione dell'HCM in base alla localizzazione dell'ipertrofia (ED Wigle et al., 1985 con aggiunte). I. Ipertrofia ventricolare sinistra. 1) Ipertrofia asimmetrica, in cui si verifica ipertrofia miocardica delle singole pareti o segmenti dei ventricoli (inclusa ipertrofia IVS - 90% con o senza ostruzione del tratto di efflusso del ventricolo sinistro, medioventricolare - 1%, ipertrofia ventricolare sinistra apicale - 3%, ipertrofia della parete libera ventricolo sinistro e parte posteriore dell'IVS - 1%). 2) L'ipertrofia simmetrica (concentrica) del ventricolo sinistro, quando l'ipertrofia miocardica si estende a tutte le pareti dei ventricoli, si verifica nel 5% dei casi. II. Ipertrofia del pancreas. Nel caso in cui l'ipertrofia miocardica impedisca il normale deflusso di sangue dai ventricoli del cuore, si parla di una forma ostruttiva di HCM. In altri casi, l'HCM non è ostruttivo. eziologia. La malattia può essere congenita o acquisita. L'HCM congenita è ereditata con modalità autosomica dominante. All'interno della stessa famiglia si possono osservare varie forme e varianti di HCM. Molto spesso, l'ipertrofia asimmetrica del setto interventricolare viene ereditata. La forma acquisita di HCM si verifica nei pazienti anziani con una storia di ipertensione arteriosa. La prevalenza è 0,02-0,05%. Le ragioni per lo sviluppo dell'HCM acquisito non sono completamente comprese. Secondo una delle ipotesi proposte, gli individui con HCM acquisita nel periodo prenatale sviluppano un difetto dei recettori adrenergici del cuore coinvolti nella regolazione dell'attività cardiaca, in particolare della frequenza cardiaca. Di conseguenza, la sensibilità alla noradrenalina e ormoni simili, che aumentano la frequenza cardiaca, aumenta in modo significativo, il che influisce sullo sviluppo dell'ipertrofia miocardica in essi e, infine, sull'HCM. Quadro patoistologico. Disposizione disorientata, errata e caotica di cardiomiociti e miofibrille nei cardiomiociti, la fibrosi miocardica è una violazione dell'architettura del muscolo cardiaco. patogenesi. I disturbi emodinamici sorgono a causa della ridotta funzione diastolica del cuore. Durante la diastole, nei ventricoli (soprattutto a sinistra) affluisce sangue in modo insufficiente a causa della loro densità e rigidità, il che porta ad un rapido aumento della pressione telediastolica. Sia l’aumento della rigidità miocardica che l’aumento della pressione intraventricolare causano una minore eiezione di sangue dal ventricolo durante la sistole. Per un'adeguata erogazione di ossigeno agli organi e ai tessuti del corpo (con il normale funzionamento del sistema cardiovascolare), per l'attuazione di qualsiasi carico, il rilascio di sangue dal cuore deve aumentare. Di conseguenza, in risposta al carico, la frequenza cardiaca aumenta. Con lo sviluppo dell'HCM, il riempimento del cuore con il sangue soffre anche a riposo e, con un aumento della frequenza cardiaca durante il periodo di esercizio, ne risente ancora più negativamente. Di conseguenza, non vi è un adeguato aumento della funzione di pompaggio del cuore durante l'esercizio in HCM. L'attività fisica nell'HCM influisce sull'aumento della pressione intraventricolare, che porta ad un aumento della pressione nell'atrio superiore sinistro, nonché nei vasi della piccola circolazione (polmonare). In queste condizioni si sviluppano iperfunzione e ipertrofia dell'atrio sinistro e, successivamente, ipertensione polmonare ("passiva"). Di conseguenza, si verifica mancanza di respiro, che è proporzionale al grado di carico. Poiché durante l'esercizio l'espulsione del sangue dal ventricolo sinistro non corrisponde all'aumento del carico, il flusso sanguigno nelle arterie coronarie che alimentano il muscolo cardiaco stesso inizia a soffrire per primo. Svolge un ruolo importante e il fatto che nell'HCM vi sia una discrepanza tra una massa significativa di miocardio ipertrofico e la possibilità di afflusso di sangue coronarico, che rimane lo stesso delle persone sane. La diminuzione del flusso sanguigno attraverso le arterie coronarie porta alla comparsa di angina pectoris nella metà e nella metà sinistra del torace, che si irradia al braccio sinistro, sotto la scapola sinistra. Come la mancanza di respiro, l'angina pectoris è provocata dallo sforzo fisico. In alcuni casi di HCM durante l'esercizio, anche l'afflusso di sangue cerebrale si deteriora, causando sincope. Va notato che per ridurre l'aumento della pressione intraventricolare durante l'esercizio, esiste un meccanismo compensatorio, il cui funzionamento si basa sul fatto che la cavità dell'atrio sinistro si espande e lo spessore delle sue pareti aumenta. Di conseguenza, c'è un ulteriore riempimento del ventricolo sinistro con sangue durante l'esercizio. Tuttavia, questa è solo una compensazione temporanea dovuta al fatto che la riserva dell'atrio sinistro come "pompa" è insignificante e una significativa espansione della cavità dell'atrio sinistro porta allo sviluppo della fibrillazione atriale. Quadro clinico. L'HCM è caratterizzata da un'estrema varietà di sintomi, che causano diagnosi errate. La presenza e la tempistica dei reclami nell'HCM sono determinati principalmente da 2 fattori: la forma dell'HCM e la posizione della lesione. La camera più potente del cuore è il ventricolo sinistro, quindi, con l'ipertrofia delle pareti del miocardio, i disturbi potrebbero non comparire per molto tempo. Il danno isolato al ventricolo destro del cuore è estremamente raro. Nella forma non ostruttiva di HCM, quando nulla interferisce con il deflusso del sangue dal ventricolo, il paziente potrebbe non presentare alcun reclamo. A volte possono esserci mancanza di respiro (con uno sforzo fisico significativo), interruzioni nel lavoro del cuore e battito cardiaco irregolare. Nella forma ostruttiva dell'HCM, l'espulsione del sangue dal cuore durante l'esercizio è significativamente ridotta a causa della presenza di un'ostruzione al deflusso del sangue dal ventricolo. In questo caso, i disturbi tipici sono mancanza di respiro da sforzo, angina pectoris e svenimento. La malattia è caratterizzata da una lenta progressione dei disturbi dal momento della sua insorgenza. A causa della somiglianza dei disturbi (dolore nella regione del cuore e dietro lo sterno) e dei dati degli studi (forte soffio sistolico), la cardiopatia reumatica e la malattia coronarica sono spesso diagnosticate erroneamente. Il quadro clinico dell'HCM è: 1) segni di ipertrofia miocardica ventricolare (principalmente a sinistra); 2) un segno di funzione ventricolare diastolica insufficiente; 3) segni variabili di ostruzione del tratto di efflusso del ventricolo sinistro. diagnostica. Nel processo di ricerca diagnostica, il più significativo è il rilevamento del soffio sistolico, del polso alterato e dell'impulso apicale spostato. L'immagine auscultatoria del cuore nei pazienti con HCM ostruttiva ha una serie di caratteristiche: il suono massimo del soffio sistolico (soffio di espulsione) è determinato nel punto Botkin e all'apice del cuore, la gravità del soffio è proporzionale a il grado di ostruzione, la sua intensificazione si verifica quando il paziente si alza bruscamente, così come durante il test di Valsalva; II tono è sempre conservato; il rumore non viene effettuato sui vasi del collo. Il polso è generalmente alto e veloce. Ciò è dovuto all'assenza di restringimento nei tratti di efflusso dal ventricolo sinistro all'inizio della sistole, ma poi, con la contrazione di muscoli potenti, appare un restringimento "funzionale" dei tratti di efflusso, a seguito del quale il polso l'onda diminuisce prematuramente. Il battito apicale in circa 1/3 dei casi ha carattere “doppio”: dapprima, alla palpazione, si avverte un colpo dalla contrazione dell'atrio sinistro, poi dalla contrazione del ventricolo sinistro. Per la comodità di identificare questa proprietà del battito apicale, la palpazione viene eseguita al meglio con il paziente sdraiato sul fianco sinistro. Per la diagnosi di HCM, i dati dell'ecocardiografia sono della massima importanza, consentendo di chiarire le caratteristiche anatomiche della malattia, la gravità dell'ipertrofia miocardica, l'ostruzione del tratto di efflusso del ventricolo sinistro. Si rivelano i seguenti segni: ipertrofia asimmetrica dell'IVS, più pronunciata nel terzo superiore, sua ipocinesi; movimento sistolico del lembo anteriore della valvola mitrale nella direzione anteriore; contatto del lembo anteriore della valvola mitrale con l'IVS in diastole. Segni aspecifici sono: ipertrofia dell'atrio sinistro, ipertrofia della parete posteriore del ventricolo sinistro, diminuzione della velocità media della copertura diastolica del lembo anteriore della valvola mitrale. All'ECG, qualsiasi cambiamento specifico si trova solo con ipertrofia ventricolare sinistra sufficientemente sviluppata. Registrando un ECG per 24 ore (monitoraggio Holter), vengono rilevati i disturbi del ritmo cardiaco esistenti. Un test ECG con attività fisica dosata utilizzando un ergometro o un tapis roulant consente di valutare la gravità dei sintomi della malattia, la sua prognosi e sviluppare un trattamento appropriato. L'ipertrofia isolata dell'IVS provoca un aumento dell'ampiezza dell'onda Q nelle derivazioni toraciche sinistre (V5-6), che complica la diagnosi differenziale con alterazioni focali dovute all'infarto del miocardio. Tuttavia, una piccola larghezza dell'onda Q consente di escludere un infarto del miocardio. Nel processo di sviluppo del sovraccarico emodinamico dell'atrio sinistro, l'ECG può mostrare segni di ipertrofia atriale sinistra: allargamento dell'onda P per più di 0,10 s, un aumento nella sua ampiezza, la comparsa di un'onda P bifasica nella derivazione V1 con la seconda fase aumentata in ampiezza e durata. La diagnostica a raggi X è importante solo nella fase avanzata della malattia, quando è possibile determinare un aumento del ventricolo sinistro e dell'atrio sinistro, un'espansione della parte discendente dell'aorta. Sul fonocardiogramma vengono conservate le ampiezze dei toni I e II, che è un segno differenziale di HCM dalla stenosi dell'orifizio aortico e viene rilevato anche un soffio sistolico di varia gravità. I metodi di ricerca invasivi (sondaggio delle parti sinistre del cuore, angiografia con contrasto) non sono attualmente obbligatori, poiché l'ecocardiografia fornisce informazioni abbastanza affidabili per fare una diagnosi. Tuttavia, a volte questi metodi vengono utilizzati in casi controversi per chiarire la diagnosi o per preparare i pazienti all'intervento chirurgico. Il sondaggio cardiaco viene utilizzato sotto il controllo della televisione a raggi X. Tecnica di esecuzione del metodo: perforando una grande arteria in anestesia locale con l'ulteriore introduzione di un apposito catetere nella cavità cardiaca, si misura il gradiente di pressione (differenza) tra il ventricolo sinistro e l'aorta in partenza da esso. Normalmente, questo gradiente non dovrebbe essere. Tuttavia, con l'HCM, c'è una differenza di pressione tra il ventricolo sinistro e l'aorta da 50 a 150 mm Hg. Art., un aumento della pressione telediastolica nella cavità del ventricolo sinistro fino a 18 mm Hg. Arte. Il gradiente di pressione diminuisce dopo l'introduzione dei β-bloccanti. Inoltre, durante il sondaggio del cuore, un agente di contrasto viene iniettato nella cavità del ventricolo (ventricolografia) per studiarne le caratteristiche anatomiche. In un certo numero di pazienti (di norma si tratta di persone di età superiore ai 40 anni), l'angiografia delle arterie coronarie (angiografia coronarica) viene utilizzata contemporaneamente prima dell'intervento chirurgico al cuore per chiarire l'eziologia dell'angina pectoris ed escludere una concomitante malattia coronarica. trattamento. La base del trattamento farmacologico per l’HCM sono i farmaci che migliorano il flusso sanguigno ai ventricoli del cuore in diastole. Questi farmaci sono un gruppo di β-bloccanti (anaprilina, atenololo, metoprololo e propranololo, 160-320 mg/die, ecc.) e un gruppo di antagonisti degli ioni calcio (verapamil, ma con cautela). Novokinamid e disopiramide riducono anche la frequenza cardiaca e hanno un effetto antiaritmico. All'inizio del trattamento vengono utilizzate piccole dosi di questi farmaci, quindi il dosaggio viene gradualmente aumentato fino al massimo tollerato dal paziente. I β-bloccanti sono usati con cautela nel diabete mellito, nell'asma bronchiale e in alcune altre malattie. Durante il trattamento con questi farmaci, è necessario un monitoraggio costante della pressione sanguigna e della frequenza cardiaca. Pericoloso è una diminuzione della pressione al di sotto di 90/60 mm Hg. Arte. e frequenza cardiaca inferiore a 55 al minuto. Se un paziente presenta aritmie pericolose che non possono essere trattate con β-bloccanti o calcio-antagonisti, nel trattamento di tali pazienti vengono utilizzati anche altri farmaci antiaritmici. La nomina di anticoagulanti è raccomandata per le aritmie parossistiche e la fibrillazione atriale, nonché in presenza di coaguli di sangue nelle camere cardiache (warfarin, ecc.). Durante il periodo di trattamento con questi farmaci, è necessario monitorare regolarmente una serie di indicatori del sistema di coagulazione del sangue. Con un sovradosaggio significativo di anticoagulanti, sono possibili emorragie esterne (nasale, uterina, ecc.) E interne (ematomi, ecc.). Il trattamento chirurgico viene eseguito nei pazienti con HCM ostruttiva quando il trattamento medico non è efficace o quando il gradiente tra il ventricolo sinistro e l'aorta è superiore a 30 mm Hg. Arte. (viene eseguita l'operazione di miotomia o miectomia - escissione o rimozione di una parte del miocardio ipertrofico del ventricolo sinistro). Vengono anche eseguite la sostituzione della valvola mitrale e l'ablazione IVS non chirurgica. Профилактика. Tutti i pazienti affetti da HCM, soprattutto quelli con forma ostruttiva, sono controindicati negli sport che possono aumentare significativamente l'attività fisica in un breve periodo di tempo (atletica leggera, calcio, hockey). La prevenzione della malattia risiede nella diagnosi precoce, che consente di iniziare un trattamento precoce della malattia e prevenire lo sviluppo di una grave ipertrofia miocardica. È obbligatorio eseguire l'ecocardiografia nei parenti genetici del paziente. Importanti per la diagnosi sono anche gli screening ECG ed EchoCG, che vengono effettuati durante la visita medica annuale. Nei pazienti con forma ostruttiva di HCM è necessario prevenire l'endocardite infettiva (profilassi antibiotica, ecc.), poiché la presenza di ostruzione crea le condizioni per lo sviluppo di questa condizione pericolosa per la vita. CONFERENZA № 4. Malattie del sistema cardiovascolare. Cardiomiopatia restrittiva Cardiomiopatia restrittiva (RCMP) - (dalle parole latinestrictio - "restrizione") - un gruppo di malattie del miocardio e dell'endocardio, in cui, a causa di fibrosi pronunciata e perdita di elasticità, a causa di vari motivi, c'è una restrizione fissa nel riempimento dei ventricoli in diastole. Il riempimento dei ventricoli viene effettuato nella fase di riempimento precoce, seguito dalla stabilizzazione della pressione intraventricolare. La malattia è accompagnata da un insufficiente apporto di sangue al cuore, che porta ulteriormente allo sviluppo di insufficienza cardiaca cronica. La cardiomiopatia restrittiva è la meno studiata e la meno comune di tutte le cardiomiopatie. RCMP include: endocardite fibroplastica parietale di Lefler (trovata in paesi con clima temperato, descritta da W. Loffler et al., 1936) e fibrosi endomiocardica (trovata nei paesi dell'Africa tropicale, descritta da D. Bedford et E. Konstman). In precedenza, erano considerati come due processi patologici indipendenti. Tuttavia, il quadro patomorfologico in queste malattie differisce poco. Причины возникновения РКМП. Первичная РКМП встречается очень редко, и единственной доказанной причиной ее возникновения является так называемый гиперэозинофильный синдром (болезнь Леффлера, лефлеровский париетальный фибропластический эндокардит). Встречается преимущественно у мужчин в возрасте 30-40 лет. При гиперэозинофильном синдроме происходит воспаление эндокарда, со временем завершающееся значительным уплотнением эндокарда и грубым его спаянием с рядом расположенным миокардом, что ведет к резкому снижению растяжимости сердечной мышцы. Для лефлеровского синдрома также характерны персистирующая на протяжении 6 месяцев и более эозинофиллия (1500 эозинофиллов в 1 мм3), danno agli organi interni (fegato, reni, polmoni, midollo osseo). Nella stragrande maggioranza dei casi, l'origine di RCMP è secondaria, per altri motivi, tra i quali i più comuni sono: 1) amiloidosi - una malattia associata a una violazione del metabolismo proteico nel corpo; contemporaneamente, nei tessuti dei vari organi, si forma una proteina anormale (amiloide) che si deposita in grandi quantità; quando il cuore è danneggiato, l'amiloide provoca una diminuzione della sua contrattilità ed estensibilità; 2) emocromatosi - una violazione del metabolismo del ferro nel corpo, accompagnata da un aumento del contenuto di ferro nel sangue, il suo eccesso si deposita in molti organi e tessuti, incluso il miocardio, causando così una diminuzione della sua estensibilità; 3) sarcoidosi - una malattia di eziologia sconosciuta, caratterizzata dalla formazione di ammassi cellulari (granulomi) in organi e tessuti; i polmoni, il fegato, i linfonodi e la milza sono più spesso colpiti; e lo sviluppo di granulomi nel miocardio porta a una diminuzione della sua estensibilità; 4) malattie dell'endocardio (fibrosi endocardica, fibroelastosi endocardica, ecc.), Quando c'è un significativo ispessimento e compattazione dell'endocardio, che porta anche a una forte limitazione dell'estensibilità del miocardio. La fibroelastosi dell'endocardio, in particolare, può verificarsi solo nei bambini; questa malattia non è compatibile con la vita a causa dello sviluppo precoce di una grave insufficienza cardiaca. patogenesi. При РКМП в силу различных причин страдает растяжимость миокарда. Вследствие этого снижается наполнение желудочков кровью, значительно повышается внутрижелудочковое давление. Однако, в отличие от ГКМП, возможность развития компенсаторной гипертрофии миокарда при рестриктивной кардиомиопатии небольшая. Таким образом, через какое-то время происходит застой в легочном круге кровообращения и снижается насосная функция сердца, что приводит к постепенной задержке жидкости в организме, развитию стойких отеков ног, гепатомегалии и асцита. Se la compattazione dell'endocardio si estende alle valvole atrioventricolari (mitrale e tricuspide), ciò è aggravato dallo sviluppo della loro insufficienza e porta anche alla trombosi nelle cavità cardiache a causa della loro ridotta contrattilità ed estensibilità. La diffusione di frammenti di questi coaguli di sangue nel flusso sanguigno può causare tromboembolia e blocco di grandi vasi, infarti degli organi interni. Con la diffusione di inclusioni patologiche del miocardio nella zona del sistema di conduzione del cuore, possono comparire varie violazioni della conduzione dell'impulso cardiaco, accompagnate dallo sviluppo di blocchi. Con RCMP, si osservano abbastanza spesso anche vari tipi di aritmie. Sulla base di quanto sopra, possiamo concludere che la malattia da un punto di vista patogenetico procede in 3 fasi. Stadio I - infiltrazione necrotica - eosinofila del miocardio e di altri organi. Stadio II - trombotico - la formazione di coaguli di sangue nelle cavità dei ventricoli sinistro e destro, lo sviluppo di complicanze tromboemboliche e il graduale ispessimento dell'endocardio principalmente nelle regioni apicali e vicino alle valvole atrioventricolari. Stadio III - fibroso, caratterizzato da ispessimento dell'endocardio fino a diversi millimetri, viene espressa la fibrosi miocardica - principalmente aree subendocardiche. La cavità è parzialmente obliterata a causa di trombi organizzati, si notano fibrosi delle cuspidi della valvola mitrale, rigurgito mitralico. Dilatazione atriale pronunciata. Si osserva una disfunzione diastolica restrittiva. Quadro clinico. Проявления болезни чрезвычайно полиморфны и определяются симптомами нарушения кровообращения в малом или большом круге (в зависимости от преимущественного поражения правого или левого желудочков). I reclami possono essere assenti o possono essere dovuti a congestione nella circolazione polmonare o sistemica. I pazienti di solito si lamentano di mancanza di respiro, che compare per la prima volta durante l'esercizio, e con il progredire della malattia, si osserva mancanza di respiro a riposo. A causa di una diminuzione della funzione di pompaggio del cuore, il paziente lamenta affaticamento e scarsa tolleranza a qualsiasi carico. Nel tempo, si uniscono gonfiore delle gambe, ingrossamento del fegato e idropisia dell'addome. Periodicamente appare un battito cardiaco irregolare e, con lo sviluppo di blocchi persistenti, potrebbero verificarsi svenimenti. La prima fase dello sviluppo della malattia (necrotica) è caratterizzata dalla comparsa di febbre, perdita di peso, tosse, eruzioni cutanee e tachicardia. diagnostica. Распознавание РКМП чрезвычайно трудно. С уверенностью о данной патологии можно говорить только после исключения ряда сходно протекающих заболеваний (таких как идиопатический миокардит типа Абрамова-Фидлера, экссудативный перикардит, клапанные пороки сердца). Quando si esaminano i pazienti con RCMP, si riscontrano sintomi caratteristici dell'insufficienza cardiaca congestizia (edema, epatomegalia e ascite), nonché una pronunciata pulsazione delle vene del collo. Quest'ultimo è dovuto alla difficoltà di afflusso di sangue al cuore a causa della scarsa estensibilità del miocardio. Durante l'auscultazione, il rilevamento di un aumento del cuore, un lieve soffio sistolico tardivo e un forte tono precoce III (dovuto al rapido riempimento dei ventricoli durante la diastole) è di grande importanza. I soffi nel cuore vengono rilevati anche nei pazienti con insufficienza della valvola atrioventricolare. Uno studio ECG rivela una moderata ipertrofia del miocardio ventricolare, nonché vari disturbi del ritmo e della conduzione dell'impulso cardiaco, cambiamenti non specifici nell'onda T dell'ECG. L'ecocardiografia è uno dei metodi più informativi per diagnosticare la malattia; rivela un ispessimento dell'endocardio, un cambiamento nella natura del riempimento dei ventricoli del cuore, una diminuzione della funzione di pompaggio del cuore, il rapido movimento del lembo anteriore della valvola mitrale durante la diastole e il rapido movimento precoce della parete posteriore del ventricolo sinistro verso l'esterno. La risonanza magnetica consente di ottenere informazioni sull'anatomia del cuore, determinare inclusioni patologiche nel miocardio e misurare lo spessore dell'endocardio. Quando si esaminano i parametri dell'emodinamica centrale, viene determinata un'aumentata pressione di riempimento in entrambi i ventricoli e la pressione finale nella sinistra supera quella nel ventricolo destro. La ventricolografia rivela una maggiore contrazione del ventricolo sinistro, contorni lisci delle sue pareti, a volte con un difetto di riempimento all'apice (prova di obliterazione). In alcuni casi vengono determinate depressioni nella regione dei muscoli papillari. Ci sono segni di insufficienza valvolare, in particolare la valvola mitrale o tricuspide. Diagnosi differenziale. При дифференциальной диагностике РКМП очень важно учитывать сходство заболевания по внешним проявлениям с констриктивным перикардитом, но методика лечения при этих заболеваниях диаметрально противоположная. Прижизненная биопсия миокарда и эндокарда обычно применяется одновременно с зондированием сердца, что позволяет обладать большей информативностью для уточнения природы заболевания и проведения дальнейшего лечения. В крайне редких случаях, когда вышеперечисленные методы диагностики не позволяют отличить РКМП от констриктивного перикардита, проводят непосредственную ревизию перикарда на операционном столе. Tutti i pazienti con RCMP necessitano di un esame clinico, biochimico e aggiuntivo completo per determinare le cause non cardiache della malattia. trattamento. Лечение заболевания представляет значительные трудности. Большинство лекарственных средств, которые используются для лечения сердечной недостаточности, могут не приносить желаемых результатов в связи с тем, что вследствие особенностей заболевания невозможно получить значительное улучшение растяжимости миокарда (в некоторых случаях для этих целей назначают антагонисты ионов кальция). Используются мочегонные препараты (альдактон) для устранения избытка жидкости в организме. Для ликвидации стойких нарушений проводимости может возникнуть необходимость в постановке (имплантации) постоянного электрокардиостимулятора. Ciò è causato da malattie come la sarcoidosi e l'emocromatosi, che portano allo sviluppo di RCMP secondario, sono soggette ad autotrattamento. Nel trattamento della sarcoidosi vengono utilizzati farmaci ormonali (prednisolone, ecc.) E nell'emocromatosi, un regolare salasso (per ridurre la concentrazione di ferro nel corpo). Il trattamento dell'amiloidosi miocardica dipende direttamente dalle cause della sua insorgenza. Si consiglia di utilizzare farmaci anticoagulanti per la trombosi nelle camere del cuore. Si ricorre al trattamento chirurgico nei casi di RCMP causato da danno endocardico. Durante l'operazione, se possibile, viene asportata la parte dell'endocardio che ha subito modifiche. In alcuni casi, se c'è insufficienza delle valvole atrioventricolari, viene eseguita la loro protesi. Alcune forme di danno miocardico amiloide vengono trattate con un trapianto di cuore. Профилактика РКМП. К сожалению, профилактические меры при данном заболевании ограничены. Главным образом, необходимо раннее выявление потенциально устранимых причин амилоидоза, саркоидоза, гемохроматоза и др. Для достижения этих целей большое значение имеет проведение ежегодной диспансеризации населения. CONFERENZA N. 5. Malattie del sistema cardiovascolare. Endocadite infettiva Endocardite infettiva (IE) - una malattia consistente in una lesione poliposi-ulcerativa dell'apparato valvolare del cuore (spesso con lo sviluppo di insufficienza valvolare) o dell'endocardio parietale (meno spesso è interessato l'endotelio dell'aorta o la grande arteria più vicina). La malattia è causata da vari microrganismi patogeni ed è accompagnata da una lesione sistemica degli organi interni (reni, fegato, milza) sullo sfondo di un'alterata reattività dell'organismo. Finora, in varie pubblicazioni a stampa, i termini precedentemente utilizzati "endocardite batterica", "endocardite settica prolungata" possono essere trovati per riferirsi a questo processo patologico. Tuttavia, è stato il termine "endocardite infettiva" a sostituirli a riflettere meglio la causa della malattia causata da un'ampia varietà di microrganismi: agenti batterici, rickettsie, virus e funghi. Il numero di pazienti con IE è in aumento in tutto il mondo. Ciò è dovuto alla presenza dei cosiddetti gruppi a rischio (pazienti con lesioni valvolari aterosclerotiche, reumatiche, traumatiche, difetti cardiaci o valvolari, difetto del setto ventricolare, coartazione aortica) in conseguenza del fatto che l'infezione si manifesta più facilmente a livello patologico valvola o endocardio alterati. eziologia. Патогенными возбудителями болезни наиболее часто являются кокковая группа микроорганизмов - стрептококки (зеленящий стрептококк ранее выделялся в 90 % случаев), стафилококки (золотистый, белый), энтерококк, пневмококк. В последние годы в связи с широким использованием антибиотиков спектр микробных возбудителей стал другим. Болезнь может вызывать грамотрицательная флора (кишечная палочка, синегнойная палочка, протей, клебсиелла), появились данные о важной роли патогенных грибов, сарцин, бруцелл и вирусов. Заболевания, вызванные этими возбудителями, протекают тяжелее, особенно эндокардит, вызванный грибковой инфекцией (возникает, как правило, в связи с нерациональным приемом антибиотиков). Однако у ряда больных истинный возбудитель заболевания не обнаруживается (частота отрицательного результата посева крови 20-50 %). Spesso, l'infezione si verifica nel sito di una protesi valvolare - la cosiddetta protesica IE, che si sviluppa principalmente entro 2 mesi dall'intervento chirurgico di sostituzione della valvola cardiaca. In questo caso, l'agente eziologico della malattia ha spesso una natura streptococcica. Pertanto, le fonti di infezione e batteriemia nell'IE sono molto diverse (interventi chirurgici nel cavo orale, operazioni e procedure diagnostiche nell'area urogenitale, intervento chirurgico sul sistema cardiovascolare (compresa la sostituzione della valvola), permanenza prolungata del catetere in vena, frequenti infusioni endovenose e metodi di ricerca endoscopica, emodialisi cronica (shunt arterovenoso), somministrazione endovenosa di farmaci). Esistono le cosiddette IE primarie, che si sono sviluppate su valvole intatte, così come IE sullo sfondo di alterazioni congenite e acquisite nel cuore e nel suo apparato valvolare - endocardite secondaria. Questi cambiamenti consentono di distinguere i pazienti in gruppi di rischio separati: difetti cardiaci (congeniti e acquisiti), prolasso della valvola mitrale, aneurismi artero-venosi, aneurismi post-infartuati, shunt, condizione dopo l'intervento chirurgico sul cuore e sui grandi vasi. patogenesi. Механизм развития ИЭ сложен и изучен недостаточно, однако можно выделить основные моменты в развитии заболевания. Se c'è un focolaio di infezione nel corpo sotto l'influenza dell'immunità umorale e locale (cellulare) alterata con una perversione delle reazioni immunologiche, vari fattori endogeni ed esogeni, si sviluppa batteriemia. Dal sangue, i microrganismi entrano nelle valvole cardiache, creando lì un focus secondario di infezione. La fissazione e la riproduzione di microrganismi sull'endocardio è facilitata da una serie di fattori: un precedente cambiamento nel tessuto e nella superficie della valvola, la presenza di masse trombotiche su di essa, che si verificano sotto l'influenza dell'effetto dannoso diretto del flusso sanguigno quando la sua circolazione intracardiaca cambia in condizioni di cardiopatia esistente. Allo stesso tempo, varie cellule del sangue (piastrine, ecc.) Si "incollano" sul sito della lesione traumatica, formando escrescenze cellulari simili a ghiaccioli appesi alla valvola. Queste vegetazioni diventano disponibili per l'infezione che è entrata nel letto vascolare. La deformazione delle valvole dovuta al verificarsi di un ampio gradiente di pressione, la ristrettezza del foro e le variazioni della velocità del flusso sanguigno contribuiscono anche all'introduzione di agenti infettivi nell'endocardio con la formazione di un focolaio infettivo. Quando una valvola precedentemente intatta è danneggiata, si verificano cambiamenti che interrompono le normali proprietà delle singole sezioni di questa valvola (appare gonfiore), processi essudativi o proliferativi ("valvulite interstiziale" - fase preclinica). Nello sviluppo della malattia si può distinguere lo stadio III. Lo stadio I (infettivo-tossico) procede con vari gradi di gravità dell'intossicazione. C'è una crescita di batteri, la distruzione delle valvole, che porta allo sviluppo di malattie cardiache; nella stessa fase, il processo è spesso generalizzato a causa della diffusione ematogena dell'infezione: pezzi di cuspidi o colonie di microrganismi possono separarsi dalla valvola, le cuspidi possono rompersi. Il distacco di frammenti di vegetazione microbica valvolare contribuisce all'introduzione di emboli infetti in varie parti del letto vascolare ed esacerba le manifestazioni settiche. Pezzi della valvola o vegetazioni microbiche circolano attraverso il corpo con il flusso sanguigno, quando entrano nel cervello provocano infarti cerebrali, che sono accompagnati da paralisi, paresi e vari altri disturbi neurologici. La valvola, che ha subito la distruzione, non può svolgere la sua funzione e presto si verifica un'insufficienza cardiaca in rapido sviluppo. Stadio II - immuno-infiammatorio, in cui i microrganismi fissati sulle valvole causano un'autosensibilizzazione prolungata e un danno iperergico agli organi e ai tessuti del corpo (generalizzazione immunitaria del processo). Durante questo periodo, gli immunocomplessi circolano nel sangue e si fissano nei tessuti (cuore, reni, fegato, vasi sanguigni). I disordini immunitari e autoimmuni causano lo sviluppo di vasculite e viscerite (nefrite immunocomplessa, miocardite, epatite, capillare, ecc.). Lo stadio III - distrofico - si verifica con la progressione del processo patologico: le funzioni di un certo numero di organi sono disturbate, si verifica insufficienza cardiaca e renale, aggravando ulteriormente il decorso della malattia. Classificazione. В настоящее время используются классификация и номенклатура ИЭ, отражающие клиническую форму, вариант течения, степень активности, патогенетическую фазу и клинико-морфологическую форму болезни (см. табл. 6). Tabella 6 Classificazione di IE
Viene inoltre fatta una distinzione tra IE attivo e inattivo (guarito). Esiste anche una classificazione chirurgica, in cui sono presenti: 1) la lesione è limitata ai lembi valvolari; 2) la lesione si estende oltre la valvola. L'IE acuta (rapidamente progressiva, si sviluppa in 8-10 settimane) è rara, di solito in persone che non hanno precedentemente avuto malattie cardiache, e si manifesta clinicamente con un quadro di sepsi generale. Con i moderni metodi di trattamento, è possibile tradurlo in subacuto. L'IE subacuta (più comune) dura 3-4 mesi, con un'adeguata terapia farmacologica può verificarsi la remissione. Tuttavia, sono possibili ricadute della malattia. L'IE prolungata dura molti mesi con periodi di esacerbazione e remissione, è caratterizzata da manifestazioni cliniche lievi, parametri di laboratorio minori e disturbi generali. La malattia di solito risponde bene al trattamento. Con un decorso sfavorevole, si verificano gravi complicazioni e i pazienti muoiono per insufficienza cardiaca progressiva, aumentando l'intossicazione settica. Quadro clinico. В зависимости от возбудителя инфекции ИЭ может возникать внезапно и бурно развиваться (золотистый стафилококк, энтерококки) или иметь скрытое начало (зеленящий стрептококк). Проявления ИЭ представлены в виде синдромов. 1) Sindrome da alterazioni infiammatorie e setticemia (febbre, brividi, eruzioni cutanee emorragiche, alterazioni dei parametri ematici della fase acuta: leucocitosi con spostamento a sinistra, aumento della VES, comparsa della proteina C-reattiva, aumento del fibrinogeno, α2-globuline. 2) La sindrome di intossicazione generale del corpo (debolezza, sudorazione, mal di testa, mialgia e artralgia, perdita di appetito, pallore della pelle con una sfumatura itterica). 3) Sindrome da danno valvolare (formazione di malattie cardiache). 4) Sindrome dei disturbi immunitari "di laboratorio" (presenza di immunocomplessi circolanti nel sangue o fissi nei reni, nel miocardio, nei vasi sanguigni; ipergammaglobulinemia; comparsa del fattore reumatoide; rilevamento di anticorpi anti-tessuto). 5) Sindrome da complicanze tromboemboliche (nefrite focale, infarto del miocardio, milza, intestino, tromboembolismo cerebrale, vasi degli arti inferiori, ecc.). 6) Sindrome di generalizzazione delle lesioni (glomerulonefrite diffusa, miocardite, epatite, vasculite, ecc.). La gravità di queste sindromi è diversa. Dipende dalla natura del corso di IE, stadio, tipo di agente patogeno. Ad esempio, l'IE da stafilococco è caratterizzata da un'elevata attività del processo, da gravi sintomi di intossicazione generale e dallo sviluppo di complicanze purulente. L'endocardite fungina è solitamente accompagnata da occlusione embolica delle grandi arterie, in particolare degli arti inferiori. Un quadro tipico della malattia è caratteristico di IE causata da streptococcus viridans. L'insorgenza della malattia è spesso associata a un'infezione acuta o all'esacerbazione di un'infezione cronica, nonché a una serie di manipolazioni mediche. Particolarmente caratteristica è la combinazione di un aumento della temperatura corporea di vari gradi (da febbre prolungata a febbre di basso grado o temperatura normale) con brividi e sudorazione. Il paziente presenta reclami simultanei a causa della presenza di un processo infettivo e di intossicazione, nonché di complicazioni tromboemboliche del danno cardiaco. I pazienti possono avere una storia di episodi di trattamento antibiotico a lungo termine (questo si verifica quando l'IE si ripresenta nei pazienti precedentemente trattati). diagnostica. Наибольшее значение для постановки правильного диагноза имеет обнаружение поражения клапанов сердца по изменению аускультативной картины ранее существовавших пороков сердца; появление "дополнительных" шумов. Выявляются характерные поражения кожи и слизистых оболочек: цвет кожных покровов "кофе с молоком", геморрагии, положительные симптомы Гехта (щипка) и Кончаловского-Румпеля-Лееде (жгута), а также узелки Ослера - болезненные гиперемированные плотные узелки на ладонной поверхности и кончиках пальцев, признак Лукина-Либмана (пятна Лукина) - геморрагия на переходной складке конъюнктивы. Часто наблюдаете при ИЭ спленомегалия. Весьма типична значительная потеря в весе (иногда на 15-20 кг). В редких случаях развивается перикардит (нерезкий шум трения плевры, обусловленный фибринозными наложениями на перикарде). При физикальном обследовании можно выявить повышение артериального давления, указывающее на развитие диффузного гломерулонефрита. Иногда определяются признаки нарушения деятельности центральной нервной системы (парезы, гиперкинезы, патологические рефлексы и т. д.) в результате эмболии мозговых сосудов. In questo caso, l'errore diagnostico più comune è la valutazione di una particolare sindrome come manifestazione di una malattia indipendente (ad esempio, con segni pronunciati di danno epatico, viene diagnosticata l'epatite, ecc.). Tuttavia, la diagnosi di IE si basa principalmente sulla diagnosi precoce dell'agente eziologico della malattia. Per questo vengono utilizzati i seguenti studi di laboratorio e strumentali. 1) Ottenere un'emocoltura positiva è il segno diagnostico più importante di IE. L'analisi è necessaria anche per selezionare l'antibiotico più efficace in questo caso. Almeno 2-3 di loro sono necessari per confermare la diagnosi. Di grande importanza sono la tecnica del prelievo ematico e della coltura, il momento dell'inoculazione (preferibilmente al culmine della febbre), l'uso di mezzi arricchiti. 2) Esecuzione del test NBT (nitrobluttetrazolio) - diagnostico delle infezioni batteriche sistemiche, che consente di differenziare le infezioni batteriche da altre malattie infiammatorie. Il metodo si basa sulla riduzione del colorante NBT solubile da parte dei neutrofili in un precipitato di formazano insolubile. Se il numero di cellule NBT-positive è superiore al 10%, il test è considerato positivo. 3) Esame del sangue clinico per rilevare gli indicatori di fase acuta: è possibile rilevare un aumento della VES a 50 mm / h o più, leucocitosi con uno spostamento della formula dei leucociti a sinistra o (nello stadio II) leucopenia e anemia ipocromica. Il valore diagnostico è associato al rilevamento degli istiociti nel sangue prelevato dal lobo dell'orecchio. Il loro contenuto di più di 6 nel campo visivo può indicare a favore di IE. Un esame del sangue biochimico mostra un aumento del contenuto di fibrinogeno, α2-globuline e α-globuline - fino al 30-40%. 4) Identificazione di alterazioni immunologiche: ipergammaglobulinemia, immunocomplessi circolanti, diminuzione del titolo del complemento, comparsa del fattore reumatoide (antiglobulina), aumento della reazione di trasformazione imperiosa dei linfociti con PHA (fitoemoagglutinina) e antigeni batterici, rilevamento di anticorpi anti-tessuto. 5) L'analisi delle urine viene eseguita per chiarire le lesioni di vari organi e sistemi, quando viene rilevata la glomerulonefrite, manifestata da proteinuria, cilindruria ed ematuria. Un aumento del contenuto di bilirubina, transaminasi indica danno epatico. 6) Un segno diagnostico diretto di IE - la presenza di vegetazione sulle valvole cardiache - viene rilevato dall'ecocardiografia. Pertanto, dall'intera varietà di sintomi, dovrebbero essere distinti quelli principali e aggiuntivi. I criteri principali per la diagnosi di IE: 1) febbre con temperatura superiore a 38°C con brividi; 2) Macchie di Lukin; 3) noduli di Osler; 4) endocardite su valvole invariate (primarie) o sullo sfondo di difetti cardiaci reumatici e congeniti. miocardite infettiva; 5) tromboembolismo arterioso multiplo, rotture di aneurismi micotici con emorragie; 6) splenomegalia; 7) emocoltura positiva; 8) un pronunciato effetto positivo dall'uso di antibiotici. Criteri aggiuntivi per la diagnosi di IE: 1) un aumento della temperatura corporea fino a 38 ° C, agghiacciante; 2) emorragie sulla pelle; 3) rapida perdita di peso; 4) artrite asimmetrica di piccole articolazioni di mani, piedi; 5) anemizzazione; 6) VES superiore a 40 mm/h; 7) SRV nettamente positivo; 8) la presenza del fattore reumatoide; 9) α-globuline superiori al 25%; 10) aumento del contenuto di immunoglobuline M, E e A. Diagnosi differenziale. Хотя тромбоэмболии чаще всего наблюдаются при ИЭ, не следует исключать другие причины эмболии в артерии большого круга кровообращения: трансмуральный инфаркт миокарда и аневризма сердца, идиопатический миокардит Абрамова-Фидлера и мерцательная аритмия различного происхождения, но прежде всего наблюдаемая при ревматическом стенозе левого предсердно-желудочкового отверстия. L'endocardite reumatica e infettiva sono della massima importanza per la diagnosi differenziale (Tabella 7). Tabella 7 Criteri diagnostici differenziali per endocardite reumatica e IE prolungata
I sintomi caratteristici di IE includono un ingrossamento della milza. Tuttavia, nell'amiloidosi si osserva una milza grande, soda e indolore; morbido, indolore indica la sua iperplasia settica. Il dolore è notato con infarto della milza, situato sottocapsularmente. La splenomegalia può essere una delle manifestazioni dell'ipertensione portale nell'insufficienza cardiaca destra. In questo caso, è combinato con ascite ed epatomegalia. Abbastanza spesso si osserva un aumento delle dimensioni del fegato con IE prolungata. L'iperplasia settica è caratterizzata da un ingrandimento relativamente piccolo e da una consistenza morbida del fegato. Ci sono degenerazione grassa ed estremamente raramente - infarti del fegato. Molto spesso, un aumento del fegato è associato a congestione venosa con insufficienza cardiaca destra. In assenza di ascite, la congestione viene riconosciuta retrospettivamente da una diminuzione delle dimensioni del fegato dopo il trattamento con glicosidi cardiaci e diuretici. trattamento. Лечение ИЭ должно быть как можно более ранним и этиотропным с учетом бактериологических данных. До того как антибактериальные препараты нашли свое широкое применение в медицинской практике, большинство больных ИЭ погибали от инфекции и ее осложнений. Сейчас более 80 % успешно излечиваются. Но почти у 20 % медикаментозное лечение неэффективно, и вскоре у них развивается сердечная недостаточность, которая почти не поддается лечению. В связи с этим целесообразно сочетание консервативного и хирургического лечения. Per il trattamento dell'IE in qualsiasi fascia di età, vengono utilizzati principalmente antibiotici che hanno un effetto battericida sui microrganismi, preferibilmente in dosi individualizzate a seconda della concentrazione dell'antibiotico nel sangue e della sensibilità dell'agente patogeno ad esso. Il farmaco di prima scelta è ancora la penicillina. Ha una bassa tossicità, che ne consente l'uso a lungo a dosaggi relativamente elevati. La dose giornaliera - fino a 20 UI viene somministrata per via endovenosa e intramuscolare. Tuttavia, non si deve escludere il fatto che nei pazienti anziani e senili, quando trattati con penicillina e altri antibiotici ad alte dosi, si osserva spesso un effetto cardiotossico: comparsa o intensificazione di insufficienza cardiaca, dolore al cuore, tachicardia. Quando si riduce la dose o si cambia il farmaco, questi fenomeni cessano. Con un'eziologia sconosciuta, il trattamento inizia con dosi elevate di benzilpenicillina per via intramuscolare o endovenosa fino a 18-000 unità o più, una combinazione con streptomicina fino a 000 g/m20 al giorno o aminoglicosidi (gentamicina, tobramicina a una velocità di 000-000 mg / giorno) viene utilizzato kg al giorno). In assenza di effetto o dopo aver determinato l'agente patogeno, vengono utilizzate penicilline semisintetiche (oxacillina, meticillina o ampicillina per via intramuscolare fino a 1 g / die). Le cefalosporine sono anche i farmaci di base usati per trattare l'IE: i più comunemente usati sono claforan, cefamisina (4-6 g/die, per via intramuscolare ed endovenosa), nonché zeporina (12-4 g/die) e kefzol (fino a 10 g/die). -10 g per via endovenosa). ed ecc.). La fusidina ha un buon effetto antistafilococcico, in alcuni casi è efficace nella resistenza dei microrganismi ad altri antibiotici (16-8 g/die). Il trattamento antibiotico viene prescritto a lungo in un corso di 1,5-2 mesi, fino a quando l'infezione non viene completamente eliminata. Dopo l'eliminazione dell'infezione, le condizioni generali del paziente migliorano, la vegetazione scompare secondo l'ecocardiografia e la conferma microbiologica. Con una ridotta immunoreattività dell'organismo, gli agenti antibatterici sono combinati con l'immunoterapia passiva (ad esempio con endocardite da stafilococco - con plasma antistafilococcico o α-globulina antistafilococcica), utilizzando immunomodulatori (timalina, T-attivina, ecc.). Per la prevenzione della trombosi, ad esempio, con l'endocardite che si è sviluppata sullo sfondo della sepsi angiogenica, viene creata un'ipocoagulazione controllata utilizzando l'eparina (20-000 UI per via endovenosa o sottocutanea). Per l'inibizione degli enzimi proteolitici viene utilizzato contrical (fino a 25-000 UI per via endovenosa). Quando l'IE valvolare ha contribuito alla formazione di una cardiopatia valvolare o le manifestazioni della malattia non scompaiono nonostante la massiccia terapia antibiotica, è consigliabile eseguire un trattamento chirurgico. Un ulteriore argomento a favore dell'intervento chirurgico è l'embolia ripetuta dai lembi della valvola cardiaca distrutti dall'infezione. A volte l'infezione va oltre i confini dell'anello della valvola, formando ascessi, che è anche un'indicazione per il trattamento chirurgico. L'obiettivo principale dell'operazione è preservare la valvola del paziente. A volte si limitano alla rimozione di vegetazioni, rotture di sutura delle valvole, ecc. Se la valvola viene quasi completamente distrutta sotto l'influenza dell'infezione, viene sostituita con una artificiale (protesi) mediante protesi meccaniche e biologiche. Профилактика. Профилактика ИЭ заключается в своевременной санации хронических очагов инфекции в полости рта, миндалинах, носоглотке, придаточных пазухах носа, применении активной антибактериальной терапии при острых стрептококковых и стафилококковых заболеваниях (ангинах и др.). Рекомендуется закаливание организма. Tutti i pazienti con cardiopatia valvolare, così come con protesi valvolari, dovrebbero assumere antibiotici a scopo profilattico il giorno prima e subito dopo qualsiasi intervento, dopodiché un'infezione può entrare nel flusso sanguigno. È necessaria l'osservazione dispensaria delle persone che hanno avuto infezioni acute da streptococco e stafilococco. CONFERENZA N. 6. Malattie dell'apparato respiratorio. Asma bronchiale Ad oggi non esiste una definizione esauriente di asma, tuttavia, la definizione più completa di questa malattia è stata data da G. B. Fedoseev nel 1982. L'asma bronchiale (BA) è una malattia ricorrente, cronica e indipendente con una lesione primaria del tratto respiratorio, il cui meccanismo patogenetico principale e obbligatorio è un'alterata reattività bronchiale dovuta a meccanismi specifici (immunologici) e (o) non specifici, congeniti o acquisiti, e il principale segno clinico (obbligatorio) è un attacco d'asma e (o) una condizione asmatica (stato asmatico) per spasmo della muscolatura liscia bronchiale, ipersecrezione, discrinia ed edema della mucosa bronchiale. eziologia. Una combinazione di diversi fattori gioca un ruolo importante nella comparsa dell’asma. A questo proposito, ci sono 2 forme di asma: atopica (dal latino athopia - "predisposizione ereditaria") e infettiva-allergica. La predisposizione ereditaria è dovuta all'associazione di alcuni antigeni di istocompatibilità (HLA) con la gravità dell'asma e un aumento della gravità della malattia è osservato soprattutto nei portatori di antigeni B35 e B40. I fattori interni nello sviluppo della malattia sono difetti biologici del sistema immunitario, endocrino, sistema nervoso autonomo, sensibilità e reattività bronchiale, clearance mucociliare, endotelio vascolare polmonare, sistema di risposta rapida (mastociti, ecc.), metabolismo dell'acido arachidonico, eccetera. I fattori esterni includono: 1) allergeni infettivi (virus, batteri, funghi, lieviti, ecc.); 2) allergeni non infettivi (pollini, polveri, industriali, medicinali, alimentari; allergeni di zecche, insetti e animali); 3) irritanti meccanici e chimici (metallo, legno, silicato, polvere di cotone; vapori di acidi, alcali; fumi, ecc.); 4) fattori meteorologici e fisico-chimici (cambiamenti di temperatura e umidità dell'aria, fluttuazioni della pressione barometrica, campo magnetico terrestre, sforzo fisico, ecc.); 5) stress, effetti neuropsichici e attività fisica. Gli agenti infettivi possono avere non solo un effetto allergenico, ma anche ridurre la soglia di sensibilità del corpo agli allergeni non infettivi (atopici), aumentare la permeabilità della mucosa respiratoria per loro; per formare un cambiamento nella reattività delle cellule bersaglio (mastociti, basofili, monociti, ecc.) e dei sistemi effettori. patogenesi. L'alterata reattività bronchiale rappresenta un anello centrale nella patogenesi della malattia e può essere primaria o secondaria. Nel primo caso, le alterazioni della reattività possono essere congenite o acquisite a causa dell'esposizione diretta a fattori chimici, meccanici, fisici e infezioni. I cambiamenti secondari nella reattività bronchiale sono una manifestazione di cambiamenti nella reattività del sistema immunitario, endocrino e nervoso del corpo. Quindi, parlando della patogenesi dell'AD, possiamo distinguere 2 gruppi di meccanismi: immunologici e non immunologici. I meccanismi immunologici nella stragrande maggioranza dei casi sono dominanti nel corso della malattia. Le violazioni del sistema immunocompetente nella mucosa delle vie respiratorie, che si verificano secondo i tipi I, III e IV di reazioni di ipersensibilità, ad es. con un cambiamento nelle immunità umorali e cellulari, portano a un cambiamento nella reattività bronchiale. Allo stesso tempo, c'è una diminuzione delle IgA secretorie, il sistema di fagocitosi è disturbato, la funzione T-soppressore dei linfociti diminuisce, la produzione di interferone diminuisce, il che alla fine porta a una diminuzione della difesa antivirale del corpo. Tipo I (atopico, reaginico o anafilattico). In risposta all'ingestione di antigeni esoallergeni (polline, proteine animali e vegetali, batteri e farmaci), si verifica un aumento della produzione di IgE (reagine), che si fissano e si accumulano sui mastociti (cellule effettrici primarie). Questa è la fase immunologica dell'AD. Successivamente, si sviluppa la fase patochimica del processo: degranulazione dei mastociti con rilascio di sostanze vasoattive, broncospastiche e chemiotattiche (istamina, serotonina, vari fattori chemiotattici, ecc.). Questi sono mediatori primari che agiscono sui vasi sanguigni e sulle cellule bersaglio (cellule effettrici secondarie) - eosinofili, neutrofili, piastrine, monociti macrofagi. Questi ultimi, quando esposti a mediatori primari, secernono mediatori secondari (leucotrieni, prostaglandine, trombossani, fattore attivante le piastrine e altre sostanze appartenenti al gruppo degli eicosanoidi). Sotto l'influenza di sostanze biologicamente attive, inizia lo stadio fisiopatologico della patogenesi: aumenta la permeabilità del letto microcircolatorio, che porta allo sviluppo di edema, infiammazione sierosa e broncospasmo. Clinicamente, questo si manifesta con una violazione acuta della pervietà bronchiale e lo sviluppo di un attacco d'asma. Una reazione di tipo III (tipo immunocomplesso, o fenomeno di Arthus) si sviluppa sotto l'influenza di esoallergeni ed endoallergeni (autoallergeni, la cui formazione porta alla denaturazione delle proteine dei bronchioli e degli alveoli a causa di un'infiammazione infettiva o allergica e l'azione di vari irritanti). La reazione avviene nella zona dell'antigene in eccesso con la partecipazione di anticorpi precipitanti appartenenti alle immunoglobuline delle classi O e M. L'effetto dannoso del complesso antigene-anticorpo formato si realizza attraverso l'attivazione del complemento, il rilascio di enzimi lisosomiali. Vi sono danni alle membrane basali, spasmo della muscolatura liscia dei bronchi, vasodilatazione e aumento della permeabilità del microcircolo. Il tipo IV (ipersensibilità cellulare, di tipo ritardato) è caratterizzato dal fatto che i linfociti sensibilizzati hanno un effetto dannoso. In questo caso, i mediatori della reazione allergica sono le linfochine (agiscono sui macrofagi, sulle cellule epiteliali), gli enzimi lisosomiali e un sistema di chinine attivato. Sotto l'influenza di queste sostanze, si verificano lo sviluppo di edema, gonfiore della mucosa, broncospasmo, iperproduzione di secrezioni bronchiali viscose. La conseguenza è un'acuta violazione della pervietà dei bronchi, manifestata da un attacco di soffocamento. I meccanismi non immunologici sono il principale cambiamento nella reattività bronchiale a seguito di difetti biologici congeniti e acquisiti. Meccanismi non immunologici agiscono sulle cellule effettrici primarie o secondarie o sui recettori della muscolatura liscia dei bronchi, dei vasi sanguigni, delle cellule delle ghiandole bronchiali. Ciò modifica la reattività delle cellule bersaglio e, soprattutto, dei mastociti, che è accompagnata da un'eccessiva produzione di sostanze biologicamente attive (istamina, leucotrieni, ecc.). In risposta al loro rilascio, si sviluppano broncospasmo, gonfiore della mucosa, iper e discrinia delle ghiandole bronchiali. Tutto questo cambia drasticamente la pervietà dei bronchi e provoca un attacco d'asma. La resistenza bronchiale può cambiare condizionatamente e incondizionatamente come riflesso. Ad esempio, l'ostruzione derivante dall'esposizione all'aria fredda, dall'inalazione di gas e polveri irritanti e dall'attività fisica è causata dal broncospasmo attraverso il riflesso vagale. Le cause del broncospasmo possono anche essere un danno alle zone effettrici del riflesso broncocostrittivo vagale o il blocco dei recettori β-adrenergici. Recentemente, parlano di un ruolo speciale nella patogenesi delle violazioni della pervietà bronchiale dell'insufficienza dei glucocorticoidi e dei disturbi disovari. L'insufficienza di glucocorticosteroidi porta allo sviluppo di iperreattività dei mastociti, a una diminuzione della sintesi di catecolamine e all'attivazione delle prostaglandine F2a, nonché una violazione del sistema immunocompetente (qui parliamo della complessa partecipazione alla patogenesi dell'AD e dei meccanismi immunologici e non immunologici). L'iperestrogenemia e l'ipoprogesteronemia agiscono sui recettori α- e β-adrenergici, aumentando l'attività dei primi e riducendo l'attività dei secondi. Classificazione. La predominanza dell'uno o dell'altro meccanismo nella patogenesi dell'asma ci consente di identificare le sue varie caratteristiche patogenetiche. Attualmente viene utilizzata la classificazione proposta da G. B. Fedoseev (1982). Fasi di sviluppo dell'AD. I - pre-asma (condizioni che minacciano lo sviluppo: bronchite acuta e cronica, polmonite acuta e cronica con elementi di broncospasmo in combinazione con rinite vasomotoria, orticaria). II - BA clinicamente formato (considerato tale dopo il primo attacco o immediatamente all'esordio dello stato asmatico). Moduli BA: 1) immunologico; 2) non immunologico. Meccanismi patogenetici (varianti cliniche e patogenetiche) dell'AD: 1) atopico; 2) dipendente dall'infezione; 3) autoimmune; 4) disordinato; 5) squilibrio neuropsichico; 6) squilibrio adrenergico; 7) squilibrio colinergico; 8) reattività bronchiale alterata primaria. In un paziente è possibile una combinazione di diverse varianti cliniche e patogenetiche. In una situazione del genere, è necessario al momento dell'esame evidenziare la variante principale per questo paziente, che è importante per una terapia adeguata. Nel corso di un lungo corso di BA, è possibile un cambiamento nel meccanismo patogenetico. Gravità di BA: 1) decorso lieve (le esacerbazioni sono rare, 2-3 volte l'anno, gli attacchi di asma a breve termine vengono fermati assumendo vari farmaci broncodilatatori all'interno); 2) moderato (riacutizzazioni più frequenti 3-4 volte l'anno, gli attacchi di asma sono più gravi e interrotti da iniezioni di farmaci); 3) decorso grave (caratterizzato da frequenti e prolungate esacerbazioni, attacchi gravi, che spesso si trasformano in uno stato asmatico). La divisione del BA in base alla gravità del corso è condizionale. Quindi, con un decorso lieve di BA, il paziente può morire per uno stato asmatico sviluppato improvvisamente. Fasi del corso di laurea: 1) esacerbazione (la presenza di attacchi ricorrenti di asma o condizione asmatica); 2) riacutizzazione dell'esacerbazione (gli attacchi diventano più rari e lievi, i segni fisici e funzionali della malattia sono meno pronunciati rispetto alla fase di esacerbazione); 3) remissione (le manifestazioni tipiche della BA scompaiono: non si verificano attacchi di asma; la pervietà bronchiale viene ripristinata in tutto o in parte). Complicazioni: 1) polmonare: enfisema, insufficienza polmonare, atelettasia, pneumotorace, stato asmatico, ecc.; 2) extrapolmonare: cuore polmonare (compensato e scompensato con lo sviluppo di insufficienza cardiaca destra), distrofia miocardica, ecc. Quadro clinico. Il segno più caratteristico dell'asma sono le denunce di attacchi di soffocamento (difficoltà di respirazione principalmente durante l'espirazione), mancanza di respiro e tosse di vario tipo (da secca, parossistica o con rilascio di espettorato viscoso). Lo sviluppo dell'infezione broncopolmonare provoca un aumento della temperatura corporea. La conseguente difficoltà nella respirazione nasale è una manifestazione di rinosinupatia allergica (rinite vasomotoria, poliposi), che solitamente si manifesta nella fase pre-asmatica. I dati storici aiutano a stabilire una connessione tra lo sviluppo di convulsioni e l'esposizione a determinati allergeni e altri fattori. Molto spesso si tratta di un'infezione delle vie respiratorie, specialmente in un'esacerbazione della malattia. Dall'anamnesi apprendono l'influenza dello sforzo fisico (come camminare a passo svelto, risate, ecc.), i cambiamenti nei fattori meteorologici (come freddo, alta umidità, ecc.), i disturbi disovariali, i fattori professionali sull'insorgenza dell'asma attacchi. Lo studio di una storia allergica contribuisce alla diagnosi di una variante atopica di BA. In questi casi, le esacerbazioni della malattia sono stagionali (più spesso in primavera e in estate), accompagnate da rinite, congiuntivite. Tali pazienti hanno orticaria, edema di Quincke; intolleranza alimentare, vengono rilevate numerose sostanze medicinali; esiste una predisposizione ereditaria alle malattie allergiche. I dati dell'anamnesi consentono spesso di stabilire la presenza della cosiddetta asma da aspirina. In questo caso, non esiste una forma ereditaria di malattie allergiche. Tali pazienti sono preoccupati per la respirazione nasale ridotta (escrescenze polipi) e il sintomo più caratteristico è l'intolleranza ai farmaci antinfiammatori non steroidei (acido acetilsalicilico, indometacina, ecc.), Che causano attacchi asmatici. In questo caso, è già possibile ipotizzare un meccanismo prostaglandine di AD. I dati sullo sviluppo dello stato asmatico in passato indicano la gravità del decorso della malattia e indicano la necessità di una terapia con corticosteroidi. diagnostica. Di grande importanza è l'identificazione di manifestazioni extrapolmonari di allergie, segni di broncoostruzione, complicanze dell'asma e altre malattie accompagnate da attacchi di broncospasmo. Quando si esamina la pelle, è possibile rilevare manifestazioni allergiche: orticaria, eruzioni cutanee eritematose papulari, che indicano una variante immunologica di BA. La combinazione di asma con eczema, neurodermite, psoriasi predispone all'asma grave. Spesso è possibile identificare una violazione della respirazione nasale. Rinite e polipi sono considerati pre-asmatici. La sinusite e altre sinusiti possono causare soffocamento. L'esame obiettivo dei polmoni, spesso dovuto alla bronchite cronica sottostante, può rivelare segni di enfisema che portano allo sviluppo di insufficienza respiratoria cronica e cuore polmonare. Vengono rilevati segni auscultatori di ostruzione bronchiale: un cambiamento nella respirazione (espirazione prolungata, secca, per lo più respiro sibilante, respiro sibilante), espirazione forzata, che rivela broncospasmo latente (la comparsa o l'aumento del respiro sibilante secco). L'auscultazione dei polmoni deve essere eseguita nella posizione del paziente sdraiato: il numero dei rantoli secchi aumenta con il loro meccanismo "vagale". Costantemente ascoltati in una certa area, i rantoli gorgoglianti dalla voce umida ("scoppiettante") possono indicare una pneumosclerosi sviluppata. Un esame obiettivo del paziente rivela sintomi di altre malattie ("farfalla" sulla pelle del viso, linfoadenopatia in combinazione con un aumento del fegato e della milza, un aumento persistente della pressione sanguigna, febbre persistente, ecc.), in cui si verificano attacchi di broncospasmo, manifestati da soffocamento (lupus eritematoso sistemico, periarterite nodulare). Quindi la presunta diagnosi di AD diventa improbabile. La spirografia rivela i segni caratteristici di un'ostruzione bronchiale di tipo ostruttivo: diminuzione del volume espiratorio forzato nel primo secondo (FEV1), diminuzione del coefficiente di Tiffno (FEV1 a VC come percentuale) e la percentuale di FEV1 a FZhEL. Durante l'esacerbazione della BA, il volume polmonare residuo (RLV) e la capacità funzionale residua (FOC) superano il livello iniziale del 100% o più. Quando si analizza lo spirogramma, si riscontrano segni di discinesia tracheobronchiale, che contribuiscono alla violazione della pervietà bronchiale, dalla presenza di una tacca nella parte superiore del colore discendente dello spirogramma (sintomo di Kolbet-Wyss). La pneumotacometria mostra la predominanza del potere inspiratorio rispetto al potere espiratorio, che è caratteristico dell'ostruzione bronchiale. Secondo la pneumotachografia con la costruzione della curva flusso-volume, una violazione della pervietà bronchiale viene diagnosticata separatamente a livello di bronchi grandi, medi e piccoli. La comparsa di un'aumentata resistenza bronchiale, registrata mediante spirografia, pneumotacometria e pneumotacografia, in risposta all'attività fisica, all'inalazione di aria fredda, gas irritanti e acetilcolina indica un'alterata reattività bronchiale. I test allergologico vengono eseguiti utilizzando una serie di vari allergeni non infettivi e infettivi, vengono eseguiti solo al di fuori dell'esacerbazione della malattia. Per valutare l'effetto provocante dell'allergene, vengono eseguiti test allergici cutanei (applicazione, scarificazione e metodi intradermici di applicazione dell'allergene), l'allergene può essere applicato alla congiuntiva dell'occhio, la mucosa nasale. La più affidabile è la diagnosi specifica dell'asma: l'identificazione di una specifica iperreattività bronchiale con l'aiuto di test provocatori di inalazione. Tuttavia, non bisogna perdere di vista il fatto che questa via di somministrazione può provocare un grave attacco di asma o lo sviluppo di uno stato asmatico. Per la diagnosi specifica dell'AD, ad esempio, quando è impossibile condurre test allergici, viene utilizzato anche un test radioimmunosorbente, che consente la valutazione quantitativa degli anticorpi IgE. Gli studi di laboratorio aiutano a confermare la diagnosi proposta, a valutare l'evoluzione della malattia e l'efficacia del trattamento. Il principale criterio diagnostico per l'AD è la comparsa di eosinofili nell'espettorato, ma questo è un segno non specifico, può servire come manifestazione di una reazione allergica generale del corpo. Di importanza diagnostica è anche il rilevamento delle spirali di Kurshman e dei cristalli di Charcot-Leiden nell'espettorato. Studi di laboratorio dimostrano la presenza di un processo infiammatorio attivo e il grado della sua gravità in termini di aumento degli indicatori di fase acuta. Con un aumento dell'insufficienza respiratoria in caso di esacerbazione dell'asma e dello stato asmatico, è importante studiare lo stato acido-base e la composizione dei gas nel sangue. L'esame a raggi X diagnostica focolai di infezione (nei seni paranasali, denti, cistifellea) e la presenza di acuta (polmonite) o esacerbazione di un processo infiammatorio cronico nei polmoni, enfisema e pneumosclerosi. I dati dell'ECG dimostrano segni dello sviluppo del cuore polmonare compensato - ipertrofia del cuore destro. Diagnosi differenziale. La BA è differenziata dall'asma cardiaco (vedere Tabella 8). Tabella 8 Diagnosi differenziale di AD
È inoltre necessario differenziare l'asma infettivo-allergico da quello atopico (vedi Tabella 9). Tabella 9 Asma infettivo-allergico e atopico
trattamento. Nel trattamento dell'asma si raccomanda un approccio graduale, che si spiega con la gravità variabile del suo decorso in persone diverse e nello stesso paziente. Lo stadio 1 è l’asma meno grave, lo stadio 4 è il più grave. Stadio 1: un decorso lievemente intermittente in cui i sintomi dell'asma compaiono in seguito all'esposizione a un fattore scatenante (p. es., polline o peli di animali) oa causa dell'esercizio. L'uso a lungo termine di farmaci antinfiammatori nel trattamento di tali pazienti non è indicato. Il trattamento consiste in farmaci profilattici, se necessario (inalazione β2agonisti, cromoglicato, nedocromil o anticolinergici). Occasionalmente, le esacerbazioni più gravi e prolungate richiedono un breve ciclo di corticosteroidi orali. Se l'asma si manifesta con sintomi più frequenti, un aumento della necessità di broncodilatatori, allora diventa necessario passare alla fase successiva. Fase 2. Corso lievemente persistente. La terapia primaria comprende farmaci antinfiammatori, corticosteroidi per via inalatoria, sodio cromoglicato o nedocromil sodico. Il dosaggio dei corticosteroidi è di 200-500 mcg di beclometasone dipropionato o budesonide al giorno. Per il trattamento sintomatico, β per via inalatoria2-agonisti, ma non più di 3-4 volte al giorno. Per le esacerbazioni più gravi e prolungate, viene somministrato un breve ciclo di corticosteroidi orali. Se i sintomi persistono nonostante una dose iniziale di corticosteroidi per via inalatoria, la dose di beclometasone dipropionato deve essere aumentata a 750-800 microgrammi al giorno. Tuttavia, un'alternativa all'aumento della dose di ormoni inalatori, soprattutto per controllare gli attacchi notturni di asma, è l'aggiunta di broncodilatatori a lunga durata d'azione assunti di notte (a una dose di corticosteroidi per via inalatoria di almeno 500 mcg). Lo stadio 3 è caratterizzato da una moderata gravità di BA. Tali pazienti richiedono l'assunzione giornaliera di farmaci antinfiammatori profilattici. La dose di corticosteroidi per via inalatoria è di 800-2000 mcg in combinazione con broncodilatatori a lunga durata d'azione. È possibile utilizzare teofilline a lunga durata d'azione (con monitoraggio costante della loro concentrazione non superiore a 5-15 μg / ml), β per via orale e per inalazione2agonisti a lunga durata d'azione. Nominare sintomaticamente β2-agonisti a breve durata d'azione o farmaci alternativi (stadio 2). Stadio 4. Asma grave, quando non è completamente controllato. In questo caso, l'obiettivo del trattamento è quello di ottenere i migliori risultati possibili. Il trattamento primario prevede alte dosi di corticosteroidi per via inalatoria (tra 800 e 2000 microgrammi al giorno di beclometasone dipropionato) in combinazione con broncodilatatori a lunga durata d'azione. Se necessario, per alleviare i sintomi è indicato β inalato.2-agonisti a breve durata d'azione (non più di 3-4 volte al giorno). Un'esacerbazione più grave può richiedere un ciclo di trattamento con corticosteroidi orali, che vengono prescritti in dosi minime o a giorni alterni. Per prevenire lo sviluppo di effetti collaterali, vengono somministrate alte dosi di corticosteroidi per via inalatoria attraverso un distanziatore. Il passaggio 5 prevede la riduzione dei farmaci di supporto. Ciò è possibile se l'asma rimane sotto controllo per almeno 3 mesi, il che aiuta a ridurre il rischio di effetti collaterali e aumenta la suscettibilità del paziente al trattamento pianificato. La "riduzione" del trattamento viene effettuata sotto il costante controllo dei sintomi, delle manifestazioni cliniche e degli indicatori delle funzioni respiratorie riducendo (cancellando) gradualmente l'ultima dose o farmaci aggiuntivi. Fermare gli attacchi. Un attacco lieve può essere trattato a casa con broncodilatatori a breve durata d’azione. Il trattamento viene effettuato fino alla completa scomparsa dei sintomi. Gli attacchi moderati e gravi richiedono non solo dosi adeguate di broncodilatatori a breve durata d'azione (β2-agonisti a breve durata d'azione), ma anche la nomina di corticosteroidi sistemici. Se il paziente ha l'ipossiemia, deve essere somministrato ossigeno. Per il trattamento degli attacchi di asma in un centro medico o in un ospedale, alte dosi di β per via inalatoria2agonisti attraverso un nebulizzatore. L'uso di un inalatore aerosol dosato attraverso un distanziatore è molto efficace. Preferibilmente, i corticosteroidi vengono somministrati per via orale, non per via endovenosa. Quando si utilizza teofillina o aminofillina in combinazione con alte dosi di β2-agonisti non è previsto un ulteriore effetto broncodilatatore, ma aumenta il rischio di effetti collaterali. Le teofilline possono essere utilizzate solo in assenza di β2-agonisti, tuttavia, possono essere somministrati per via endovenosa alla velocità di 6 mg/kg di aminofillina (o 5 mg/kg di teofillina) con una dose costante di 0,5-1,0 mg/kg per ora per 24 ore.In alternativa, β2Gli agonisti a breve durata d'azione possono anche usare l'adrenalina, ma con il suo uso sono possibili effetti collaterali significativi. Farmaci mucolitici per via inalatoria, sedativi e antistaminici, solfato di magnesio, fisioterapia toracica, idratazione con grandi volumi di liquidi per adulti e bambini più grandi non sono raccomandati per il trattamento degli attacchi di asma per evitare un aumento della tosse. Профилактика. La prevenzione primaria dell'asma comprende il trattamento dei pazienti in stato di pre-asma, l'identificazione di difetti biologici in individui praticamente sani con una storia familiare che rappresentano una minaccia per l'insorgenza dell'asma, l'eliminazione di allergeni potenzialmente pericolosi, sostanze irritanti e altri fattori dall'asma ambiente dei pazienti che può portare allo sviluppo della malattia. Nel trattamento di pazienti in stato di preasma, è necessario disinfettare i focolai di infezione, trattare la rinosinusopatia allergica, applicare vari metodi di trattamento non farmacologico, tra cui agopuntura e psicoterapia, terapia fisica, baroterapia e cure termali. La realizzazione di hyposensitization specifico e nonspecifico è mostrata. CONFERENZA N. 7. Malattie dell'apparato respiratorio. Bronchite cronica La bronchite ostruttiva cronica è una lesione infiammatoria non allergica diffusa dell'albero bronchiale, causata da prolungati effetti irritanti sui bronchi di vari agenti, che ha un decorso progressivo ed è caratterizzata da ventilazione polmonare ostruttiva, formazione di muco e funzione drenante dei bronchi albero, che si manifesta con tosse, espettorato e mancanza di respiro. Secondo la definizione dell'OMS, se un paziente tossisce espettorato quasi tutti i giorni per almeno 3 mesi consecutivi per più di 2 anni consecutivi, la malattia è considerata bronchite cronica (CB). La bronchite cronica è divisa in primaria e secondaria. La bronchite cronica primaria è una malattia indipendente che non è associata ad altri processi broncopolmonari o danni ad altri organi e sistemi, in cui è presente una lesione diffusa dell'albero bronchiale. Il CB secondario si sviluppa sullo sfondo di altre malattie, sia polmonari (tubercolosi, bronchiectasie, ecc.) Che extrapolmonari (uremia, insufficienza cardiaca congestizia, ecc.). Molto spesso è di natura locale (segmentale). Considera la HB primaria. eziologia. Sia fattori esogeni (fumo di tabacco, inquinamento atmosferico, condizioni professionali sfavorevoli, fattori climatici e infettivi) che endogeni (patologia del rinofaringe, respirazione alterata attraverso il naso, malattie respiratorie acute ripetute, bronchite acuta e infezione focale delle prime vie respiratorie) svolgono un ruolo nello sviluppo delle vie CB, predisposizione ereditaria, disturbi metabolici (obesità)). patogenesi. Sotto l'influenza di fattori esogeni e con la partecipazione di fattori endogeni nell'albero tracheobronchiale, le proprietà strutturali e funzionali della mucosa e dello strato sottomucoso cambiano, si sviluppa l'infiammazione della mucosa e la pervietà e la funzione di drenaggio dei bronchi vengono interrotte. I cambiamenti strutturali e funzionali nella membrana mucosa e nello strato sottomucoso sono espressi nell'iperplasia e nell'iperfunzione delle cellule caliciformi, delle ghiandole bronchiali, dell'ipersecrezione di muco denso e viscoso, che porta all'interruzione del sistema di trasporto mucociliare. La quantità di IgA-lisozima secretoria e lattoferrina prodotta è ridotta. Si sviluppa l'edema della mucosa e quindi - atrofia e metaplasia dell'epitelio. L'infiammazione della mucosa è causata da vari irritanti in combinazione con l'infezione (virale e batterica). Le sostanze chimiche (inquinanti) contenute nell'aria hanno un effetto dannoso sulle vie respiratorie, si verifica un gonfiore della mucosa e si verifica l'inibizione dell'attività dell'epitelio ciliato. Ciò porta a una violazione dell'evacuazione e a una diminuzione della funzione di barriera della mucosa bronchiale. Il contenuto catarrale è sostituito da catarrale-purulento e quindi purulento. La diffusione del processo infiammatorio alle sezioni distali dell'albero bronchiale interrompe la produzione di tensioattivo e riduce l'attività dei macrofagi alveolari che fagocitano le particelle estranee. Se il broncospasmo che si verifica in caso di infiammazione è pronunciato, si sviluppa una componente broncospastica (non allergica). L'infezione associata durante l'esacerbazione dell'infiammazione contribuisce allo sviluppo di una componente asmatica (allergica), che consente di attribuire tale CB al pre-asma. La sindrome ostruttiva si sviluppa a causa di una combinazione di una serie di fattori: 1) spasmo della muscolatura liscia dei bronchi a causa di effetti irritanti di fattori esogeni e alterazioni infiammatorie della mucosa; 2) ipersecrezione di muco, alterazioni delle sue proprietà reologiche, che portano all'interruzione del trasporto mucociliare e al blocco dei bronchi con un segreto viscoso; 3) metaplasia epiteliale da cilindrica a squamosa stratificata e sua iperplasia; 4) violazioni della produzione di tensioattivo; 5) edema infiammatorio e infiltrazione della mucosa; 6) collasso di piccoli bronchi e obliterazione dei bronchioli; 7) alterazioni allergiche nella mucosa. Se nel processo sono coinvolti bronchi di grosso calibro (bronchite prossimale), l'ostruzione bronchiale non viene espressa. Ma in caso di danni ai bronchi piccoli e medi, si verifica una pronunciata violazione della pervietà bronchiale. Tuttavia, con una lesione isolata dei piccoli bronchi (bronchite distale), priva di recettori della tosse, la mancanza di respiro può essere l'unica prova di bronchite sviluppata e la tosse compare quando i bronchi più grandi sono coinvolti nel processo. Vari rapporti di cambiamenti nella mucosa causano la formazione di una certa forma clinica: 1) con bronchite catarrale non ostruttiva, prevalgono alterazioni superficiali delle proprietà strutturali e funzionali della mucosa; 2) con bronchite mucopurulenta (purulenta), predominano i processi di infiammazione infettiva. Tuttavia, è anche possibile una situazione in cui la bronchite catarrale a lungo termine dovuta all'aggiunta di un'infezione può diventare mucopurulenta, ecc. Nella variante non ostruttiva di tutte le forme cliniche della bronchite cronica, i disturbi della ventilazione sono leggermente pronunciati; 3) i disturbi ostruttivi inizialmente compaiono solo sullo sfondo di un'esacerbazione della malattia e sono causati da alterazioni infiammatorie nei bronchi, iper e diskrinia, broncospasmo (componenti reversibili dell'ostruzione), ma poi persistono costantemente, mentre la sindrome ostruttiva cresce lentamente. Nella bronchite cronica ostruttiva, predominano l'ispessimento della membrana mucosa e dello strato sottomucoso, l'edema e l'ipersecrezione e sono anche caratteristici disturbi della ventilazione persistenti. L'ostruzione sviluppata dei piccoli bronchi porta all'enfisema. Nel suo corso, HB subisce una certa evoluzione. Come risultato dello sviluppo di enfisema e pneumosclerosi, si nota una ventilazione irregolare dei polmoni, si formano aree iper e ipoventilate. In combinazione con alterazioni infiammatorie locali, ciò porta a uno scambio di gas alterato, insufficienza respiratoria, ipossiemia arteriosa e ipertensione polmonare, seguiti dallo sviluppo della principale condizione pericolosa per la vita: insufficienza ventricolare destra. Classificazione. Attualmente non esiste una classificazione generalmente accettata del CB. È importante dividere il CB in varianti ostruttive e non ostruttive, in ciascuna delle quali può svilupparsi un processo infiammatorio catarrale (mucoso), catarrale-purulento o purulento. La classificazione include anche forme rare: CB emorragico e fibrinoso. In base al livello di danno bronchiale, si distinguono: con una lesione predominante, grandi bronchi (bronchite prossimale) e con una lesione predominante di piccoli bronchi (bronchite distale) (N. R. Paleev, 1985). Quadro clinico. I principali sintomi del CB sono tosse, produzione di espettorato e mancanza di respiro. Durante un'esacerbazione della malattia oa causa di ipossia con sviluppo di insufficienza polmonare e altre complicazioni, vengono identificati sintomi generali (sudorazione, debolezza, aumento della temperatura corporea, affaticamento, ecc.). La tosse è la manifestazione più tipica della malattia. In base alla natura e alla consistenza dell'espettorato si può ipotizzare una variante del decorso della malattia. Nella versione non ostruttiva della bronchite catarrale, la tosse è accompagnata dal rilascio di una piccola quantità di muco e espettorato acquoso (di solito al mattino, dopo l'esercizio o a causa dell'aumento della respirazione). All'inizio della malattia la tosse non disturba il paziente; la comparsa di tosse parossistica indica lo sviluppo di ostruzione bronchiale. La tosse assume un tono che abbaia ed è di natura parossistica con pronunciato collasso espiratorio della trachea e dei grandi bronchi. Con la bronchite purulenta e mucopurulenta, i pazienti sono più preoccupati per la tosse con l'espettorato. In caso di esacerbazione della malattia, l'espettorato acquisisce un carattere purulento, la sua quantità aumenta, a volte l'espettorato viene escreto con difficoltà (a causa dell'ostruzione bronchiale durante l'esacerbazione). Nella variante ostruttiva della bronchite, la tosse è improduttiva e secca, accompagnata da mancanza di respiro, con una piccola quantità di espettorato. La mancanza di respiro si verifica in tutti i pazienti con bronchite cronica in vari momenti. La comparsa di mancanza di respiro nei pazienti con "tosse a lungo termine" inizialmente con uno sforzo fisico significativo indica l'aggiunta di ostruzione bronchiale. Con il progredire della malattia, la mancanza di respiro diventa più pronunciata e costante, cioè si sviluppa un'insufficienza respiratoria (polmonare). Nella variante non ostruttiva, il CB progredisce lentamente, la mancanza di respiro di solito compare 20-30 anni dopo l'esordio della malattia. Tali pazienti non risolvono quasi mai l'insorgenza della malattia, ma indicano solo la comparsa di complicanze o frequenti esacerbazioni. C'è una storia di ipersensibilità al freddo e la maggior parte dei pazienti riferisce di fumare a lungo termine. In un certo numero di pazienti, la malattia è associata a rischi professionali sul lavoro. Quando si analizza una storia di tosse, è necessario assicurarsi che il paziente non abbia altre patologie dell'apparato broncopolmonare (tubercolosi, tumori, bronchiectasie, pneumoconiosi, malattie sistemiche del tessuto connettivo, ecc.), accompagnate dagli stessi sintomi. A volte un'anamnesi indica emottisi dovuta a una lieve vulnerabilità della mucosa bronchiale. L'emottisi ricorrente indica una forma emorragica di bronchite. Inoltre, l'emottisi nella bronchite cronica a lungo termine può essere il primo sintomo di cancro ai polmoni o bronchiectasie. diagnostica. L'auscultazione rivela un respiro affannoso (con lo sviluppo dell'enfisema può indebolirsi) e un respiro sibilante secco di natura sparsa, il cui timbro dipende dal calibro dei bronchi colpiti (il respiro sibilante, ben udibile durante l'espirazione, è caratteristico del danno ai piccoli bronchi ). I cambiamenti nei dati di auscultazione saranno minimi nella bronchite cronica non ostruttiva in remissione e più pronunciati durante l'esacerbazione del processo (rantoli umidi di vario calibro che possono scomparire dopo una buona tosse e produzione di espettorato). Con un'esacerbazione della bronchite ostruttiva, aumenta la mancanza di respiro, aumentano i fenomeni di insufficienza respiratoria. Un segreto viscoso purulento complica ulteriormente la pervietà dei bronchi. La componente ostruttiva che ha unito le forme catarrali e mucopurulente della bronchite e durante il periodo di esacerbazione o nel processo della loro evoluzione, aggrava significativamente il decorso della bronchite. Segni di ostruzione bronchiale: prolungamento della fase espiratoria con respirazione calma e soprattutto forzata; respiro sibilante all'espirazione (meglio auscultato con respirazione forzata e in posizione supina); sintomi di enfisema polmonare ostruttivo. Nei casi avanzati di bronchite cronica e con l'aggiunta di complicanze, compaiono segni di enfisema polmonare, insufficienza respiratoria e cardiaca (ventricolare destra) - cuore polmonare scompensato: acrocianosi, pastosità o gonfiore delle gambe e dei piedi, alterazioni delle unghie in la forma di occhiali da orologio e le falangi terminali delle mani e dei piedi - sotto forma di bacchette, gonfiore delle vene cervicali, pulsazione nella regione epigastrica dovuta al ventricolo destro, accento del II tono nel II spazio intercostale a sinistra dello sterno, ingrossamento del fegato. Influisce sul quadro della malattia e sull'aggiunta di un componente asmatico (allergico), quando c'è una somiglianza con l'asma bronchiale. Gli indicatori di laboratorio e strumentali hanno un diverso grado di significatività a seconda della fase del processo. Nel periodo iniziale della malattia o nella fase di remissione, potrebbero non esserci cambiamenti. Tuttavia, questi indicatori sono di grande importanza per identificare l'attività del processo infiammatorio; chiarimento della forma clinica della malattia; identificare le complicazioni; diagnosi differenziale con malattie che hanno sintomi clinici simili. L'esame a raggi X del torace viene eseguito in tutti i pazienti con bronchite cronica, tuttavia, di norma, non ci sono cambiamenti nei polmoni su radiografie semplici. Potrebbe esserci una deformazione della maglia del modello polmonare, a causa dello sviluppo di pneumosclerosi. Con un lungo corso del processo, vengono rivelati segni di enfisema polmonare. Con lo sviluppo del cuore polmonare, sul contorno sinistro dell'ombra del cuore appare un rigonfiamento del tronco dell'arteria polmonare, l'espansione delle arterie basali, seguita dal loro restringimento a forma di cono e una diminuzione del diametro del rami periferici. L'esame radiografico gioca un ruolo importante nella diagnosi delle complicanze (polmonite acuta, bronchiectasie) e nella diagnosi differenziale con malattie con sintomi simili. La broncografia viene utilizzata solo per diagnosticare le bronchiectasie. La broncoscopia è di grande importanza nella diagnosi della bronchite cronica e nella sua differenziazione dalle malattie che manifestano un quadro clinico simile. Conferma la presenza di un processo infiammatorio; chiarisce la natura dell'infiammazione (la diagnosi di bronchite emorragica o fibrinosa viene effettuata solo dopo questo studio); rivela disturbi funzionali dell'albero tracheobronchiale (è particolarmente importante identificare il collasso espiratorio - discinesia della trachea e grossi bronchi); aiuta a identificare le lesioni organiche dell'albero bronchiale. Inoltre, la broncoscopia consente di ottenere il contenuto dei bronchi o lavaggi per studi microbiologici, parassitologici e citologici. Lo studio della funzione della respirazione esterna viene effettuato per identificare i disturbi restrittivi e ostruttivi della ventilazione polmonare. Secondo lo spirogramma, viene calcolato l'indice di Tiffno (il rapporto tra il volume espiratorio forzato in 1 s - FEV1 alla capacità vitale dei polmoni - VC in percentuale) e un indicatore della velocità dell'aria - PSV (il rapporto tra la massima ventilazione dei polmoni - MVL e VC). Con lo sviluppo della sindrome ostruttiva, c'è una diminuzione degli indicatori di velocità assoluta della respirazione esterna (MVL e FEV1), eccedente il grado di riduzione della VC; l'indice di Tiffno diminuisce e la resistenza bronchiale all'espirazione aumenta. Secondo la pneumotacometria, la predominanza del potere inspiratorio rispetto al potere espiratorio si rivela come un segno precoce di ostruzione bronchiale. L'identificazione delle violazioni della pervietà bronchiale a diversi livelli dell'albero bronchiale è possibile con l'aiuto di speciali pneumotachigrafi, che consentono di ottenere una curva "flusso-volume". L'ostruzione periferica è caratterizzata da una significativa diminuzione della curva flusso-volume nell'area di basso volume. La valutazione congiunta della resistenza bronchiale e dei volumi polmonari aiuta anche a determinare il livello di ostruzione. In caso di ostruzione a livello dei grossi bronchi, si ha un aumento del volume residuo dei polmoni (RLV) e la capacità polmonare totale (TLC) non aumenta. Con l'ostruzione periferica si osserva un aumento più significativo del TRL e un aumento del TRL. Per identificare la proporzione di broncospasmo nella proporzione totale di ostruzione bronchiale, la ventilazione e la meccanica respiratoria vengono studiate dopo una serie di test farmacologici. Dopo l'inalazione di aerosol broncodilatatori, le prestazioni di ventilazione migliorano in presenza di una componente spastica di ostruzione delle vie aeree. La radiopulmonografia utilizzando l'isotopo radioattivo 133Xe viene eseguita per rilevare una ventilazione irregolare associata all'ostruzione dei piccoli bronchi. Questo è il primo segno diagnostico di questo tipo di ostruzione bronchiale. L'elettrocardiografia è necessaria per rilevare l'ipertrofia del ventricolo destro e dell'atrio destro che si sviluppa con l'ipertensione polmonare. Viene rilevata una pronunciata deviazione dell'asse QRS a destra, uno spostamento della zona di transizione a sinistra (R / S < 1 in V4-V6), ECG di tipo S; onda P alta e acuta nelle derivazioni VF, III, II. Un esame del sangue clinico rivela eritrocitosi secondaria risultante da ipossia cronica con lo sviluppo di grave insufficienza polmonare. Gli indicatori della "fase acuta" sono espressi moderatamente: la VES è normale o moderatamente aumentata, la leucocitosi è piccola, così come lo spostamento della formula dei leucociti a sinistra. Come prova di manifestazioni allergiche, è possibile l'eosinofilia. Lo studio dell'espettorato e del contenuto bronchiale aiuta a stabilire la gravità dell'infiammazione. Con grave infiammazione, il contenuto è purulento o purulento-mucoso, contiene molti neutrofili e singoli macrofagi, le cellule distroficamente alterate dell'epitelio ciliato e squamoso sono scarsamente rappresentate. L'infiammazione moderata è caratterizzata da un contenuto più vicino al mucopurulento; il numero di neutrofili si riduce, aumenta il numero di macrofagi, muco e cellule epiteliali bronchiali. Con una lieve infiammazione, i contenuti bronchiali sono mucosi, predominano le cellule desquamate dell'epitelio e dei bronchi; macrofagi e neutrofili sono pochi. L'esame microbiologico dell'espettorato e del contenuto bronchiale è importante per identificare l'eziologia delle esacerbazioni della bronchite cronica e la scelta della terapia antimicrobica. Diagnosi differenziale. Tabella 10 Criteri diagnostici differenziali per CB
trattamento. Comprende una serie di misure che differiscono durante il periodo di esacerbazione e remissione della malattia. Durante il periodo di esacerbazione della malattia cronica, si distinguono due direzioni di trattamento: etiotropica e patogenetica. Il trattamento etiotropico ha lo scopo di eliminare il processo infiammatorio nei bronchi: è indicata la terapia con antibiotici, sulfamidici, antisettici, fitoncidi, ecc.. Il trattamento viene iniziato con antibiotici della serie delle penicilline (penicillina, ampicillina) o un gruppo di cefalosporine (cefamesina , tseporina) e, in assenza di effetto, vengono utilizzati gli antibiotici del gruppo di riserva (gentamicina, ecc.). La via di somministrazione più preferita è quella intratracheale (aerosol o riempimento con una siringa laringea attraverso un broncoscopio). Il trattamento patogenetico è finalizzato al miglioramento della ventilazione polmonare; ripristino della pervietà bronchiale; controllo dell'ipertensione polmonare e dell'insufficienza ventricolare destra. Il ripristino della ventilazione polmonare, oltre all'eliminazione del processo infiammatorio nei bronchi, è facilitato dall'ossigenoterapia e dalla terapia fisica. La cosa principale nel trattamento della bronchite cronica - il ripristino della pervietà bronchiale - si ottiene migliorando il loro drenaggio ed eliminando il broncospasmo. Per migliorare il drenaggio bronchiale vengono prescritti espettoranti (bevanda alcalina calda, decotti di erbe, mukaltin, ecc.), Farmaci mucolitici (acetilcisteina, bromexina; con secrezione viscosa purulenta - aerosol di enzimi proteolitici - chimopsina, tripsina); viene utilizzata la broncoscopia terapeutica. Per eliminare il broncospasmo, viene utilizzata l'eufillina (per via endovenosa, in supposte, compresse), efedrina, atropina; gli appuntamenti soli in un aerosol di preparazioni simpatomimetichesky sono possibili: fenoterol, orciprenaline solfato (asthmopenta) e una nuova medicina domestica "Soventol", farmaci anticolinergici: atrovent, troventol. Preparazioni efficaci di aminofillina prolungata (teopec, teodur, theobelong, ecc.) - 2 volte al giorno. In assenza dell'effetto di tale terapia, piccole dosi di corticosteroidi vengono somministrate per via orale (10-15 mg di prednisolone al giorno) o per via intratracheale (sospensione di idrocortisone - 50 mg). Come terapia aggiuntiva, nominare: 1) farmaci antitosse: con tosse improduttiva - libexin, tusuprex, bromexina, con tosse secca - codeina, dionina, stoptussin; 2) farmaci che aumentano la resistenza dell'organismo: vitamine A, C, gruppo B, stimolanti biogenici. Attualmente, nel trattamento della bronchite cronica, vengono sempre più utilizzati farmaci immunocorrettivi: T-attivina o timalina (100 mg per via sottocutanea per 3 giorni); all'interno - catergen, nucleinato di sodio o pentossile (entro 2 settimane), levamisolo (decaris). Trattamento fisioterapico: prescrivere diatermia, elettroforesi con cloruro di calcio, quarzo sulla zona del torace, massaggio toracico ed esercizi di respirazione. Con la bronchite moderata e grave, insieme al trattamento anti-ricaduta e al sanatorio, molti pazienti sono costretti a ricevere costantemente un trattamento farmacologico di supporto. La terapia di mantenimento ha lo scopo di migliorare la pervietà bronchiale, ridurre l'ipertensione polmonare e combattere l'insufficienza ventricolare destra. Gli stessi farmaci sono prescritti come nel periodo di esacerbazione, solo in dosi minori, nei corsi. Previsione. La prognosi per il completo recupero è sfavorevole. La prognosi meno favorevole è per il CB ostruttivo e il CB con danno predominante ai bronchi distali, che porta rapidamente allo sviluppo di insufficienza polmonare e alla formazione del cuore polmonare. La prognosi più favorevole è per il CB superficiale (catarrale) senza ostruzione. CONFERENZA N. 8. Malattie dell'apparato respiratorio. Polmonite La polmonite è una malattia infettiva e infiammatoria acuta di natura focale, in cui le sezioni respiratorie e il tessuto connettivo interstiziale dei polmoni sono coinvolti nel processo patologico. Классификация Е. В. Гембицкого (1983 г.). Per eziologia: 1) batterico (che indica l'agente patogeno); 2) virale (che indica l'agente patogeno); 3) cornitico; 4) traballante; 5) micoplasma; 6) fungino; 7) misto; 8) infettivo-allergico; 9) eziologia sconosciuta. Per patogenesi: 1) primario (processo infiammatorio acuto indipendente); 2) secondario (complicazione delle malattie del sistema cardiovascolare con disturbi circolatori nella circolazione polmonare, malattie croniche dei reni, sistemi sanguigni, metabolismo, malattie infettive o sviluppo sullo sfondo di malattie respiratorie croniche). Caratteristiche cliniche e morfologiche: 1) parenchimale (per polmonite pneumococcica): croupous; focale; 2) interstiziale. Per localizzazione ed estensione: unilaterale; bilaterale. Per gravità: estremamente grave; pesante; moderare; mite e abortivo. A valle: tagliente; protratto (risoluzione radiologica e clinica della polmonite). eziologia. Большинство пневмоний имеет инфекционное происхождение. Пневмонии аллергические и обусловленные действием физических или химических факторов встречаются редко. Бактериальные пневмонии диагностируются чаще у лиц среднего и пожилого возраста; вирусные пневмонии - у молодых. В этиологии первичных бактериальных пневмоний ведущая роль принадлежит пневмококкам. В период эпидемии гриппа возрастает роль вирусно-бактериальных ассоциаций (чаще стафилококков), а также условно-патогенных микроорганизмов. Nella polmonite secondaria, il ruolo eziologico principale è svolto dai batteri gram-negativi (klebsiella pneumoniae e bacillo influenzale); in caso di polmonite da aspirazione, l'importanza dell'infezione anaerobica è grande. patogenesi. Инфекционный возбудитель попадает извне в респираторные отделы легких через бронхи: ингаляционно и аспирационно (из носо- или ротоглотки). Гематогенным путем возбудитель попадает в легкие преимущественно при вторичных пневмониях или при тромботическом генезе пневмоний. Лимфогенное распространение инфекции с возникновением пневмонии наблюдается лишь при ранениях в грудную клетку. Esiste anche un meccanismo endogeno per lo sviluppo dell'infiammazione nel tessuto polmonare, dovuto all'attivazione della microflora nei polmoni. Il suo ruolo è ottimo nella polmonite secondaria. Lo sviluppo della polmonite è facilitato da fattori sfavorevoli dell'ambiente esterno e interno, sotto l'influenza dei quali c'è una diminuzione della resistenza generale non specifica del corpo (soppressione della fagocitosi, produzione di batteriolisine, ecc.) E soppressione della locale meccanismi di difesa (danneggiamento della clearance mucociliare, diminuzione dell'attività fagocitica dei macrofagi alveolari e dei neutrofili, ecc.) . Significativa importanza nella patogenesi della polmonite è attribuita anche alle reazioni allergiche e autoallergiche. Saprofiti e microrganismi patogeni, diventando antigeni, contribuiscono alla produzione di anticorpi che si fissano sulle cellule della mucosa delle vie respiratorie, dove si verifica la reazione antigene-anticorpo, che porta al danno tissutale e allo sviluppo del processo infiammatorio. In presenza di determinanti antigenici comuni di microrganismi e tessuto polmonare, o se il tessuto polmonare è danneggiato da virus, microrganismi, tossine e sostanze tossiche, portando alla manifestazione delle sue proprietà antigeniche, si sviluppano processi autoallergici. Questi processi contribuiscono a un'esistenza più lunga di cambiamenti patologici e a un decorso prolungato della malattia. Quadro clinico. Основные синдромы: 1) intossicazione (debolezza generale, affaticamento, mal di testa e dolori muscolari, mancanza di respiro, palpitazioni, pallore, perdita di appetito); 2) una sindrome da alterazioni infiammatorie generali (sensazione di calore, brividi, febbre, alterazioni dell'emocromo in fase acuta: leucocitosi con spostamento della formula dei leucociti a sinistra, aumento della VES, livello di fibrinogeno, α2-globuline, la comparsa della proteina C-reattiva); 3) una sindrome di alterazioni infiammatorie nel tessuto polmonare (comparsa di tosse ed espettorato, accorciamento del suono della percussione), aumento del tremore della voce e della broncofonia, cambiamenti nella frequenza e nella natura della respirazione, comparsa di rantoli umidi, alterazioni radiografiche; 4) sindrome da coinvolgimento di altri organi e sistemi. La gravità di queste manifestazioni caratterizza la gravità del decorso della polmonite (vedi Tabella 11). Tabella 11 Sintomi e decorso della polmonite
In varie fasi del decorso della polmonite, il quadro clinico può cambiare dall'aggiunta di alcune complicanze: polmonari ed extrapolmonari. Polmonare: formazione di ascessi; pleurite (para- e metapneumonica), meno spesso - empiema pleurico; è possibile l'adesione di una componente asmatica, la formazione di edema polmonare e lo sviluppo di insufficienza respiratoria acuta. Complicanze extrapolmonari: shock infettivo-tossico (con sintomi di insufficienza vascolare acuta, ventricolare sinistra acuta e renale, ulcerazione della mucosa del tubo digerente e sanguinamento, sviluppo di coagulazione intravascolare disseminata; miocardite allergica infettiva; endocardite infettiva; pericardite; meningite o meningoencefalite, nefrite, epatite Nella polmonite crouposa grave possono svilupparsi psicosi da intossicazione e nella polmonite totale confluente - cuore polmonare acuto. Le principali lamentele di un paziente con polmonite: tosse, produzione di espettorato, dolore toracico, aggravato dalla respirazione e dalla tosse, mancanza di respiro, alterato benessere generale, febbre. La tosse può essere secca o con espettorato (mucoso, mucopurulento, purulento-mucoso, sanguinolento). L'espettorato "arrugginito" è caratteristico della polmonite lobare, sanguinante - per la polmonite causata da Klebsiella (bacillo di Fridlander) e polmonite virale; espettorato sanguinante purulento indica una polmonite di origine streptococcica. Tosse persistente con una piccola quantità di espettorato mucopurulento si osserva con polmonite micoplasmica, che è anche caratterizzata da una sensazione di dolore alla gola. Il dolore al fianco, aggravato dalla respirazione profonda e dalla tosse, è caratteristico della polmonite pneumococcica lobare, così come il coinvolgimento della pleura nel processo patologico. Con la localizzazione della polmonite nelle parti inferiori dei polmoni e il coinvolgimento della pleura diaframmatica nel processo, il dolore può irradiarsi nella cavità addominale, simulando un'immagine di un addome acuto. Se il segmento superiore o inferiore del polmone sinistro è coinvolto nel processo, i dolori sono localizzati nella regione del cuore. Nel 25% dei pazienti, la denuncia di mancanza di respiro è una delle principali, in particolare con la polmonite che si è sviluppata sullo sfondo di malattie respiratorie croniche e insufficienza cardiaca. La gravità della mancanza di respiro aumenta parallelamente alla violazione del benessere generale. I sintomi di grave intossicazione sono più caratteristici della cornitosi e della polmonite da micoplasma e si osservano anche nella polmonite da stafilococco, influenza e pneumococco (crouposa). Il paziente può essere disturbato da brividi e un aumento della temperatura corporea fino a febbrile. Sullo sfondo generale di intossicazione e temperatura febbrile, compaiono sintomi locali. diagnostica. Для постановки этиологического диагноза имеет значение правильная оценка симптомов заболевания в самом его начале. Осиплость голоса или невозможность разговаривать характерны для пневмоний, вызванных вирусом парагриппа. Lacrimazione, dolore agli occhi, mal di gola durante la deglutizione, abbondante secrezione dal naso senza modificare altre parti del tratto respiratorio si trovano nella polmonite causata da adenovirus. Il più significativo per la diagnosi è la presenza di una sindrome di alterazioni infiammatorie nel tessuto polmonare. Questa sindrome è costituita dai seguenti sintomi: 1) ritardo nella respirazione del lato toracico colpito; 2) accorciamento del suono della percussione nell'area della proiezione della lesione in misura maggiore o minore; 3) aumento del tremore della voce e della broncofonia nella stessa area; 4) cambiamento nella natura della respirazione (dura, bronchiale, indebolita, ecc.); 5) la comparsa di rumori respiratori patologici (rantoli e crepiti umidi e gorgoglianti). La natura della respirazione può cambiare in diversi modi. Nella fase iniziale della polmonite crouposa, la respirazione può essere indebolita, con un'espirazione prolungata; nella fase di epatizzazione, insieme ad un aumento dell'ottusità del suono della percussione, si sente la respirazione bronchiale; con la risoluzione del fuoco polmonare con una diminuzione dell'ottusità della percussione, la respirazione diventa difficile. Con la polmonite focale, i sintomi più costanti sono respiro affannoso e rantoli umidi e gorgoglianti. Tuttavia, con la polmonite ilare centrale, i dati fisici sono presentati molto male e il riconoscimento della polmonite è possibile solo dopo un esame a raggi X. Le polmoniti da micoplasma si distinguono per la scarsità di dati fisici. Nella polmonite causata dalla polmonite da Klebsiella si osserva una grave intossicazione, combinata con un numero molto ridotto di dispnea. In alcuni casi, durante l'auscultazione, può emergere un gran numero di rantoli secchi bassi e acuti, non caratteristici della sindrome da infiltrazione infiammatoria. Ciò si verifica con la polmonite che si è sviluppata sullo sfondo della bronchite cronica; polmonite causata dal bastone di Pfeiffer; in caso di adesione alla polmonite di un componente allergico. I sintomi aiutano a fare una diagnosi eziologica: 1) il rilevamento di un'eruzione cutanea a piccole macchie, come con la rosolia, in combinazione con linfoadenopatia è caratteristica dell'infezione da adenovirus; 2) l'allargamento locale dei linfonodi indica una polmonite perifocale; 3) polmonite fungina associata a lesioni delle mucose, della pelle e delle unghie; 4) la sindrome epatolienale e un leggero ittero si verificano nelle polmoniti cornitiche e curicketsi; 5) per la tipica polmonite crouposa, l'aspetto del paziente è caratteristico: viso pallido con arrossamento febbrile sul lato della lesione, eruzioni erpetiche, gonfiore delle ali del naso durante la respirazione. Il metodo più importante per chiarire la presenza di polmonite e il grado di coinvolgimento del tessuto polmonare nel processo è la fluorografia a grande telaio e l'esame a raggi X degli organi del torace. Le polmoniti da stafilococco si distinguono per una chiara segmentazione delle lesioni polmonari con il coinvolgimento di diversi segmenti nel processo. Il loro segno radiologico caratteristico è la formazione di cavità multiple nei polmoni del tipo pneumocele nel 5-7o giorno dall'inizio della malattia e successivamente - cavità necrotiche con presenza di liquido. A differenza dei veri ascessi, la configurazione e il numero delle cavità cambiano rapidamente. La lesione lobare è una manifestazione di polmonite crouposa o polmonite causata da Klebsiella. Il lobo superiore, principalmente il polmone destro, è più comunemente colpito. L'esame radiografico rivela un versamento nella cavità pleurica. Spesso un tale versamento si verifica con la polmonite da streptococco, con la polmonite causata dal bastone di Pfeiffer, che è localizzato nel lobo inferiore e in 2/3 dei pazienti cattura più di un lobo del polmone. I dati dell'esame radiografico sono particolarmente importanti per rilevare la polmonite con lievi alterazioni auscultative (polmonite interstiziale e ilare). In alcuni casi, per chiarire la diagnosi, sono indicate la tomografia e la broncografia, che aiutano a chiarire la diagnosi nei casi di regressione ritardata delle alterazioni infiltrative, con decorso complicato (ascesso, versamento nella cavità pleurica). Sono usati per escludere altri processi patologici con presentazioni cliniche e radiologiche simili. La broncografia rivela cavità di decadimento nel tessuto polmonare, nonché la presenza di bronchiectasie, attorno alle quali, durante l'esacerbazione, sono possibili alterazioni infiltrative (polmonite perifocale). Nella diagnosi di polmonite da infarto, uno studio sui radionuclidi del flusso sanguigno polmonare svolge un certo ruolo, rivelandone le violazioni. L'esame batteriologico dell'espettorato (o lavaggi bronchiali) prima della nomina di antibiotici aiuta a rilevare l'agente patogeno e determinarne la sensibilità agli antibiotici. Il microrganismo non sempre identificato è l'agente eziologico della polmonite. Una diagnosi eziologica più precisa può essere fatta utilizzando studi immunologici: reazione di fissazione del complemento (RCC) e reazione di inibizione dell'emoagglutinazione (HITA) con antigeni virali e batterici. Nella diagnosi delle polmoniti virali e virali-batteriche sono importanti gli studi virologici e sierologici (i risultati di uno studio colturale dell'espettorato, compreso un test biologico nei topi, un metodo per coltivare virus in un embrione di pollo in via di sviluppo, un metodo di immunofluorescenza, un metodo sierologico che utilizza sieri accoppiati contro i virus, attribuisce importanza a un aumento solo di 4 volte del titolo anticorpale). L'esame dell'espettorato aiuta a chiarire la natura della polmonite. Un gran numero di eosinofili indica processi allergici, la presenza di cellule atipiche indica polmonite di origine cancerosa; Il Mycobacterium tuberculosis si trova nella tubercolosi; fibre elastiche - prova del collasso del tessuto polmonare. Con la polmonite da micosi, insieme al rilevamento di funghi, si nota l'assenza di flora piogenica a causa dell'effetto inibitorio dei prodotti di scarto dei funghi. Secondo la microscopia degli strisci di espettorato macchiati di Gram, possiamo parlare di microrganismi gram-negativi o gram-positivi che vivono nei bronchi già il primo giorno di degenza del paziente in ospedale. La gravità del processo infiammatorio è giudicata dalla gravità dei parametri ematici della fase acuta e dalla loro dinamica (leucocitosi con cambiamento nella formula dei leucociti, aumento della VES, aumento del contenuto di α2-globuline, fibrinogeno, comparsa di CRP, aumento del livello di acidi sialici). Con un decorso prolungato di polmonite e lo sviluppo di complicanze, viene studiata la reattività immunologica dell'organismo. Una diminuzione dell'immunità umorale (IgM) e cellulare (migrazione ritardata dei leucociti, cambiamenti nei test che caratterizzano il sistema dei linfociti T) richiede una terapia immunomodulante. trattamento. Непосредственно после постановки диагноза необходимо приступать к этиотропной терапии пневмонии. Большое значение приобретают эмпирические представления о возможном возбудителе, поскольку бактериологическое исследование мокроты проводится в течение достаточно длительного времени и у большинства больных даже при современном подходе к данному исследованию дает неопределенные, а иногда ошибочные результаты. Al momento, le penicilline hanno perso la loro importanza come farmaco d'elezione nel trattamento della polmonite. Ciò è dovuto al fatto che eziologicamente significativi per lo sviluppo della polmonite, oltre al pneumococco e all'Haemophilus influenzae, sono i microrganismi intracellulari obbligati - Mycoplasma pneumoniae e Chlamydia pneumoniae, che sono resistenti agli effetti battericidi degli antibiotici del gruppo β-lattamico. È impossibile perdere di vista il fatto che l'ipersensibilità a questi farmaci si sviluppa rapidamente nei pazienti. In relazione a quanto sopra, nel trattamento della polmonite, viene prestata molta attenzione ai macrolidi, che si sono dimostrati efficaci non solo contro il pneumococco, ma anche contro Mycoplasma pneumoniae, Chlarnydia pneumoniae. Tuttavia, è importante non perdere di vista il fatto che l'eritromicina, che è lo standard di questo gruppo di farmaci per la sua bassa stabilità in ambiente acido (e quindi bassa biodisponibilità), nonché per la diffusa prevalenza di ceppi di pneumococco resistente all'eritromicina, sta perdendo il suo valore clinico. Come farmaci di scelta, è stato sostituito da altri farmaci della classe dei macrolidi: azitromicina, roxitromicina, rovamicina, ecc. Un certo numero di macrolidi viene utilizzato anche per uso orale e parenterale (ad esempio rovamicina). Di conseguenza, il loro uso è giustificato nel grave decorso del processo infiammatorio nel polmone (ad esempio, inizialmente la rovamicina viene somministrata per via endovenosa per 2-3 giorni e successivamente, con la dinamica positiva del processo patologico, il paziente passa a prendendo questo farmaco per via orale). Il vantaggio della rovamicina è innegabile, poiché non interagisce con le teofilline, prevenendo la possibilità di un sovradosaggio di questi farmaci, poiché teofilline e rovamicina sono utilizzate insieme nel trattamento di pazienti con malattie polmonari ostruttive croniche. È anche noto che questo sottogruppo di macrolidi (macrolidi a 16 membri) sono farmaci con un livello minimo di effetti collaterali. Nei pazienti di età superiore ai 65 anni, a causa dell'eterogeneità dello spettro eziologico della polmonite e della concomitante broncopneumopatia cronica ostruttiva, le penicilline semisintetiche possono essere utilizzate per la terapia antibiotica iniziale, e in assenza di un effetto positivo dopo questa terapia per 3-4 giorni, l'uso di cefalosporine è giustificato. È importante ricordare che lo spettro d'azione della I e di alcune cefalosporine di II generazione è costituito da microrganismi gram-positivi e gram-negativi e le cefalosporine di III generazione agiscono principalmente sui patogeni gram-negativi. Le cefalosporine di prima generazione sono rappresentate da cefalotina (keflin), cefazolina (kefzol), ecc.I farmaci di seconda generazione includono cefuroxima (ketocef), cefoxitina (boncefin) e altri Cefalosporine di terza generazione: cefotaxime (claforan), cefoperazone (cefobid), ceftriaxone ( longacef). Le polmoniti da aspirazione sono associate a microflora anaerobica o gram-negativa, che determina l'uso di aminoglicosidi o cefalosporine di terza generazione in combinazione con metronidazolo-semisuccinato (500 mg per via endovenosa 2-3 volte al giorno). Gli stati di immunodeficienza influenzano anche la natura dei farmaci selezionati, che in questo caso dipende dalla natura dell'agente patogeno. In questi casi, lo schema applicato è costituito da aminoglicosidi e moderne cefalosporine. La durata di un'efficace terapia antibiotica per un paziente con polmonite è di 7-10 giorni. Quando si prescrive il trattamento, si deve tenere conto del fatto che nel 7-15% dei casi potrebbe non esserci alcun effetto da questa terapia. Ciò indica la necessità di sostituire gli antibiotici, sulla base dei risultati di uno studio microbiologico. Un'altra opzione è l'uso di farmaci alternativi, i cosiddetti antibiotici di seconda scelta: moderne cefalosporine, imipenem, monobattami, fluorochinoloni. I fluorochinoloni (ofloxacina, pefloxacina, ciprofloxacina) sono efficaci contro i patogeni gram-negativi, incluso lo Pseudomonas aeruginosa, e alcuni cocchi gram-positivi (Staphylococcus aureus), ma sono inattivi se esposti agli anaerobi. I fluorochinoloni possono essere giustamente considerati un'alternativa ai macrolidi nelle infezioni da clamidia, legionella e micoplasma. Gli antibiotici monobactamici nella loro forma moderna sono rappresentati dall'aztreonam (azactam), che è attivo principalmente contro aerobi gram-negativi (Salmonella, Shigella, Proteus, Escherichia coli, Klebsiella, ecc.); ed è stabile anche sotto l'azione delle β-lattamasi. Imipenem - un farmaco antibatterico del gruppo dei carbapenemi, è prescritto solo in combinazione con cilastatina, che inibisce il metabolismo dell'imipenem. Il farmaco è altamente efficace contro molti anaerobi, cocchi gram-positivi e bastoncelli gram-negativi. Dosaggio di antibiotici utilizzati nel trattamento della polmonite. 1) Penicilline: benzilpenicillina (500-000 UI per via endovenosa ogni 1-000 ore o 000-6 UI ogni 8 ore per via intramuscolare), ampicillina (500-000-1 g per via intramuscolare ogni 000-000 ore o 4 g ogni 0,5 ore per via endovenosa), amoxicillina (1,0-2,0 g ogni 6 ore per via orale o 8-0,5 g ogni 6-0,5 ore per via intramuscolare, endovenosa), oxacillina (1,0 g ogni 8-0,5 ore per via orale, intramuscolare, endovenosa). 2) Cefalosporine: I generazione - cefalotina (keflin) (0,5-2,0 g ogni 4-6 ore per via intramuscolare, endovenosa), cefazolina (kefzol) (0,5-2,0 g, ogni 8 ore per via intramuscolare, endovenosa), II generazione - cefuroxima (zinacef , ketocef) (0,75-1,5 g ogni 6-8 ore per via intramuscolare, endovenosa), III generazione - cefotaxime (claforan) (1,0-2,0 g, massimo fino a 12 g/die ogni 12 ore per via intramuscolare, endovenosa), ceftriaxone (longacef, rocefin) (1,0-2,0-4,0 g ogni 24 ore per via intramuscolare, endovenosa). 3) Aminoglicosidi: genetamicina (80 mg ogni 12 ore per via intramuscolare, endovenosa), amikacina (10-15 mg/kg ogni 12 ore per via intramuscolare, endovenosa), tobramicina (brulamicina) (3-5 mg/kg ogni 8 ore per via intramuscolare, endovenosa) . 4) Макролиды: эритромицин (0,5 г каждые 6-8 ч перорально или 0,5-1,0 г каждые 6-8 ч внутривенно), ровамицин (3,0 млн. МЕ каждые 8-12 ч перорально или 1,5-3,0 млн. ME каждые 8-12 ч внутривенно). 5) Fluorochinoloni: pefloxacina (leflacina) (400 mg ogni 12 ore per via orale, IV), ciprofloxacina (cyprobay) (500 mg ogni 12 ore per via orale o 200-400 mg ogni 12 ore per via endovenosa), ofloxacina (zanocina, tarivid) (200 mg ogni 12 ore per via orale). 6) Tetracicline: doxiciclina (vibramicina) (200 mg il giorno 1, nei giorni successivi - 100 mg ogni 24 ore per via orale), minociclina (minocina) (200 mg il giorno 1, nei giorni successivi - 100 mg ogni 12 ore per via orale), aztreonam (azactam) (1,0-2,0 g ogni 8-12 ore), imipenem/cilstatina (thienam) (500 mg ogni 6-8 ore per via intramuscolare). È anche significativo che, di regola, un decorso prolungato o progressivo della malattia sia dovuto a una terapia antibiotica iniziale inadeguata. Tuttavia, oltre a questo, esistono una serie di cause locali e sistemiche che portano a un lungo e persistente decorso dell'infiammazione dei polmoni: si tratta di ostruzione delle vie aeree locali (cancro, adenoma, blocco mucoide, ecc.); bronchiectasie (congenite, acquisite); fibrosi cistica; difetti del sistema immunitario (acquisiti); aspirazione ricorrente (acalasia, cancro esofageo, ecc.); attivazione dell'infezione da tubercolosi latente; sviluppo di ascesso polmonare; terapia antibiotica inadeguata. CONFERENZA N. 9. Malattie dell'apparato digerente. Malattie dell'esofago. Esofagite e ulcera peptica dell'esofago 1. Esofagite acuta L'esofagite acuta è una lesione infiammatoria della membrana mucosa dell'esofago che dura da alcuni giorni a 2-3 mesi. Eziologia e patogenesi. Этиологические факторы: инфекционные заболевания, травмы, ожоги, отравления, аллергические реакции, алиментарные погрешности. Tra gli agenti infettivi, i più caratteristici dell'esofagite acuta sono la difterite, la scarlattina, il tifo e il tifo, l'influenza, la parainfluenza, l'infezione da adenovirus, la parotite. I fattori dannosi fisici e chimici sono rappresentati da radiazioni ionizzanti, ustioni chimiche, cibi caldi e molto freddi e spezie. Classificazione. Единой классификации не существует. Возможно применение рабочей классификации острых эзофагитов. Morfologicamente si distinguono i tipi elencati di esofagite acuta: catarrale, edematosa, erosiva, pseudomembranosa, emorragica, esfoliativa, necrotica, flemmonica. Per eziologia: infettiva, chimica, fisica, alimentare. Per fasi endoscopiche: 1a - edema e iperemia della mucosa, 2a - comparsa di singole erosioni nella parte superiore delle pieghe edematose della mucosa, 3a - edema significativo e iperemia della mucosa con focolai di mucose erose e sanguinanti, 4a - "piangente" - membrana mucosa diffusamente erosa, sanguina al minimo tocco dell'endoscopio. Quadro clinico. Катаральный эзофагит - самая распространенная форма острого эзофагита. Возникает на фоне погрешностей в питании: при употреблении острых, холодных, горячих блюд, при мелких травмах, спиртовых ожогах. Si manifesta clinicamente con bruciore e dolore dietro lo sterno, costringendo i pazienti a rifiutare il cibo per diversi giorni. Esofagite di grado I-II annotato endoscopicamente, raggi X - ipercinesia dell'esofago. L'esofagite erosiva si verifica con malattie infettive (finnica, tifo, sepsi, processi fungini) e allergie. Appare anche con ustioni chimiche e lesioni dell'esofago. Infatti, questa forma di esofagite è una fase dell'evoluzione dell'esofagite catarrale. Il quadro clinico principale è costituito dai sintomi della malattia sottostante. I sintomi clinici sono simili a quelli dell'esofagite catarrale: forte dolore al petto durante il passaggio del cibo; bruciore di stomaco, eruttazione, ipersalivazione, odore putrido dalla bocca (cacosmia). Accertare endoscopicamente i segni di esofagite II-III grado. L'esame istologico ha rivelato iperemia, edema della mucosa, emorragia, erosione. L'esame radiografico mostra un'abbondanza di muco nell'esofago, una ristrutturazione del rilievo con formazione di depositi piatti di bario di forma longitudinale lunghi fino a 1 cm, e ipercinesia delle pareti esofagee. L'esofagite emorragica è una rara forma clinica di esofagite erosiva. L'eziologia è la stessa dell'esofagite erosiva. Sindrome da dolore intenso ed ematemesi sono clinicamente tipiche. L'endoscopia rivela un'infiammazione di grado III-IV con predominanza della componente emorragica. C'è un distacco della membrana mucosa sanguinante sotto forma di strisce sottili e strette. Esofagite fibrinosa (pseudomembranosa). I fattori eziologici in esso contenuti sono la scarlattina, la difterite, le malattie del sangue, le malattie fungine, gli effetti della radioterapia. La clinica è dominata da disfagia e dolore intenso, aggravato dopo aver mangiato, nausea, vomito. Con il vomito vengono rilasciati film di fibrina, potrebbe esserci emottisi. Endoscopicamente, sulle aree interessate della mucosa, si trovano placche fibrinose grigie e giallo-grigie, formate da strati di fibrina e detriti che ricoprono la superficie della mucosa. Con il rigetto delle pseudomembrane, si formano erosioni piatte a lenta guarigione, a volte ulcere sanguinanti. Dopo un grave processo infettivo, le stenosi membranose rimangono nell'esofago, che scompaiono dopo ripetuti bougienage. L'esofagite membranosa (esfoliativa) per eziologia è chimica (ustioni dell'esofago), infettiva (le cause sono sepsi, fuoco di Sant'Antonio, vaiolo, infezione da herpes generalizzata). La clinica della malattia è variabile: dalle forme lievi, diagnosticate endoscopicamente, a quelle gravi. Nella clinica dell'esofagite membranosa grave, prevalgono intossicazione, disfagia e sindrome del dolore. Possibile sanguinamento, perforazione dell'esofago, mediastinite, che, di regola, terminano con la morte. Nell'esame endoscopico si osserva un danno a tutti gli strati dell'esofago, il cui epitelio viene respinto dagli strati. Quando la malattia di base scompare, a volte rimangono nell'esofago stenosi membranose simmetriche e asimmetriche o stenosi cicatriziali ruvide. L'esofagite necrotizzante è una forma rara di infiammazione acuta dell'esofago. Il suo sviluppo è facilitato dalla ridotta immunità in malattie così gravi come sepsi, febbre tifoide, candidosi, insufficienza renale allo stadio terminale. La clinica è caratterizzata da disfagia dolorosa, vomito, debolezza generale, sanguinamento, frequente sviluppo di mediastinite, pleurite, polmonite. Dopo il trattamento della malattia sottostante, le stenosi rimangono nell'esofago, diagnosticate come alterazioni precancerose facoltative. L'esofagite settica è una rara infiammazione locale o diffusa delle pareti dell'esofago ad eziologia streptococcica o che si manifesta quando la mucosa è danneggiata da un corpo estraneo, con ustioni, ulcerazioni, e può passare dagli organi vicini. A volte l'esofagite flemmonica acuta si presenta come una complicazione di qualsiasi forma di esofagite acuta, portando alla fusione purulenta delle pareti dell'esofago. Il crollo delle pareti è accompagnato da una penetrazione di pus nel tessuto del mediastino, dallo sviluppo di mediastinite, pleurite, bronchite purulenta, polmonite, spondilite, rottura dell'aorta o altri grandi vasi. L'adesione di un'infezione anaerobica può portare a enfisema mediastinico o pneumotorace spontaneo. Il quadro clinico è caratterizzato da grave intossicazione, febbre alta, dolore dietro lo sterno e al collo, vomito. All'esame, c'è gonfiore al collo, la mobilità in questa parte della colonna vertebrale è limitata. La posizione della testa è forzata, con un'inclinazione su un lato. La malattia si trasforma spesso in mediastinite purulenta. Negli esami del sangue - iperleucocitosi, VES accelerata. L'esame strumentale (raggi X, endoscopico) nella fase acuta non è indicato. Durante il periodo di cicatrizzazione, un esame radiografico è obbligatorio a causa del rischio di sviluppare deformità macroscopiche e stenosi cicatriziale dell'esofago. trattamento. Принципы лечения острого эзофагита: этиотропное, патогенетическое и симптоматическое. Trattamento etiotropico - trattamento della malattia sottostante. Nelle malattie infettive complicate da esofagite acuta, vengono utilizzati antibiotici (per via parenterale). Con pronunciati cambiamenti necrotici ed emorragici nell'esofago, si raccomanda di astenersi dal mangiare per 2-3 settimane. In questo periodo sono indicate nutrizione parenterale, somministrazione endovenosa di idrolizzati proteici, miscele di aminoacidi, intralipidi, vitamine e terapia di disintossicazione. Dopo aver ridotto l'infiammazione, vengono prescritti cibi che risparmiano termicamente e chimicamente: latte caldo, panna, zuppe di verdure, cereali liquidi. Per ridurre i sintomi locali dell'infiammazione - soluzioni interne di tannino 1%, collargol - 2%, novocaina - 1-2% prima dei pasti. Gli astringenti vengono presi in posizione orizzontale con la testata del letto abbassata. In assenza dell'effetto della somministrazione locale di preparati astringenti, vengono prescritti analgesici non narcotici per via parenterale. Per ridurre gli effetti della discinesia esofagea, i farmaci procinetici (cerucal, raglan, cisapride) vengono utilizzati per via orale prima dei pasti. Con erosioni multiple, sono indicate preparazioni di bismuto (denol, vikair), iniezioni di solcoseryl. Con l'esofagite emorragica, complicata da sanguinamento, vengono utilizzati preparati di acido aminocaproico, vikasol, dicynone. Con un'emorragia massiccia, viene prescritta una trasfusione di sangue o plasma. Con esofagite purulenta e necrotica, il paziente deve essere sottoposto a nutrizione parenterale per molto tempo, viene utilizzata una terapia massiccia con diversi antibiotici e l'ascesso viene drenato. Le stenosi esofagee sono corrette dal bougienage. In rari casi, viene posizionata una gastrostomia. Previsione. Прогноз катарального и эрозивного эзофагитов благоприятный. Возможно самопроизвольное исчезновение симптомов эзофагита при условии адекватной коррекции основного заболевания. Прогноз псевдомембранозного, экфолиативного, флегмонозного эзофагитов серьезен. Во всех случаях при условии выздоровления от основного заболевания эзофагит заканчивается образованием рубцовых стриктур, которые в дальнейшем требуют коррекции. Больные с тяжелыми формами эзофагита, осложнившегося стриктурами пищевода, нетрудоспособны. La prevenzione dell'esofagite acuta consiste in una diagnosi e un trattamento adeguati e tempestivi della malattia sottostante. 2. Esofagite cronica L'esofagite cronica è un'infiammazione cronica della membrana mucosa dell'esofago che dura fino a 6 mesi. La variante più comune è l'esofagite peptica (esofagite da reflusso), che può essere complicata dall'ulcera peptica dell'esofago. Eziologia e patogenesi. Главная причина заболевания - постоянный рефлюкс в пищевод желудочного содержимого, иногда желчи и кишечного содержимого, т. е. пептический эзофагит - это асептический ожог пищевода кислотой желудка. Nella patogenesi dell'esofagite da reflusso, sono importanti il rigurgito di contenuto acido e una violazione della purificazione e dello svuotamento dell'esofago da esso. Il tasso di clearance dell'esofago dall'irritazione chimica è chiamato clearance esofagea. Con una clearance normale, il reflusso singolo di secrezioni aggressive non provoca esofagite da reflusso. Cibo caldo, alcol, fumo e altri fattori esogeni riducono la clearance dell'esofago. Questi fattori includono il fast food, in cui una quantità significativa di aria viene ingerita insieme al cibo. Anche la qualità del cibo conta: carne grassa, strutto, pasta, spezie piccanti aiutano a ritardare l'evacuazione del cibo dallo stomaco, seguita dal reflusso del contenuto nell'esofago. I farmaci riducono significativamente il tono dello sfintere esofageo inferiore e promuovono il reflusso: calcioantagonisti, nitrati, analgesici narcotici, farmaci anticolinergici, teofillina e suoi analoghi, farmaci del gruppo delle prostaglandine. Esistono cinque criteri per la patogenicità del reflusso nella genesi dell'esofagite peptica: frequenza, volume, rigurgito, composizione chimica, condizione della mucosa esofagea e sensibilità a un fattore chimico (l'infiammazione delle pareti riduce la sensibilità), velocità di svuotamento (clearance) , che dipende principalmente dalla peristalsi attiva, dall'azione alcalinizzante della saliva e del muco. L'insorgenza dell'esofagite da reflusso è favorita dall'ernia dell'apertura esofagea del diaframma, dall'ulcera duodenale, dai disturbi post-gastroresezione e dalle allergie. Anche la predisposizione allergica conta. L'esame morfologico dei pazienti con esofagite peptica mostra edema, iperemia della mucosa, infiltrazione della sottomucosa del segmento sopradiaframmatico dell'esofago. Esistono due opzioni per la diffusione dell'infiammazione cronica: esofagite da reflusso totale e locale. Con il coinvolgimento nel processo di più di 2/3 della mucosa esofagea, è possibile lo sviluppo di tracheite da reflusso, bronchite da reflusso. Nella parte superiore delle pieghe esofagee si verificano erosioni, piccole ulcere (nei luoghi di massima irrigazione con contenuto gastrico). L'infiammazione cronica dell'esofago porta alla contrattura spastica e all'accorciamento dell'organo. Quadro clinico. К типичным признакам рефлюкс-эзофагита относят жжение за грудиной, изжогу, срыгивание, которое усиливаются в положении лежа, дисфагию, положительный эффект от приема антацидов. Могут возникать боли за грудиной после еды, напоминающие стенокардитические. L'insorgenza di dolore nell'esofagite da reflusso è associata all'irritazione peptica della parete esofagea e ai suoi spasmi durante il rigurgito del contenuto gastrico acido, nonché alla violazione della mucosa prolassata. Caratteristiche distintive di questo dolore: il suo carattere lungo e bruciante, la localizzazione nel processo xifoideo, l'irradiazione lungo l'esofago, meno spesso nella metà sinistra del torace, nessun effetto evidente dall'assunzione di antiacidi, antispastici, aumentato in posizione orizzontale, soprattutto dopo mangiare. Particolare attenzione nella diagnosi clinica dovrebbe essere prestata ai sintomi minori della disfagia, come la sensazione di un nodulo dietro lo sterno, una sensazione di cibo caldo che passa attraverso l'esofago. Un segno di esofagite che inizia gradualmente può essere la salivazione e l'abitudine di bere acqua con il cibo. L'esame obiettivo dei pazienti con esofagite da reflusso non fornisce informazioni diagnostiche significative. Le complicanze dell'esofagite da reflusso comprendono sanguinamento, ulcerazione, stenosi, accorciamento dell'esofago e tumore maligno. L'esofagite da reflusso cronico può portare allo sviluppo di un'ernia iatale assiale. Диагностика и дифференциальный диагноз. Наиболее ценным методом исследований при данной патологии является эндоскопия, в ходе которой отмечаются гиперемия, отек, утолщение складок слизистой оболочки. Достоверен покрывающий слизистую оболочку белесоватый налет, который в начальных стадиях болезни может быть тонким, едва заметным, при длительном процессе - массивным белым или грязно-серым. На отдельных участках на фоне белого налета нередко видна ярко-красная слизистая оболочка пищевода. В ряде случаев выявляются эрозивные и язвенные дефекты в виде полос. Изменения слизистой оболочки могут соответствовать любой из четырех стадий эзофагита: от гиперемии до "плачущей" слизистой оболочки. При выраженном эзофагите в просвете скапливается много слюны и слизи. рН-метрия, в отличие от эндоскопии, дает возможность более объективно оценить клиренс пищевода. Рентгенологически обнаруживают гастро-пищеводный рефлюкс. È necessario differenziare l'esofagite da reflusso con l'ulcera peptica dello stomaco e del duodeno, la malattia coronarica, la colecistite cronica e la pancreatite. Il sintomo principale nella diagnosi differenziale è il dolore. La differenziazione con l'ulcera peptica è aiutata dall'assenza di dolori tardivi e "affamati" nell'esofagite, nonché dai dati ottenuti dall'endoscopia dell'esofago e dello stomaco. Il dolore coronarico, a differenza dell'esofagite, è caratterizzato da una connessione con lo stress fisico ed emotivo, l'effetto dei nitrati, i segni di ischemia sull'ECG, compresi quelli secondo l'ergometria della bicicletta. I dati ecografici degli organi addominali aiutano a escludere la patologia della cistifellea e del pancreas come causa della sindrome del dolore. trattamento. Терапия рефлюкс-эзофагита включает в себя лечение заболеваний, его вызвавших, и назначение антирефлюксной терапии. Si consiglia ai pazienti di evitare di sollevare pesi, piegarsi. È necessario assumere la posizione corretta durante il riposo e il sonno (la testiera è rialzata di 15-20 cm, con un angolo di 30-50 °). Si consiglia di normalizzare il peso corporeo, mangiare in modo frazionato (l'ultimo pasto - 3 ore prima di coricarsi). Alcol e cibi piccanti sono esclusi dalla dieta. Assegna adsorbenti e farmaci alcalinizzanti che hanno un effetto protettivo sulla mucosa. Queste sostanze includono Venter, che viene somministrato per via orale 1 g (preferibilmente sotto forma di sospensione) 30-40 minuti prima dei pasti 3 volte al giorno e la 4a volta - a stomaco vuoto prima di coricarsi. Il corso del trattamento è di 8-10 settimane. Almagel, phosphalugel, maalox, gastal hanno un effetto simile. Questi farmaci vengono utilizzati nel periodo interdigestivo (1/2-2 ore dopo i pasti e durante la notte) fino alla completa remissione. Phosphalugel e Maalox sono prescritti 1-2 pacchetti 2-3 volte al giorno, gastal - 2-3 compresse al giorno. Non è consigliabile utilizzare la soda di tè, una miscela di Bourget, argilla bianca a causa dell'insufficiente efficienza. Ad azione avvolgente e astringente ha nitrato di bismuto 1 g 3-4 volte al giorno. È stata notata un'elevata attività antireflusso di un nuovo antiacido, il topalkan. Acque minerali - "Borjomi", "Essentuki No. 4", "Jermuk", "Smirnovskaya" hanno un effetto alcalinizzante. Per ridurre la secrezione gastrica acida, vengono prescritti anti-H.2recettori dell'istamina (cimetidina, ranitidina, famotidina), inibitori della Ka-K-ATPasi (omeprazolo), un bloccante selettivo dei recettori M-colinergici delle cellule parietali, suo analogo buscopan. La cimetidina è prescritta 400 mg 2 volte al giorno, ranitidina - 300 mg e famotidina - 40 mg una volta la sera dopo cena. L'omeprazolo è raccomandato per le forme resistenti di esofagite da reflusso erosiva e ulcerosa. È prescritto a 30-40 mg al giorno per 3-4 settimane. Per normalizzare i disturbi dell'evacuazione motoria nella malattia da reflusso, vengono prescritti metoclopramide (cerucal, raglan, perinorm, biomral), prepulsid (sizepride, motilium, domperidone, coordinax). La metoclopramide e i suoi analoghi di 2a generazione aumentano il tono dello sfintere esofageo inferiore, riducono la pressione intragastrica e accelerano l'evacuazione dallo stomaco. Assegna metoclopramide 1 compressa 3-4 volte al giorno prima dei pasti o 2 ml per via intramuscolare 2 volte al giorno. Il farmaco è generalmente ben tollerato. Quando lo si utilizza, sono possibili secchezza delle fauci, sonnolenza, acufene, che diminuiscono dopo aver mangiato. Sizepride è un nuovo agente procinetico gastrointestinale. Aumenta il tono dello sfintere esofageo inferiore, migliora la clearance esofagea, migliora la funzione di evacuazione motoria del tubo digerente e sopprime i reflussi patologici (gastroesofageo e duodenogastrico). Il farmaco, a differenza della metoclopramide, non blocca i recettori delle donamine, non è uno stimolante diretto dei recettori anticolinergici ed è privo di effetti collaterali inerenti al cerucal e ai suoi analoghi. È prescritto per via orale a 5 o 10 mg 2-3 volte al giorno. Il corso del trattamento dura da 2-3 settimane a 2-3 mesi. Cesapride con esofagite da reflusso può essere utilizzato come monoterapia. Previsione e prevenzione. Прогноз для жизни и трудовой деятельности благоприятен. При осложненном течении прогноз определяется своевременностью и качеством оказания медицинской помощи. Пациентам с тяжелым течением устанавливается группа инвалидности. Больные с хроническим рефлюкс-эзофагитом должны находиться под наблюдением гастроэнтеролога. Не реже 2 раз в год показаны эндоскопические и морфологические исследования в связи с возможностью малигнизации. 3. Ulcera peptica dell'esofago L'ulcera peptica dell'esofago è una malattia acuta o cronica caratterizzata dall'ulcerazione della mucosa dell'esofago distale sotto l'influenza del succo gastrico attivo. Eziologia e patogenesi. Хронические пептические язвы пищевода являются осложнениями рефлюкс-эзофагита и хиатальной грыжи. Их возникновению способствуют внутренний короткий пищевод, очаговая метаплазия слизистой, гетеротопия слизистой желудка в пищевод, рефлюксная болезнь при недостаточности кардии, заболевания, сопровождающиеся частой рвотой (постваготомический синдром, синдром приводящей петли, хронический алкоголизм). Le ulcere acute dell'esofago sono possibili con secchezza patologica della mucosa esofagea (xerosi), allergie ai farmaci, uso di FANS, infezioni fungine, infezioni virali, ustioni cutanee e malattie del sistema nervoso centrale. Queste ulcere sono considerate sintomatiche. Quadro clinico. У части пациентов отмечается сочетанное язвенное поражение слизистой оболочки пищевода и гастродуоденальной зоны. Симптомы пептической язвы пищевода напоминают клинику пептического эзофагита: упорная изжога, усиливающаяся после еды, при наклоне туловища, в положении лежа, возникают срыгивание, боль при глотании, нарушение прохождения твердой пищи. Осложнения, типичные для язв пищевода: перфорация, кровотечение, пенетрация, стриктура. Кровотечение проявляется кровавой рвотой, меленой, гипохромной анемией, падением сердечной деятельности. Перфорация пищевода диагностируется крайне редко. I sintomi clinici della perforazione sono indistinguibili dai sintomi della lesione meccanica acuta penetrante e non penetrante da corpi estranei. Circa il 14% delle ulcere esofagee penetra nei tessuti circostanti. Диагностика и дифференциальный диагноз. По клиническим симптомам заподозрить пептическую язву крайне трудно. Диагноз верифицируется в ходе инструментального и лабораторного исследования. Наиболее информативно рентгенологическое и эндоскопическое исследование. Рентгенологически язва представляет собой нишу в супракардиальном отделе пищевода с небольшим перифокальным отеком слизистой оболочки. Пищевод в области язвы спастически сокращен, над ним определяется небольшое супрастенотическое расширение. Язву сопровождают признаки гиперкинезии и рефлюкс-эзофагита, очень часто встречаются симптомы хиатальной грыжи. Иногда язва напоминает небольшой эпифренальный дивертикул, однако последний не имеет типичного клинического течения, не сочетается с недостаточностью кардии, грыжей, эзофагитом. È più difficile distinguere un'ulcera peptica dell'esofago dal cancro endofitico ulcerato, che è accompagnato da rigidità delle pareti e sollievo della mucosa, e un'asta asimmetrica, da segni radiologici. Le informazioni più affidabili nella verifica dell'ulcera peptica dell'esofago sono fornite dall'endoscopia e dalla biopsia multipla dai bordi dell'ulcera. Quando si fa avanzare l'endoscopio all'ulcera peptica, vengono rilevati segni di esofagite di stadio I-IV, disfunzione motoria dell'esofago, edema perifocale e iperemia della mucosa. Un'ulcera acuta è solitamente rotonda o ovale, con bordi ripidi, ricoperta da un rivestimento biancastro o verde. Un'ulcera cronica ha un fondo piatto con pareti dense e irregolari, bordi delicati, depositi purulento-fibrinosi, focolai di granulazioni e sovrapposizioni cicatriziali. Per escludere la malignità, vengono prelevate 4-6 biopsie dai bordi dell'ulcera. L'esame endoscopico rivela singoli difetti peptici, allungati lungo l'asse dell'esofago. La loro lunghezza varia entro 1-10 cm, ma più spesso non supera 1 cm L'ulcera è spesso poco profonda, il suo fondo è ricoperto da un rivestimento biancastro. L'iperemia, l'edema della mucosa e le singole erosioni spesso riflettono una moderata reazione infiammatoria perifocale. Dopo la guarigione di un'ulcera peptica, nell'esofago rimangono una ruvida cicatrice lineare o stellata o una ruvida deformità simile a un diverticolo della parete e un restringimento del lume. È necessario differenziare le ulcere peptiche dell'esofago con ulcerazioni di natura specifica (con tubercolosi, sifilide). In queste situazioni, i test sierologici specifici, i risultati degli studi istologici e batteriologici aiutano significativamente. La combinazione della patologia dell'esofago con danni ai polmoni e ad altri organi rende necessario esaminare in modo mirato il paziente in relazione a un processo specifico. trattamento. Лечение включает назначение диеты: рекомендуется механически и химически щадящая пища, которая принимается небольшими порциями 5-6 раз в день. Для предотвращения рефлюкса содержимого из желудка в пищевод положение больного в постели должно быть с приподнятым изголовьем. Медикаменты принимают лежа. Назначают монотерапию препаратом одной из следующих фармакологических групп: антисекреторные, в том числе антациды и адсорбенты, стимуляторы моторно-эвакуаторной функции желудка (прокинетики), препараты - имитаторы слизи. Терапия осуществляется длительно - 1,5-3 месяца. Indicazioni per il trattamento chirurgico - mancanza di guarigione entro 6-9 mesi, decorso complicato (perforazione, penetrazione, stenosi, sanguinamento). Previsione e prevenzione. Течение заболевания рецидивирующее. Прогноз для жизни и трудовой деятельности благоприятен. Рекомендуется периодическое (1-2 раза в год) обследование в амбулаторных условиях у гастроэнтеролога с применением эндоскопии и биопсии. Viene effettuata la prevenzione stagionale (primavera - autunno) dell'esofagite da reflusso. CONFERENZA N. 10. Malattie dell'apparato digerente. Malattie dello stomaco. Gastrite cronica La gastrite cronica è una malattia clinicamente caratterizzata da dispepsia gastrica e morfologicamente - da cambiamenti infiammatori e degenerativi nella mucosa gastrica, processi di rinnovamento cellulare alterati e un aumento del numero di plasmacellule e linfociti nella membrana stessa della mucosa. Eziologia e patogenesi. Allo stato attuale dello sviluppo della gastroenterologia, è accertato che la comparsa della gastrite cronica è facilitata dall'espansione microbica dell'Helicobacter pylori (HP), che provoca gastrite antrale nel 95% dei casi e pangastrite nel 56% dei casi. A loro volta, i cosiddetti fattori eziologici per l'insorgenza della gastrite cronica possono essere attribuiti con un elevato grado di certezza a fattori di rischio (alimentazione squilibrata irregolare, fumo, assunzione di alcol, ipersecrezione di acido cloridrico e pepsina). Il ruolo principale nello sviluppo della malattia appartiene anche ai meccanismi autoimmuni, accompagnati dall'accumulo di anticorpi contro le cellule parietali della mucosa gastrica, dall'ereditarietà aggravata e dall'uso di farmaci che hanno un effetto dannoso sulla mucosa gastrica. Classificazione. Nel 1990, al IX Congresso Internazionale dei Gastroenterologi in Australia, fu adottata una nuova sistematizzazione della gastrite cronica, chiamata sistema Sydney. Basi istologiche di classificazione. 1) Eziologia: gastrite cronica associata a HP, gastrite autoimmune, idiopatica, acuta da farmaci. 2) Topografia: antrale, fundica, pangastrite. 3) Morfologia: forme acute, croniche, speciali. Base di classificazione endoscopica: 1) gastrite dell'antro dello stomaco; 2) gastrite del corpo dello stomaco; 3) pangastrite; 4) alterazioni della mucosa gastrica: edema, eritema, vulnerabilità della mucosa, essudato, erosioni piatte, erosioni elevate, iperplasia delle pieghe, atrofia delle pieghe, visibilità del pattern vascolare, emorragie sopramucose. Quadro clinico. La gastrite cronica è una delle malattie più comuni nella clinica di medicina interna. La sua frequenza tra gli abitanti del mondo varia dal 28 al 75%. La gastrite cronica si manifesta più spesso con sintomi di dispepsia gastrica e dolore nella regione epigastrica. Raramente è asintomatico. Il dolore è solitamente localizzato nella regione epigastrica. Esiste una chiara connessione tra il suo verificarsi con l'assunzione di cibo e la localizzazione del processo infiammatorio nello stomaco. Nei pazienti con gastrite delle sezioni subcardiche e cardiache dello stomaco, il dolore nella regione epigastrica si verifica 10-15 minuti dopo un pasto, con patologia del corpo dello stomaco - 40-50 minuti dopo un pasto. I dolori "tardi", "affamati" sono tipici della gastrite della sezione di uscita dello stomaco o della duodenite. Il dolore a "due onde" - dopo aver mangiato ea stomaco vuoto - si osserva con gastrite del subcardiaco e dell'antro. Con un processo diffuso, il dolore è localizzato nella regione epigastrica, si verifica dopo aver mangiato ed è di natura pressante. Dicono del decorso asintomatico della gastrite quando non è possibile stabilire la relazione tra il dolore nella regione epigastrica e la lesione, che si verifica quando è di origine endogena (la gastrite diventa secondaria alla patologia di altri organi e sistemi). Un posto altrettanto importante nel quadro clinico della gastrite cronica è la sindrome dispeptica: nausea, eruttazione (acido, amaro, marcio), bruciore di stomaco, stitichezza o diarrea, feci instabili. Con la gastrite antrale isolata, i disturbi di bruciore di stomaco e stitichezza, derivanti dall'ipersecrezione di acido cloridrico e pepsina, diventano fondamentali. Con pangastrite con segni di grave atrofia, predominano nausea, eruttazione "marcio", feci instabili o diarrea, tipica dell'iposecrezione di acido cloridrico e pepsina. La nausea persistente è caratteristica della gastrite secondaria nella pancreatite cronica, colecistite cronica, che si verifica con discinesia ipomotoria della cistifellea. diagnostica. La gastrite cronica dura a lungo, con un aumento dei sintomi nel tempo. Le riacutizzazioni sono provocate da disturbi nutrizionali. Il quadro fisico della gastrite cronica è piuttosto scarso. Nell'80-90% dei pazienti durante un'esacerbazione della malattia, uno studio oggettivo determina solo il dolore locale nella regione epigastrica. Quando la gastrite cronica è combinata con duodenite, colecistite o pancreatite, è possibile determinare la localizzazione del dolore che non è tipica della gastrite, ma caratteristica della patologia di un altro organo. Gli esami del sangue e delle urine generali, i parametri biochimici del sangue nei pazienti con gastrite cronica non differiscono dai parametri corrispondenti negli individui sani. In uno studio coprologico, non ci sono cambiamenti nelle analisi o potrebbero esserci segni di un disturbo digestivo. Quando si studia il contenuto gastrico della secrezione acida mediante pH-metria, si notano sia i segni di ipersecrezione acida che una diminuzione della produzione di acido. Gli indicatori della formazione di pepsina nella gastrite cronica sono più persistenti e diminuiscono sullo sfondo dell'anacidità persistente nel danno d'organo diffuso. È più probabile che un esame radiografico escluda altre malattie dello stomaco (ulcera, cancro), aiuti nella diagnosi della malattia di Menetrier piuttosto che confermare la diagnosi di gastrite cronica. A causa della scarsità delle manifestazioni cliniche della malattia, nonché della non specificità dei test di laboratorio, la diagnosi di gastrite cronica si basa sui risultati di studi endoscopici e morfologici. L'endoscopia rivela cambiamenti nella gravità della mucosa gastrica di varia gravità: edema, eritema, vulnerabilità della mucosa, essudato, erosioni piatte, erosioni in rilievo, iperplasia o atrofia delle pieghe, visibilità del pattern vascolare, emorragie sottomucose. Parlano di gastrite cronica con un aumento del numero di plasmacellule e linfociti nella propria membrana della mucosa (in contrasto con la gastrite acuta, quando compaiono i leucociti polimorfonucleati). In connessione con quanto sopra, l'identificazione morfologica dell'infiammazione nella gastrite potrebbe non coincidere con l'interpretazione dei dati del clinico. L'attività delle alterazioni infiammatorie della mucosa gastrica viene valutata morfologicamente e morfometricamente in base al grado di infiltrazione leucocitaria della lamina propria o dell'epitelio. Non dobbiamo perdere di vista il fatto che la gastrite autoimmune non è attiva. Vengono quantificati i cambiamenti morfologici (deboli, moderati e gravi) - infiammazione, attività, atrofia, metaplasia - e il grado di contaminazione da HP. Le manifestazioni cliniche caratteristiche della gastrite si osservano anche in altre malattie dell'apparato digerente, pertanto, nel processo di diagnosi, sono necessari l'ecografia della cavità addominale, un approfondito esame endoscopico e morfologico degli organi digestivi. Diagnosi differenziale. La più difficile è la diagnosi differenziale della gastrite con malattie funzionali dello stomaco, ulcera peptica dello stomaco e del duodeno, colecistite cronica e pancreatite e cancro allo stomaco. Le malattie funzionali dello stomaco, simili alla gastrite cronica, possono manifestarsi in modo latente o essere accompagnate da dolore e sintomi dispeptici. Sono caratterizzati da una breve durata, dalla presenza di sintomi nevrotici generali che prevalgono nel quadro clinico della malattia (come debolezza, affaticamento, irritabilità, cefalea, umore instabile, sudorazione). Con disturbi della funzione dello stomaco, il dolore non dipende dalla qualità del cibo o si manifesta dopo l'uso di un prodotto rigorosamente definito. Spesso c'è una sindrome di acidismo (bruciore di stomaco, eruttazione acida, sapore acido in bocca), che, a differenza della gastrite con aumento della funzione secretoria, non aumenta dopo aver mangiato, ma con eccitazione, lunghe pause nel cibo. Il vomito nelle patologie funzionali dello stomaco si sviluppa secondo il meccanismo di un riflesso condizionato, porta sollievo al paziente e non porta a un significativo deterioramento delle condizioni generali. Nella gastrite cronica, di solito si verifica durante un'esacerbazione e non porta sollievo al paziente. Un sintomo frequente di disfunzione dello stomaco è una forte eruzione d'aria. Nella gastrite cronica, è associata a una ridotta digestione del cibo o alla motilità gastrica e può essere acida se la secrezione è preservata, o con odore di uova marce se è ridotta. Nello studio della secrezione gastrica nella gastrite, all'inizio della malattia vengono rilevati valori normali di secrezione e, in futuro, una tendenza a una diminuzione della secrezione di succo gastrico. Con le malattie funzionali dello stomaco, si osserva spesso l'eterochilia. L'esame a raggi X dello stomaco consente di confermare tali forme di gastrite come rigida, angrale, iperplastica gigante, poliposi e in caso di violazioni della funzione di evacuazione motoria dello stomaco (gastroptosi, ipotensione) indica la natura funzionale di la malattia. Il metodo di ricerca più prezioso per la diagnosi differenziale della gastrite cronica e delle malattie funzionali dello stomaco è la gastroscopia, che consente, in casi controversi, di accertare alterazioni della mucosa gastrica caratteristiche della gastrite o malattie funzionali dello stomaco. La diagnosi differenziale della gastrite cronica con ulcera peptica è descritta nella prossima lezione. Il cancro gastrico ha un quadro molto simile con la gastrite con ridotta funzione secretoria. La diagnosi precoce del cancro gastrico sulla base dei segni clinici è difficile, soprattutto nei pazienti che soffrono di gastrite da molto tempo. Di grande importanza per la diagnosi di cancro sono la comparsa di dolore persistente persistente, poco dipendente dall'assunzione di cibo, debolezza generale e affaticamento immotivati, perversione dell'appetito, nonché una progressiva diminuzione del peso corporeo del paziente. Il rilevamento di un tumore alla palpazione si riferisce alle fasi successive del processo del cancro. Sintomi come un cambiamento nel benessere del paziente, una rapida diminuzione dell'acidità del succo gastrico, una "carenza" di acido cloridrico, la comparsa di cellule atipiche nel succo gastrico, una reazione positiva al sangue occulto nelle feci dovrebbero indurre il medico a sospettare un cancro gastrico. Di importanza decisiva nella diagnosi differenziale sono gli studi radiografici e gastroscopici con biopsia mirata della mucosa gastrica. Nei pazienti con gastrite cronica con ridotta funzione secretoria, l'esame radiografico rivela atrofia della sua membrana mucosa, confermata anche dalla gastroscopia. Con la biopsia mirata in questi casi, vengono rivelati cambiamenti strutturali e atrofia della mucosa. Per il cancro gastrico, l'esame radiografico è caratterizzato dalla presenza di un difetto di riempimento, dall'assenza di pieghe della mucosa o da un cambiamento nella loro natura e dall'assenza di peristalsi in alcune aree. L'endoscopia dello stomaco consente di rilevare un tumore nella prima fase del suo sviluppo, quando il tumore è ancora all'interno della mucosa gastrica e il trattamento chirurgico porta al recupero in oltre il 90% dei casi. Colecistite cronica. Nella colecistite cronica, il dolore è localizzato nell'ipocondrio destro ed è di natura sorda. Con la colecistite calcolotica, il dolore è acuto, colico, che si irradia alla regione sottoscapolare destra. L'insorgenza del dolore è associata al consumo di cibi grassi o alla guida sobbalzante. Nella gastrite cronica, il dolore all'epigastrio è diffuso, sordo, non c'è irradiazione, si verifica immediatamente dopo aver mangiato cibo secco o in violazione della dieta. Con gastrite e colecistite, il dolore è accompagnato da sintomi dispeptici, ma una sensazione di pesantezza nell'epigastrio, pienezza, eruttazione di cibo o aria, un sapore metallico in bocca sono più caratteristici della gastrite. Il vomito nella gastrite cronica è raro. Oggettivamente, nella colecistite cronica, soprattutto calcolosi, rilevano tensione nella parete addominale anteriore, iperestesia cutanea nell'ipocondrio destro, che non è tipica della gastrite cronica. Alla palpazione dell'addome in caso di colecistite cronica, si nota dolore nella localizzazione della cistifellea. La gastrite cronica è caratterizzata da dolore diffuso. Nei pazienti con colecistite cronica, l'esame della bile rivela un aumento della quantità di muco e leucociti. La gastrite cronica è caratterizzata da un quadro normale della bile sullo sfondo dei cambiamenti nella secrezione e nell'acidità del succo gastrico, nonché da altre funzioni dello stomaco (assorbimento, motore). Un esame radiografico della cistifellea in pazienti con colecistite cronica rivela un cambiamento nella sua funzione di evacuazione, così come i calcoli. Pancreatite cronica. Nella pancreatite cronica, il dolore è localizzato nella metà sinistra dell'addome, irradiandosi alla regione sottoscapolare sinistra, alla parte bassa della schiena e all'area circostante. L'insorgenza del dolore è associata al consumo di cibi abbondanti, spesso grassi, e di alcol. Se la gastrite cronica è caratterizzata da un decorso lungo e monotono della malattia, nella pancreatite cronica è graduale. Un esame obiettivo in caso di pancreatite cronica rivela iperestesia della pelle nell'ipocondrio sinistro, il dolore corrisponde topograficamente alla posizione del pancreas. In uno studio di laboratorio sul succo pancreatico nella pancreatite cronica, si riscontra un cambiamento persistente dell'alcalinità e degli enzimi: il livello di diastasi nel sangue e nelle urine può cambiare, il che non è il caso della gastrite cronica. Radiologicamente, la pancreatite cronica è caratterizzata da un'aumentata inversione dell'anello duodenale, un forte aumento della sua papilla maggiore (sintomo di Frostberg) e talvolta la presenza di aree di calcificazione del pancreas. Dovrebbe essere eseguita anche la diagnostica intranosologica di varie forme di gastrite cronica. Pertanto, la malattia associata all'HP procede clinicamente con sintomi di ulcere duodenali e in alcuni casi può procedere in modo latente. L'esame endoscopico e morfologico rivela antropiloroduodenite. Le erosioni nella gastrite da Helicobacter pylori sono solitamente localizzate nell'area di grave infiammazione (zona antropica dello stomaco). La gastrite cronica autoimmune è clinicamente caratterizzata da una sensazione di pesantezza nella regione epigastrica, un retrogusto sgradevole in bocca, eruttazione marcia e nausea. A causa della produzione insufficiente di acido cloridrico, compare la diarrea. Nel 10% dei casi, sullo sfondo della gastrite autoimmune, si riscontrano sintomi B12- anemia da carenza: debolezza, pallore della pelle e delle mucose, unghie fragili, negli esami del sangue - anemia megaloblastica ipercromica. Forme speciali della malattia includono gastrite granulomatosa, eosinofila, ipertrofica (malattia di Menetrier), linfocitaria. La gastrite granulomatosa agisce come una forma indipendente della malattia o più spesso - uno dei componenti di una patologia più grave (morbo di Crohn, tubercolosi, sarcoidosi). La diagnosi è sempre confermata dai risultati dell'esame istologico di campioni bioptici della mucosa gastrica. La gastrite eosinofila è estremamente rara ed è causata da vasculite sistemica. Una storia di reazioni allergiche è obbligatoria. L'esame istologico rivela un'infiltrazione eosinofila della mucosa gastrica. La gastrite ipertrofica (malattia di Menetrier) si manifesta clinicamente con dolore nella regione epigastrica e nausea. Alcuni pazienti possono sperimentare una perdita di peso a causa della diarrea. Negli studi endoscopici, radiologici e morfologici si trovano pieghe mucose ipertrofiche giganti, simili alle convoluzioni del cervello. La gastrite linfocitaria è clinicamente asintomatica; morfologicamente, questa forma è caratterizzata da una pronunciata infiltrazione della mucosa gastrica da parte dei linfociti. trattamento. I pazienti con gastrite necessitano di misure mediche generali: alimentazione regolare ed equilibrata, normalizzazione degli orari di lavoro e di riposo, livellamento delle situazioni stressanti nella vita quotidiana e nel lavoro. La terapia farmacologica è indicata solo in presenza di manifestazioni cliniche di gastrite cronica. I pazienti con gastrite associata a HP vengono trattati con un programma di ulcera peptica (vedi lezione successiva). Gli individui con gastrite autoimmune necessitano di un'integrazione di vitamina B12 (500 mcg una volta al giorno per via sottocutanea per 1 giorni, seguito da una ripetizione di cicli di trattamento), acido folico (30 mg al giorno), acido ascorbico (fino a 5 g al giorno). Se necessario, viene eseguita la terapia sostitutiva con preparati enzimatici (mezim-forte, festal, enzistal, creon, pancitrato, acidin-pepsina). La sindrome del dolore viene solitamente interrotta dalla nomina di antiacidi (maalox, almagel, gastal) o bloccanti del recettore dell'istamina H (ranitidina, famotidina) a dosi terapeutiche medie. Con forme speciali di gastrite, è necessario il trattamento della malattia sottostante. Previsione e prevenzione. La prognosi per la vita e il lavoro è favorevole. I pazienti con gastrite cronica dovrebbero essere registrati con un gastroenterologo. Vengono esaminati clinicamente ed endoscopicamente con una biopsia almeno una volta all'anno per escludere la trasformazione del tumore. Le più pericolose in termini di degenerazione cancerosa sono la gastrite atrofica ipertrofica e diffusa con displasia epiteliale. Nelle forme erosive della malattia complicate da sanguinamento, così come nella forma scompensata della malattia di Menetrier, la prognosi è determinata dalla tempestività e dall'adeguatezza del trattamento chirurgico. La prevenzione della gastrite si riduce a un'alimentazione razionale, al rispetto del regime di lavoro e di riposo, limitando l'assunzione di FANS. CONFERENZA N. 11. Malattie dell'apparato digerente. Malattie dello stomaco. ulcera peptica L'ulcera peptica (ulcera peptica) è una malattia cronica recidivante, manifestata clinicamente da una patologia funzionale della zona gastroduodenale e morfologicamente - da una violazione dell'integrità dei suoi strati mucosi e sottomucosi, e quindi l'ulcera guarisce sempre con la formazione di una cicatrice. eziologia. Il principale fattore eziologico dell'ulcera peptica è l'espansione microbica dell'HP sulla superficie dell'epitelio gastrico. Il significato dell'aggressività batterica nell'eziologia della malattia è stato studiato dal 1983, quando J. Warren e B. Marshall hanno riportato la scoperta di un gran numero di batteri S-spirale sulla superficie dell'epitelio dell'antro dello stomaco. Gli elicobatteri sono in grado di esistere in un ambiente acido grazie alla produzione dell'enzima ureasi, che converte l'urea (dal flusso sanguigno) in ammoniaca e anidride carbonica. I prodotti dell'idrolisi enzimatica neutralizzano l'acido cloridrico e creano le condizioni per modificare il pH dell'ambiente attorno a ciascuna cellula batterica, fornendo così condizioni favorevoli per l'attività vitale dei microrganismi. La colonizzazione totale di HP si verifica sulla superficie delle cellule epiteliali gastriche, che è accompagnata da un danno all'epitelio sotto l'azione delle fosfolipasi. Questi ultimi forniscono la formazione di lecitine tossiche e proteinasi dalla bile, causando la distruzione dei complessi proteici protettivi e del muco. Sullo sfondo di "alcalinizzazione" delle membrane cellulari epiteliali con ammoniaca, il potenziale di membrana delle cellule cambia, aumenta la diffusione inversa degli ioni idrogeno, la morte e la desquamazione dell'epitelio della mucosa gastrica. Tutti questi cambiamenti portano alla penetrazione di HP nella profondità della mucosa gastrica. Non meno importanti nello sviluppo dell'ulcera peptica sono gli effetti neuropsichici, la predisposizione ereditaria, gli agenti infettivi, gli errori alimentari e l'assunzione di determinati farmaci e le cattive abitudini. Per la prima volta, il concetto neurogeno dell'insorgenza della malattia è stato formulato da Bergman, il quale ha affermato che i disturbi ereditari-costituzionali del sistema nervoso autonomo portano a spasmi dei muscoli e dei vasi sanguigni nella parete dello stomaco, ischemia e una diminuzione nella resistenza della mucosa agli effetti aggressivi del succo gastrico. Questa teoria è stata ulteriormente sviluppata da K. N. Bykov e I. T. Kurtsin (1952). Hanno confermato la teoria corticoviscerale dell'ulceragenesi, che si basa su dati sui cambiamenti nell'attività nervosa superiore risultanti da trauma neuropsichico cronico. Integrata e dettagliata dalla dottrina dei legami biochimici e ormonali nella regolazione della secrezione gastrica, della motilità e del trofismo, questa teoria dell'ulceragenesi ha nuovamente conquistato molti sostenitori negli ultimi anni. I fattori ereditari sono popolari tra i ricercatori: l'inerzia dei principali processi nervosi, le proprietà specifiche del gruppo del sangue, le caratteristiche immunologiche e biochimiche, la sindrome del carico ereditario. Nell'insorgenza dell'ulcera peptica, un'importanza essenziale è stata attribuita alle violazioni alimentari. Tuttavia, gli studi clinici e sperimentali condotti negli ultimi due decenni nella maggior parte dei casi non hanno rivelato l'effetto dannoso dei prodotti alimentari sulla mucosa gastroduodenale. La prevalenza dell'ulcera peptica tra contingenti significativi di persone con abitudini alimentari diverse testimonia anche la principale importanza dei fattori nutrizionali. Disturbi del ritmo e della regolarità dell'alimentazione, lunghe pause tra i pasti, alimentazione prematura sono essenziali per l'insorgenza dell'ulcera peptica. I ricercatori hanno espresso opinioni relativamente contrastanti sul ruolo dell'alcol nell'ulceragenesi. È noto che l'alcol provoca cambiamenti atrofici nella mucosa gastrica. Queste osservazioni sono in conflitto con il concetto generale di formazione dell'ulcera. Tuttavia, l'uso frequente di alcol è accompagnato da violazioni della dieta, cambiamenti qualitativi nella composizione del cibo, che alla fine possono causare ulcera peptica allo stomaco e al duodeno. Il ruolo degli effetti medicinali nell'ulceragenesi è oggetto di studio attivo. I risultati degli studi pubblicati in letteratura e i nostri dati indicano che i farmaci antinfiammatori non steroidei e gli ormoni glucocorticoidi hanno le proprietà ulcerogeniche più pronunciate. patogenesi. La patogenesi dell’ulcera peptica non è ancora del tutto chiara. Quando si considerano i processi di ulcerogenesi, è necessario evidenziare una serie di postulati: 1) caratterizzato dalla stagionalità delle esacerbazioni dell'ulcera peptica; 2) vi è una localizzazione predominante delle ulcere peptiche nella zona antropiloroduodenale; 3) è stata rilevata la presenza di acido cloridrico e pepsina nel succo gastrico; 4) si nota un'alta frequenza (fino al 70%) di guarigione spontanea delle ulcere gastriche e duodenali; 5) è presente una gastrite antrale cronica associata a HP; 6) la parte antropica dello stomaco e la parte iniziale del duodeno sono l'"ipotalamo" del tratto gastrointestinale; 7) esiste una predisposizione ereditaria all'insorgenza di ulcere peptiche; 8) l'insorgenza di un'ulcera, la sua recidiva e la sua remissione sono possibili in presenza di tutti i suddetti fattori. Pertanto, il concetto unificato di ulcerogenesi è il seguente. In un paziente con predisposizione ereditaria all'ulcera peptica in presenza di gastrite batterica cronica durante il periodo di disormonosi autunnale o primaverile, si notano solo iperplasia e iperfunzione delle cellule endocrine che secernono gastrina, istamina, melatonina e serotonina. I principali ormoni e le ammine biogene prodotte dalla zona antropicoruduodenale sono coinvolti sia nella stimolazione della secrezione gastrica che nella modifica del trofismo e della proliferazione cellulare, principalmente in questa zona. Sullo sfondo della gastrite batterica attiva e della duodenite, sorgono condizioni favorevoli per la formazione di ulcere. Con la formazione di un difetto peptico, l'attività funzionale delle cellule endocrine diminuisce. Ciò porta a una diminuzione dell'aggressività acido-peptica, a un miglioramento del trofismo tissutale nella zona antropoloroduodenale e alla creazione di condizioni per la guarigione delle ulcere gastriche e duodenali, anche sullo sfondo della continua espansione microbica dell'HP. Nel periodo acuto dell'ulcera peptica si nota l'iperplasia delle cellule produttrici di α-endorfine, che sono citoprotettori universali. Agiscono come i principali meccanismi protettivi nelle ulcere peptiche e forniscono il processo di autolimitazione dell'ulcera e della sua guarigione, sia direttamente che stimolando il sistema immunitario. Allo stesso tempo, gli anticorpi contro l'HP, sintetizzati nella sottomucosa dello stomaco e del duodeno, si legano efficacemente alle cellule batteriche e neutralizzano le tossine dell'HP e contribuiscono alla loro morte. Tutto quanto sopra contribuisce alla creazione di un equilibrio tra i cosiddetti fattori di aggressività e fattori di protezione e la guarigione di un difetto peptico nella zona gastroduodenale. Classificazione. Classificazione (Panfilov Yu. A., Osadchuk M. A., 1991) Localizzazione del difetto peptico: 1) ulcera gastrica (sezioni sottocardiche e cardiache, parte pilorica e canale pilorico, curvatura minore e maggiore); 2) ulcera duodenale (sezione bulbare e postbulbare); 3) ulcere dello stomaco e del duodeno. Il decorso dell'ulcera peptica. 1. Facile. L'esacerbazione dell'ulcera non è più di 1 volta in 1-3 anni, la guarigione del difetto peptico termina entro la 5-6a settimana dall'inizio della terapia, la gravità del dolore e delle sindromi dispeptiche è moderata. 2. Moderato. Recidiva almeno 2 volte l'anno, epitelizzazione dell'ulcera - entro 7-12 settimane, gravità del dolore e sindromi dispeptiche. 3. Pesante. I periodi di remissione non superano i 3-4 mesi. Oltre al forte dolore, ci sono complicazioni. Fasi della malattia: 1) esacerbazione della recidiva dell'ulcera o disturbi funzionali del sistema gastroduodenale; 2) remissione completa (negli aspetti clinici, radiologici, endoscopici e funzionali); 3) incompleto (con la conservazione di disturbi funzionali o strutturali nella zona gastroduodenale). La condizione della mucosa dello stomaco e del duodeno: 1) gastrite cronica; 2) duodenite cronica. Stato funzionale del sistema gastroduodenale Secrezione: normale, aumentata, ridotta. Motilità: normale, accelerata, lenta; evacuazione: duodenostasi normale, accelerata, ritardata. Complicanze: sanguinamento, perforazione, penetrazione, perigastrite, periduodenite, deformità cicatriziale dello stomaco e del duodeno. Quadro clinico. Il quadro clinico dell'ulcera peptica è polimorfico. I sintomi dipendono dal sesso e dall'età del paziente, dal periodo dell'anno, dalla localizzazione e dalle dimensioni dell'ulcera, dalle caratteristiche personali e sociali del paziente e dalle sue qualità professionali. La clinica è determinata da una combinazione di sintomi: il decorso cronico della malattia dal momento della sua insorgenza, la presenza di segni di esacerbazione e remissione della malattia, guarigione del difetto nella mucosa gastrica e duodenale con la formazione di un cicatrice. L'ulcera peptica è rappresentata da due varianti cliniche e morfologiche: l'ulcera gastrica e l'ulcera duodenale. Tradizionalmente si distinguono il dolore e le sindromi dispeptiche. Il principale segno clinico è il dolore nella parte superiore dell'addome. Per la natura della sindrome del dolore, è quasi impossibile distinguere tra gastrite batterica cronica e ulcera peptica. Il dolore nella regione epigastrica, a stomaco vuoto, principalmente in primavera e in autunno, è ugualmente comune sia nell'ulcera peptica che nella gastrite batterica cronica. Il sollievo dalla sindrome del dolore con cibo e antiacidi medicinali si ottiene sia nella gastrite batterica cronica che nell'ulcera peptica. Caratteristica dell'ulcera duodenale è solo la presenza di dolore nella regione epigastrica durante la notte. Il vomito con ulcera peptica è raro. La nausea è molto più comune con le ulcere allo stomaco e le ulcere duodenali. La stitichezza accompagna l'ulcera duodenale cronica. I sintomi dell'ulcera peptica sono determinati dal numero di difetti ulcerativi e dalla loro localizzazione. Le ulcere allo stomaco multiple sono 3 volte più comuni negli uomini. Il quadro clinico in questo caso dipende dalla localizzazione dei difetti peptici. Con ulcere nel corpo dello stomaco, si notano dolore sordo nell'epigastrio senza irradiazione, che si verifica 20-30 minuti dopo aver mangiato e nausea. Con le ulcere della regione subcardiaca, sono caratteristici i dolori sordi sotto il processo xifoideo, che si irradiano alla metà sinistra del torace. Le ulcere gastriche combinate e le ulcere duodenali sono una combinazione di un'ulcera gastrica attiva e un'ulcera duodenale guarita. Sono caratterizzati da conservazione a lungo termine della sindrome del dolore, decorso persistente della malattia, frequenti ricadute della malattia, lenta cicatrizzazione dell'ulcera e frequenti complicanze. Le ulcere extrabulbose comprendono ulcere situate nella regione dello sfintere bulboduodenale e distali ad esso. Il loro quadro clinico ha le sue caratteristiche e ha molto in comune con le ulcere duodenali. Si verificano principalmente in pazienti di età compresa tra 40 e 60 anni. Le ulcere postbulbari sono gravi e soggette a frequenti esacerbazioni, accompagnate da massicce emorragie. Il dolore localizzato nel quadrante superiore destro dell'addome, che si irradia alla schiena o sotto la scapola destra, si verifica nel 100% dei casi. L'intensità, la gravità del dolore, che scompare solo dopo aver assunto analgesici narcotici, porta i pazienti a una grave nevrastenia. La stagionalità delle riacutizzazioni nelle ulcere extrabulbose è registrata in quasi il 90% dei pazienti. In molti pazienti, il sanguinamento gastrointestinale diventa un sintomo cardinale. Le ulcere del canale pilorico sono caratterizzate da un complesso sintomatico chiamato sindrome pilorica: dolore epigastrico, nausea, vomito e significativa perdita di peso. L'esacerbazione della malattia è molto lunga. Sullo sfondo della terapia antiulcera intensiva, l'ulcera si cicatrizza entro 3 mesi. L'abbondante afflusso di sangue al canale pilorico provoca un'emorragia gastrica massiccia. diagnostica. Nel decorso semplice dell'ulcera peptica non si notano cambiamenti nell'esame del sangue generale; sono possibili una leggera diminuzione della VES e una leggera eritrocitosi. Quando si verificano complicazioni negli esami del sangue, appare l'anemia, la leucocitosi - quando il peritoneo è coinvolto nel processo patologico. Non ci sono cambiamenti nell'analisi generale delle urine. Nell'analisi biochimica del sangue nei casi di decorso complicato dell'ulcera peptica, sono possibili variazioni dei parametri del test sialico, della proteina C-reattiva, della reazione DPA. Il metodo tradizionale di ricerca nella patologia dello stomaco è la determinazione dell'acidità del contenuto gastrico. Sono possibili vari indicatori: elevati e normali, in alcuni casi persino ridotti. Un'ulcera duodenale si verifica con un'elevata acidità del succo gastrico. Nell'esame a raggi X, un'ulcera peptica è una "nicchia" - un deposito di sospensione di bario. Oltre a un tale sintomo radiologico diretto, nella diagnosi sono importanti i segni indiretti di un difetto peptico: ipersecrezione del contenuto dello stomaco a stomaco vuoto, disturbi dell'evacuazione, reflusso duodenale, disfunzione del cardias, spasmi locali, convergenza della mucosa pieghe, deformità cicatriziale dello stomaco e del duodeno. La gastroduodenoscopia con biopsia è il metodo più affidabile per diagnosticare l'ulcera peptica. Consente di valutare la natura dei cambiamenti della mucosa ai margini dell'ulcera, nella zona periulcera e garantisce l'accuratezza della diagnosi a livello morfologico. Studi endoscopici e morfologici hanno dimostrato che la maggior parte delle ulcere gastriche si trova nell'area della curvatura minore e dell'antro, molto meno spesso - sulla curvatura maggiore e nell'area del canale pilorico. Il 90% delle ulcere duodenali si trova nella regione bulbare. Un'ulcera peptica è tipicamente di forma rotonda o ovale. Il suo fondo è costituito da masse necrotiche, sotto le quali c'è tessuto di granulazione. La presenza di macchie scure sul fondo indica sanguinamento. La fase di guarigione dell'ulcera è caratterizzata da una diminuzione dell'iperemia della mucosa e da un albero infiammatorio nella zona periulcera. Il difetto diventa meno profondo, gradualmente eliminato dalla placca fibrinosa. La cicatrice si presenta come un'area iperemica della mucosa con retrazioni lineari o stellate della parete. In futuro, durante l'esame endoscopico nel sito dell'ex ulcera, vengono determinate varie violazioni del sollievo della mucosa: deformazioni, cicatrici, restringimento. All'endoscopia, una cicatrice matura dovuta alla sostituzione di un difetto con tessuto di granulazione ha un aspetto biancastro, non ci sono segni di infiammazione attiva. Uno studio morfologico di un campione bioptico ottenuto dal fondo e dai bordi dell'ulcera rivela detriti cellulari sotto forma di un accumulo di muco con una miscela di leucociti in decomposizione, eritrociti e cellule epiteliali desquamate con fibre di collagene situate al di sotto. Diagnosi differenziale. Con l'uso diffuso dell'endoscopia, la diagnosi differenziale delle ulcere dello stomaco e del duodeno (ulcere sintomatiche, ulcerazioni specifiche nella tubercolosi, sifilide, morbo di Crohn, cancro ulcerativo primario, ulcere maligne secondarie) diventa particolarmente importante. Per le ulcere sintomatiche deve esserci una causa che le ha provocate (esposizione estrema, segni clinici e morfologici di malattie endocrine, malattie cardiovascolari e respiratorie, malattie reumatiche). Più che per l'ulcera peptica, sono caratterizzati da una molteplicità di lesioni, una localizzazione predominante nello stomaco e dimensioni significative. Con l'ulcera peptica prevale la sindrome del dolore e con la gastrite cronica - fenomeni dispeptici. Nella gastrite cronica il dolore è lieve o assente, non c'è stagionalità della malattia e dolore limitato alla palpazione; l'aggravamento della malattia dipende spesso dalla natura del cibo. Lo stato della funzione secretoria dello stomaco con la gastrite può essere diverso. Di importanza decisiva sono la gastroscopia e la gastrobiopsia, in cui vengono rilevati i cambiamenti della mucosa caratteristici della gastrite e un'ulcera nell'ulcera peptica. Anche l'ernia iatale (HH) è spesso accompagnata da dolore nell'epigastrio. Tuttavia, a differenza dell'ulcera peptica, questa malattia è caratterizzata principalmente dall'età anziana dei pazienti, dal rapporto del dolore con la posizione del corpo (il dolore aumenta in posizione supina, si indebolisce in posizione eretta). La diagnosi di HH è confermata dai risultati dell'esame radiografico. La colecistite cronica è caratterizzata da dolore nell'ipocondrio e nell'epigastrio destro, spesso irradiato alla scapola destra, alla spalla, all'angolo della mascella inferiore a destra. Con la colecistite acalcolare, hanno un carattere opaco, monotono, pressante e con la colecistite calcolosa acquisiscono il carattere di colica. Si notano nausea, costipazione, flatulenza. È possibile una condizione subfebbrile persistente. Con l'ostruzione prolungata dei dotti biliari, l'ittero può unirsi. La diagnosi di danno al sistema biliare è verificata dall'ecografia della cavità addominale, dall'esame radiografico (colecistografia), dalla colepancreatografia retrograda endoscopica (ERCP), nonché dai risultati del sondaggio duodenale, indicato solo per un processo senza calcoli. Nella pancreatite acuta e nell'esacerbazione del dolore cronico, il dolore è localizzato nella metà sinistra della regione epigastrica, ha un carattere di fuoco di Sant'Antonio ed è provocato dall'assunzione di qualsiasi cibo. Nell'anamnesi - patologia del sistema biliare, abuso di alcol, uso a lungo termine di farmaci pancreatici. Rivela oggettivamente perdita di peso, polifecale, steatorrea, creatorea. La diagnosi è confermata dai risultati di un esame del sangue biochimico per gli enzimi pancreatici, le feci - per la digeribilità e i dati strumentali. trattamento. La terapia razionale per l'ulcera peptica dovrebbe includere un regime, un'alimentazione adeguata, un trattamento farmacologico, una psicoterapia, metodi di trattamento fisico e termale. Durante il periodo di esacerbazione dell'ulcera peptica, è necessario osservare rigorosamente una dieta frazionata (da 4 a 6 volte al giorno con una piccola quantità di ciascuna porzione di cibo assunta a determinate ore). I prodotti alimentari devono avere buone proprietà tampone e contenere una quantità sufficiente di proteine (120-140 g). La psicoterapia è essenziale per fermare o ridurre le reazioni psiconevrotiche derivanti dalla sindrome del dolore persistente e dalla sua aspettativa. I medicinali usati per il trattamento dell'ulcera peptica sono divisi in 5 gruppi: 1) farmaci che agiscono sul fattore acido-peptico (antiacidi e H2-bloccanti dell'istamina, altri agenti antisecretori); 2) farmaci che migliorano la barriera mucosa gastrica; 3) farmaci che aumentano la sintesi delle prostaglandine endogene; 4) agenti antibatterici e antisettici; 5) farmaci che normalizzano i disturbi dell'evacuazione motoria dello stomaco e del duodeno. Antiacidi: 1) solubile (assorbibile) - bicarbonato di sodio, carbonato di calcio (gesso) e ossido di magnesio (magnesia bruciata); 2) insolubile (non assorbibile): trisilicato di magnesio e idrossido di alluminio. Gli antiacidi solubili hanno un effetto alcalinizzante rapido, energetico, ma a breve termine, ma spesso causano effetti collaterali, motivo per cui non vengono utilizzati nel trattamento dell'ulcera peptica. Gli antiacidi insolubili a base di idrossido di alluminio e idrossido di magnesio (Almagel, Phosphalugel, Gelusillac, Topaal, Maalox, ecc.) Forniscono una neutralizzazione a lungo termine dell'acido cloridrico, avvolgono la mucosa, proteggendola dagli effetti dannosi dell'acido e del cibo. Oltre a neutralizzare l'acido cloridrico, aiutano a ridurre l'attività proteolitica del succo gastrico, legano la lisolecitina e gli acidi biliari e hanno un effetto citoprotettivo universale. Gli antiacidi devono essere assunti 1-2 ore dopo i pasti e di notte. Maalox è prescritto in sospensione (15 ml 4 volte al giorno) o compresse (1-2 compresse 4 volte al giorno), phosphalugel - sotto forma di gel (16 g 3-4 volte al giorno). Uno dei principali effetti collaterali degli antiacidi non assorbibili è il disturbo delle feci. I preparati a base di idrossido di alluminio causano stitichezza e i preparati a base di idrossido di magnesio (Maalox) hanno un effetto lassativo dose-dipendente. Con l'avvento di H2- bloccanti dell'istamina. In condizioni fisiologiche, l'istamina media il nervo extragastrico e gli stimoli umorali che causano la produzione di acido. La stimolazione della produzione di acido cloridrico da parte dell'istamina è dovuta ad un aumento dell'attività del cAMP, che agisce sull'enzima adenilciclasi contenuto nella regione acida dello stomaco, che aumenta la secrezione di ioni idrogeno. I dati ottenuti sono stati la base per la sintesi di farmaci che interrompono la partecipazione dell'istamina al processo secretorio a livello cellulare, come cimetidina, ranitidina, famotidina, nizatidina, ecc. Inoltre, antagonisti H2I recettori dell'istamina prevengono i disturbi del microcircolo nella mucosa gastrica e quindi prevengono lo sviluppo di ulcere. Inoltre, riducono la produzione di pepsina, aumentano la secrezione di bicarbonati, normalizzano la motilità gastroduodenale, aumentano il numero di cellule epiteliali che sintetizzano il DNA, stimolano i processi riparativi e accelerano la guarigione delle ulcere croniche dello stomaco e del duodeno. Tuttavia, i farmaci di prima generazione (cimetidina, cinamet, belomet, tagamet) possono causare alterazioni del sistema nervoso, epatite tossica, disturbi del ritmo e della conduzione nel sistema cardiovascolare e alterazioni degli organi ematopoietici. bloccanti H2generazioni successive di recettori dell'istamina - ranitidina (zantac, ranisan, gistak), famotidina (kvamatel, lecedil, gastrosidina), nizatidina (roxatidina) differiscono dalla cimetidina per una buona tolleranza. La ranitidina è prescritta alla dose di 150 mg 2 volte al giorno, famotidina - 20 mg 2 volte al giorno per 4-6 settimane. Per prevenire la sindrome da astinenza dopo la guarigione dell'ulcera, si raccomanda di continuare l'assunzione di ranitidina (150 mg) o famotidina (20 mg) di notte per 2-3 mesi. Negli ultimi anni è apparso un nuovo farmaco antisecretorio omeprazolo (omenrol, omez, lossk), che appartiene ai derivati del benzimidazolo. Blocca l'enzima H + -K + -ATPasi della pompa protonica della cellula parietale. La breve emivita (circa 1 ora) e la lunga durata d'azione (18-24 ore) consentono di assumere questo farmaco una volta. L'omeprazolo viene prescritto 20 mg di notte 1 volta al giorno per 2-3 settimane. L'omeprazolo è al primo posto in termini di gravità dell'effetto antisecretorio tra i moderni farmaci antiulcera Gli effetti collaterali del farmaco non sono molto pronunciati. L'uso diffuso nel trattamento delle ulcere peptiche ha trovato la gastrocepina (nirenzepina, gastrozepina), che appartiene ai farmaci anticolinergici. Il farmaco blocca selettivamente i recettori muscarinici dell'acetilcolina situati nelle cellule della mucosa gastrica che producono acido cloridrico e pepsina. La gastrocepina ha un effetto inibitorio sulla secrezione gastrica basale e stimolata, inibisce la produzione di pepsina, rallenta l'evacuazione dallo stomaco, provoca l'inibizione della produzione di gastrina, riduce il livello di polipeptide pancreatico, ha un effetto citoprotettivo aumentando la produzione di glicoproteine del muco gastrico , nonché migliorando l' afflusso di sangue alla membrana mucosa della regione gastroduodenale . Assegnalo a 50 mg 2 volte al giorno 30 minuti prima dei pasti. Il corso del trattamento è in media di 4 settimane. I medicinali che rafforzano la barriera mucosa dello stomaco comprendono preparati a base di bismuto colloidale (denol), che forma un film protettivo sulla mucosa, riduce l'attività peptica dello stomaco, formando un composto insolubile con pepsina, migliora la formazione di muco, ha un effetto citoprotettivo effetto, aumentando il contenuto di prostaglandine nella parete dello stomaco. Denol ha la capacità di inibire l'attività dell'HP nella mucosa gastrica. Il farmaco viene prescritto 2 compresse (240 mg) 2 volte al giorno mezz'ora prima dei pasti o 2 ore dopo i pasti. Per evitare l'accumulo di sali di bismuto nel corpo, non è consigliabile effettuare la terapia con questi farmaci per più di 8 settimane. Ai fini della terapia antibatterica per le ulcere gastriche e duodenali vengono utilizzate tetraciclina, amoxicillina e claritromicina. Sono usati in combinazione con altri farmaci antiulcera. Sono stati proposti diversi schemi di terapia combinata (a due, tre, quattro componenti). Terapia a due componenti: amoxicillina 1000 mg 2 volte al giorno per 2 settimane; omeprazolo 40 mg due volte al giorno. Lo schema a tre componenti include la preparazione di bismuto colloidale 2 mg 120 volte al giorno; tetraciclina 4 mg 250 volte al giorno; metronidazolo 4 mg 250 volte al giorno. Il ciclo di terapia è di 4 giorni. Lo schema a quattro componenti prevede omeprazolo 20 mg 2 volte al giorno dal 1° al 10° giorno; de-nol 120 mg 4 volte al giorno dal 4° al 10° giorno; tetraciclina 500 mg 4 volte al giorno dal 4° al 10° giorno; metronidazolo 500 mg 3 volte al giorno dal 4° al 10° giorno. Lo schema a quattro componenti per il trattamento dell'ulcera peptica dello stomaco e del duodeno è riconosciuto come il più efficace. 6 settimane dopo, la guarigione del difetto peptico si osserva nel 93-96% dei pazienti. Dopo la cicatrizzazione di un'ulcera peptica dello stomaco e del duodeno, vengono tradizionalmente utilizzati due tipi di trattamento. 1) La terapia di mantenimento continua viene eseguita con farmaci antisecretori alla metà della dose giornaliera per un periodo fino a un anno. 2) La terapia "on demand", prevede l'uso di uno degli agenti antisecretori a metà della dose giornaliera per due settimane quando compaiono i sintomi dell'ulcera peptica. Previsione e prevenzione. Le forme non complicate della malattia hanno una prognosi favorevole per la vita e il lavoro. In caso di complicanze dell'ulcera peptica, la prognosi è determinata dalla tempestività delle cure chirurgiche. La prevenzione della recidiva dell'ulcera peptica include il monitoraggio dinamico con esami di follow-up obbligatori da parte di un medico 2 volte l'anno. Gli esami dovrebbero includere un esame clinico ed endoscopico e, se necessario, morfologico. Come misura preventiva, si raccomanda di normalizzare il sonno e il riposo, rinunciare alle cattive abitudini, limitare l'assunzione di farmaci ulcerogenici, razionalizzare cinque pasti al giorno e utilizzare una terapia a due o tre componenti per una settimana ogni 3 mesi. CONFERENZA N. 12. Malattie dell'apparato digerente. Malattie dell'intestino. Malattie dell'intestino tenue. Enterite cronica L'enterite cronica è una malattia dell'intestino tenue, caratterizzata da una violazione delle sue funzioni (digestione e assorbimento) sullo sfondo di cambiamenti distrofici e disrigenerativi, culminanti nello sviluppo di infiammazione, atrofia e sclerosi della mucosa dell'intestino tenue. Eziologia e patogenesi. Это полиэтиологическое заболевание, которое может быть исходом острого воспаления тонкой кишки или первичным хроническим процессом. Negli ultimi anni, Yersinia, Helicobacteria, Proteus, Pseudomonas aeruginosa, rotavirus, numerosi rappresentanti di protozoi ed elminti (giardia, ascaris, tenie, opistorchia, cryptosporidium) hanno avuto grande importanza come fattore eziologico nell'enterite cronica. Di grande importanza nell'insorgenza di enterite cronica sono i fattori alimentari: eccesso di cibo, cibo secco, cibi squilibrati, prevalentemente carboidrati, abuso di spezie. L'enterite è causata da radiazioni ionizzanti, esposizione a sostanze tossiche e farmaci. Tra i comuni meccanismi patogenetici delle malattie croniche dell'intestino tenue, ci sono cambiamenti nella microflora intestinale sullo sfondo di una diminuzione dell'immunità locale e generale. I cambiamenti nello stato immunitario - una diminuzione del contenuto di IgA secretorie, un aumento del livello di IgE, una diminuzione della trasformazione blastica dei linfociti e l'inibizione della migrazione dei leucociti - portano alla colonizzazione dell'intestino tenue da parte dei rappresentanti della microflora opportunistica e di un diminuzione della normale flora anaerobica. La colonizzazione batterica dell'intestino tenue migliora la secrezione intestinale grazie all'attivazione delle cellule epiteliali cAMP, che aumenta la permeabilità intestinale, migliora la produzione di elettroliti e acqua da parte delle cellule. La secrezione di acqua ed elettroliti porta a una violazione del metabolismo del sale marino. Sotto l'influenza della flora microbica, la circolazione enteroepatica della bile è disturbata. Gli acidi grassi legano gli ioni calcio, formando saponi poco solubili che vengono escreti nelle feci. La violazione del metabolismo del calcio è promossa da cambiamenti nel metabolismo della vitamina D, che riduce l'assorbimento del calcio. Sotto l'influenza dei disordini metabolici delle vitamine liposolubili, il contenuto di microelementi nel sangue diminuisce. La disbiosi prolungata promuove la sensibilizzazione agli antigeni microbici e alimentari, provoca l'infiammazione immunitaria della mucosa, che si traduce nella formazione di antigeni tissutali. L'aumentata permeabilità della barriera mucosa è accompagnata dal riassorbimento delle macromolecole proteiche non suddivise, che diventano allergeni e la reattività immunologica è compromessa. Con le allergie vengono rilasciate sostanze biologicamente attive che aumentano la permeabilità della parete intestinale, modificano le proprietà funzionali degli enterociti. Le violazioni della microstruttura della membrana citoplasmatica degli enterociti portano prima all'inibizione dell'attività della lattasi, quindi dell'attività della maltasi e della sucrasi. Con i cambiamenti distrofici e disrigenerativi negli epiteliociti, la sintesi degli enzimi e il loro assorbimento sulle membrane degli epiteliociti - disaccaridasi, peptidasi, enterokinasi, fosfatasi alcalina - sono ridotti, il che provoca disturbi sia nella digestione della membrana che della cavità. Tutto questo diventa la base della sindrome da malassorbimento. Nelle prime fasi della malattia, si sviluppano disturbi del metabolismo lipidico a causa di una diminuzione dell'assorbimento dei grassi, della sua perdita con le feci e dei cambiamenti nella fase intestinale della circolazione biliare enteroepatica. La violazione del metabolismo della bile, a sua volta, porta all'interruzione del metabolismo dei lipidi, che colpisce la struttura e la funzione delle membrane cellulari. In connessione con un assorbimento insufficiente di grasso, si verifica una violazione della sintesi di steroidi, che induce una violazione delle funzioni delle ghiandole endocrine. Morfologicamente, l'enterite cronica si manifesta con cambiamenti infiammatori e disrigenerativi nella mucosa dell'intestino tenue. Se il processo progredisce, si osservano atrofia e sclerosi. Classificazione (Zlatkina AR, Frolkis AV, 1985). 1) Eziologia: infezioni intestinali, invasioni elmintiche, fattori alimentari, fisici e chimici, malattie dello stomaco, pancreas, vie biliari. 2) Fasi della malattia: esacerbazione; remissione. 3) Grado di gravità: lieve; moderare; pesante. 4) Corrente: monotona; ricorrente; continuamente ricorrente; latente. 5) Carattere dei cambiamenti morfologici: eunità senza atrofia; jeunitis con moderata atrofia parziale dei villi; jeunitis con parziale atrofia dei villi; jeunitis con atrofia totale dei villi. 6) La natura dei disturbi funzionali: disturbi della digestione di membrana (carenza di disaccaridasi), malassorbimento di acqua, elettroliti, oligoelementi, vitamine, proteine, grassi, carboidrati. 7) Complicanze: solarite, mesadenite aspecifica. Quadro clinico. Клиническая картина хронического энтерита складывается из местного и общего энтерального синдромов. Первый обусловлен нарушением процессов пристеночного (мембранного) и полостного пищеварения (мальдигестия). Больные жалуются на метеоризм, боли в параумбиликальной зоне, вздутие живота в форме колпака, громкое урчание, поносы, реже - запоры. При пальпации выявляются болезненность в мезогастрии, а также слева и выше пупка (положительный симптом Поргеса), шум плеска в области слепой кишки (симптом Образцова). Кал приобретает глинистый вид, характерна полифекалия. La sindrome enterale generale è associata a un ridotto assorbimento degli ingredienti alimentari (malassorbimento), con conseguenti disturbi di tutti i tipi di metabolismo, cambiamenti nell'omeostasi. Caratterizzato da molteplici disordini metabolici, principalmente proteici, che si manifesta con una progressiva perdita di peso corporeo. I cambiamenti nel metabolismo dei carboidrati sono meno pronunciati, che si manifestano con gonfiore, brontolio nell'addome e aumento della diarrea durante l'assunzione di latticini. In larga misura, la carenza di peso corporeo nei pazienti è dovuta non solo alle proteine, ma anche allo squilibrio lipidico. I cambiamenti nel metabolismo dei lipidi sono strettamente correlati ai disordini metabolici delle vitamine e dei minerali liposolubili (calcio, magnesio, fosforo). I segni caratteristici della carenza di calcio sono un sintomo positivo del rollio muscolare, convulsioni, fratture ossee "immotivate" ricorrenti, osteoporosi, osteomalacia. Ci sono anche gonfiore del viso, cianosi delle labbra, glossite, irritabilità, scarso sonno. Le violazioni dell'equilibrio idrico ed elettrolitico si manifestano con debolezza generale, inattività fisica, ipotensione muscolare, nausea, vomito e alterazioni del sistema nervoso centrale. I sintomi della poliipovitaminosi diventano tipici per l'enterite cronica di gravità moderata e grave. L'ipovitaminosi C si manifesta clinicamente con sanguinamento delle gengive, ripetute emorragie nasali, uterine, lividi sulla pelle. L'ipovitaminosi B è accompagnata da pallore della pelle, glossite, stomatite angolare (cheilez). Segni di carenza di vitamine liposolubili (A, O, E, K): scarsa visione crepuscolare, pelle secca e mucose, aumento del sanguinamento delle gengive. Forme gravi di enterite cronica si verificano con sintomi di disfunzione endocrina (insufficienza plurighiandolare). L'ipocorticismo si manifesta con ipotensione arteriosa, aritmie cardiache, anoressia e pigmentazione cutanea. Una diminuzione dell'attività delle gonadi è accompagnata da disfunzione ovarica, disturbi mestruali, negli uomini - impotenza, ginecomastia, caduta dei capelli. La disfunzione tiroidea è caratterizzata da debolezza generale, pelle secca, bradicardia, riduzione delle prestazioni e disturbi intellettivi-mnestici. Диагностика и дифференциальный диагноз. В общем анализе крови выявляют микро- и макроцитарную анемию, увеличение СОЭ, в тяжелых случаях - лимфо- и эозинопению. При паразитарном происхождении заболевания в крови могут отмечаться лимфоцитоз, эозинофилия. L'esame scatologico rivela un tipo intestinale di steatorrea da acidi grassi e saponi, creatorea, amilorrea. Il contenuto di enterochinasi e fosfatasi alcalina nelle feci aumenta. La massa giornaliera di feci aumenta in modo significativo. L'analisi batteriologica delle feci rivela disbatteriosi di vario grado. C'è una diminuzione di latto- e bifidobatteri, compaiono enterococchi, ceppi di Escherichia coli con proprietà enzimatiche alterate. Nell'analisi generale delle urine nell'enterite cronica grave, si notano microalbuminuria e migroematuria. In un esame del sangue biochimico, vengono rilevati ipoproteinemia, ipoalbuminemia, ipoglobulinemia, ipocalcemia, diminuzione del livello di magnesio, fosforo e altri microelementi, disturbi del metabolismo degli elettroliti sotto forma di diminuzione del livello di sodio e potassio. I disturbi del metabolismo lipidico sono accompagnati da cambiamenti nello spettro lipidico: il livello di colesterolo, fosfolipidi diminuisce e cambia anche lo spettro degli acidi biliari, fosfolipidi e trigliceridi. I risultati dell'esame radiografico consentono di chiarire la funzione motoria dell'intestino tenue e il sollievo della mucosa, i cambiamenti distonici e discinetici sotto forma di rallentamento o accelerazione del passaggio di una sospensione di solfato di bario attraverso l'intestino tenue e il sollievo della mucosa cambia sotto forma di ispessimento irregolare, deformazione e levigatura delle pieghe. La gastroduodenoscopia rivela gastrite e duodenite atrofica. Il quadro morfologico di una forma lieve di enterite cronica è caratterizzato da ispessimento dei villi, loro deformazione, diminuzione della profondità dei recessi, diminuzione del tono della muscolatura liscia, edema subepiteliale, alterazioni degenerative della superficie dell'epitelio , assottigliamento del bordo a spazzola delle cellule, diminuzione del numero di cellule caliciformi nella regione dei villi, aumento del numero di cripte e infiltrazione del proprio strato mucosa con elementi linfoplasmocitici, diminuzione delle cellule di Paneth in l'area del fondo delle cripte. Per la forma moderata, sono tipiche atrofia parziale dei villi, diminuzione del numero delle cripte, assottigliamento della membrana mucosa, diminuzione del bordo della spazzola e infiltrazione linfoplasmocitica degli strati sottomucosi e muscolari. La forma grave della malattia è caratterizzata da una progressiva atrofia dei villi, diagnosticata secondo criteri istologici, istochimici e morfometrici. Il processo di proliferazione degli enterociti prevale sulla loro differenziazione, appare un'abbondanza di cellule immature e difettose. La diagnosi differenziale nell'enterite cronica si effettua con enteropatia celiaca, morbo di Crohn, morbo di Whipple, amiloidosi intestinale, malattia diverticolare, linfoma, tumori dell'intestino tenue. Comuni a tutte queste condizioni sono le sindromi cliniche di indigestione, assorbimento e dysbacteriosis. La diagnosi finale è confermata dall'esame morfologico della mucosa dell'intestino tenue. Quindi, per l'enteropatia celiaca, è tipica un'indicazione anamnestica della relazione tra le esacerbazioni della malattia con l'uso di prodotti contenenti gliadina. La clinica dell'enteropatia celiaca ricorda l'enterite cronica. Molto spesso, l'intestino superiore è interessato e non ci sono cambiamenti nell'ileo. Il sito ottimale per il prelievo di campioni bioptici è l'area della mucosa vicino al legamento di Treitz. L'esame morfologico rivela una diminuzione del numero di cellule caliciformi e un aumento del numero di linfociti interepiteliali, atrofia dei villi subtotali e infiltrazione di cellule infiammatorie nel proprio strato. Con l'enteropatia celiaca, i cambiamenti morfologici sullo sfondo di una dieta priva di glutine sono reversibili, in contrasto con l'enterite cronica banale, in cui i cambiamenti morfologici sono irreversibili. Nella malattia di Crohn si nota il polimorfismo clinico dovuto alla genesi autoimmune della malattia e alle sue manifestazioni sistemiche caratteristiche (come tiroidite autoimmune, poliartrite, irite, epatite, frequente combinazione di enterite e colite distale). I test endoscopici e morfologici hanno un'elevata risoluzione nella verifica del morbo di Crohn, rivelando la natura a mosaico della lesione intestinale, alterazioni tipiche del tipo "pavimentazione in ciottoli", che si alternano ad aree di mucosa intatta. L'esame endoscopico a raggi X può rilevare stenosi intestinali, a volte si formano fistole intestinali. La diagnostica morfologica indica l'infiltrazione di cellule infiammatorie di tutti gli strati della parete intestinale con massimo danno allo strato sottomucoso e minimi cambiamenti nella mucosa. Nello strato sottomucoso si trovano granulomi linfocitici simili a sarcoidi, patognomonici di questa malattia. Per la malattia di Whipple, oltre ai segni di enterite, sono caratteristiche manifestazioni extraintestinali sotto forma di febbre, artrite, linfoadenopatia, ipotensione arteriosa e pigmentazione della pelle. I criteri morfologici più informativi della malattia. Le biopsie prelevate dall'intestino tenue rivelano accumulo di grasso intracellulare ed extracellulare nella mucosa dell'intestino tenue e nei linfonodi mesenterici; infiltrazione del proprio strato da parte di grandi microfagi contenenti granuli privi di grasso CHIC-positivi e presenza di bacilli nella mucosa. trattamento. Лечение хронического энтерита должно быть комплексным, включающим в себя средства, воздействующие на этиологические факторы, патогенетические механизмы, а также на местные и общие симптомы заболевания. La base è l'alimentazione dietetica, che aiuta a ridurre l'aumento della pressione osmotica nella cavità intestinale, riduce la secrezione e normalizza il passaggio del contenuto intestinale. Escludere i prodotti contenenti fibre vegetali grossolane (verdure crude, frutta, pane di segale, noci, pasticceria, cibo in scatola, spezie, piatti speziati, latte intero, birra, kvas, bevande gassate e alcoliche). L'uso del sale da cucina è limitato. Sono necessari pasti frazionati, fino a 5-6 volte al giorno. Durante il periodo di remissione, alcune verdure e frutta vengono introdotte nella dieta, fino a 100-200 g al giorno. Assegnare lattuga, pomodori pelati maturi, pere morbide, mele dolci, arance, mandarini, lamponi, fragole, fragoline di bosco. Il cibo dovrebbe essere bollito o cotto a vapore. Лекарственная терапия должна быть этиотропной, патогенетической и симптоматической. Этиотропное лечение: при дисбиозе II-IV степени назначают препараты антибактериального действия: метронидазол (по 0,5 г 3 раза в сутки), клиндамицин (по 0,5 г 4 раза в сутки), цефалексин (по 0,5 г 2 раза в сутки), бисептол (по 0,48 г 2 раза в сутки), сульгин (по 1 г 3-4 раза в сутки), фуразолидон (0,1 г 4 раза в сутки). После применения антибактериальных препаратов назначают эубиотики - бифидумбактерин или бификол по 5 доз 3 раза в сутки за 30 мин до еды, коли-бактерин или лактобактерин по 3 дозы 3 раза в сутки до еды, хилакфорте по 40 капель 3 раза в день перед едой. Лечение бактерийными препаратами проводят длительно: 3 курса по 3 месяца в течение года. При стафилококковом дисбактериозе назначают антистафилококковый бактериофаг (по 20 мл 3 раза в день в течение 15-20 дней), при протейном дисбактериозе - колипротейный бактериофаг внутрь по 20 мл 3 раза в сутки, курс лечения - 2-3 недели. Come agente sintomatico antidiarroico, l'imodium (loperamide) viene prescritto 1 capsula 2-3 volte al giorno prima dei pasti per 3-5 giorni. Per migliorare il processo di digestione si raccomandano gli enzimi: pancreatina, panzinorm forte, festal, digestal, pankurmen, mezim forte, trienzyme, le cui dosi sono selezionate individualmente (da 1 compressa 3 volte al giorno a 3-4 compresse 4 volte al giorno ) e che vengono prescritti direttamente prima o durante i pasti per 2-3 mesi. Se necessario, la terapia enzimatica sostitutiva viene proseguita per un periodo più lungo. Per normalizzare le condizioni generali dei pazienti con enterite ed eliminare i disturbi metabolici, è indicata la terapia sostitutiva. Per compensare la carenza di vitamine, le vitamine B e B vengono prescritte per 4-5 settimane.6 50 mg ciascuno, PP - 10-30 mg, C - 500 mg ciascuno. Per la steatorrea è indicata la somministrazione parenterale di vitamina B.2 (100-200 mcg) in combinazione con vitamine liposolubili. All'interno sono prescritti riboflavina 0,02 g, acido folico 0,003 g una volta al giorno, vitamina E 3300 UI 2 volte al giorno. Nell'enterite cronica che si manifesta con grave carenza proteica, insieme a una dieta, somministrazione parenterale di plasma, 150-200 ml di idrolizzati proteici e miscele di aminoacidi (aminopeptide, alvesina, poliammina, intrafusina, 250-500 ml per via endovenosa per 20 giorni) in combinazione con ormoni anabolici (retabolil 2,0 ml 1 volta in 7-10 giorni per 3-4 settimane) e miscele grasse come intralipid. La nomina di steroidi è indicata solo con una significativa carenza proteica, ipoproteinemia, presenza di insufficienza surrenalica. Per correggere i disturbi idrici ed elettrolitici, la somministrazione endovenosa di panangin 20-30 ml, gluconato di calcio 10% 10-20 ml in 200-400 ml di soluzione isotonica o soluzione di glucosio, soluzioni poliioniche "Disol", "Trisol", "Quartasol" sono indicato. Le soluzioni elettrolitiche vengono somministrate per via endovenosa per 10-20 giorni sotto il controllo dello stato acido-base e del livello degli elettroliti nel sangue. Previsione e prevenzione. Прогноз для жизни и трудоспособности в большинстве случаев благоприятный. Прогностически неблагоприятными признаками являются непрерывно-рецидивирующее течение болезни, резкое значительное похудание, анемия, синдром эндокринных нарушений (снижение либидо, дисменорея, бесплодие). La prevenzione dell'enterite cronica consiste nel trattamento tempestivo delle infezioni intestinali acute e delle malattie concomitanti della zona gastroduodenale, nel rispetto della dieta, nella somministrazione profilattica di preparati batterici durante i raggi X e la radioterapia. CONFERENZA N. 13. Malattie dell'apparato digerente. Malattie dell'intestino. Morbo di Crohn Il morbo di Crohn è una malattia intestinale cronica con manifestazioni sistemiche; la cui base morfologica è l'infiammazione autoimmune granulomatosa del tratto gastrointestinale. Eziologia e patogenesi. Этиология и патогенез заболевания изучены недостаточно. Наиболее популярными считаются инфекционная и иммунная концепции возникновения болезни. В последние годы появились сообщения об этиологической роли микроорганизмов рода иерсиний. Однако трудно установить, являются ли эти микробные агенты возбудителями или комменсалами. В то же время в патогенезе заболевания важная роль принадлежит изменениям в кишечной микрофлоре. Tipicamente, una diminuzione dei batteri di tipo bifidum con un contemporaneo aumento degli enterobatteri con segni di patogenicità. I meccanismi autoimmuni svolgono un ruolo nello sviluppo della malattia. Nella malattia di Crohn, gli autoanticorpi (IgC, IgM) compaiono contro i tessuti intestinali. Il substrato morfologico della malattia è un processo infiammatorio autoimmune che si manifesta inizialmente nello strato sottomucoso, si estende a tutto lo spessore della parete intestinale ed è caratterizzato dalla presenza di infiltrati granulomatosi con successiva ulcerazione della mucosa, sviluppo di ascessi e fistole che guariscono con formazione di cicatrici e restringimento del lume intestinale. Con un aumento della durata della malattia, l'estensione della lesione aumenta e compaiono i sintomi dei disturbi extraintestinali. Classificazione. Классификация (Ф. И. Комаров, А. И. Казанов, 1992 г.). 1) Decorso: acuto; cronico. 2) Caratteristiche del processo: lesione all'interno dell'intestino tenue; lesione all'interno della regione ileocecale; lesione all'interno del colon. 3) Complicanze: restringimento dell'intestino; dilatazione tossica del colon; fistole; amiloidosi; nefrolitiasi, colelitiasi; A12-anemia da carenza. Quadro clinico. Клиническая картина болезни Крона характеризуется значительным разнообразием, которое определяется локализацией и протяженностью патологического процесса в кишечнике, формой заболевания и присоединением осложнений. L'esordio della malattia può essere acuto, quando la malattia progredisce dall'inizio, e cronico, quando la malattia inizia gradualmente. Nel primo caso, la diagnosi viene spesso fatta durante la laparotomia eseguita per sospetta appendicite, o ostruzione intestinale che si è sviluppata senza motivo apparente nei giovani. Allo stesso tempo, si trovano un'area iperemica dell'intestino tenue, linfonodi ingrossati della radice mesenterica, caratteristici del morbo di Crohn. I pazienti lamentano dolore addominale senza una localizzazione specifica, allentamento delle feci senza impurità patologiche visibili, perdita di peso, temperatura corporea di basso grado. Uno studio obiettivo presta attenzione al pallore della pelle, che è correlato alla gravità dell'anemia, al gonfiore delle gambe dovuto all'assorbimento ridotto e al metabolismo delle proteine. Alla palpazione dell'addome si notano flatulenza e brontolio. Quando il processo è localizzato nell'intestino crasso, si notano costipazione alternata a diarrea, crampi addominali, feci liquide o semiformate contenenti una miscela di sangue. Quando viene colpito il tratto gastrointestinale superiore, si verificano sintomi che ricordano l'esofagite cronica, la gastrite cronica e la duodenite cronica. Potrebbe esserci dolore dietro lo sterno durante il passaggio del cibo attraverso l'esofago, dolore notturno e "affamato" nell'epigastrio, dolore alla palpazione nella zona piloroduodenale. Durante l'esame obiettivo del paziente, vengono determinati il pallore della pelle, la condizione del subfebrile, la carenza di peso corporeo, la palpazione rivela le anse intestinali spasmodiche, il dolore nella zona paraombelicale, nella regione iliaca destra. Nella malattia di Crohn si notano segni extraintestinali della malattia: stomatite aftosa, flemmone e fistole del cavo orale, artrite, simile all'artrite reumatoide in clinica, con sintomi caratteristici di lesioni simmetriche delle piccole articolazioni, rigidità mattutina. Cambiamenti tipici negli occhi: irite, iridociclite, maculopatia. La pelle può sviluppare eritema nodoso e pioderma gangrenoso. La diarrea è caratterizzata da un aumento della frequenza delle feci fino a 10 volte al giorno o più, materia polifecale. Il volume delle feci è determinato dalla localizzazione anatomica del processo: con un danno all'intestino tenue prossimale, il volume delle feci è molto più grande che con un danno alle parti distali. La perdita di peso è nota in tutti i pazienti. Диагностика и дифференциальный диагноз. В клиническом анализе крови в период обострения выявляют лейкоцитоз, анемию, повышение СОЭ. Изменения в общем анализе мочи появляются при тяжелой форме, характеризующейся присоединением амилоидоза почек (протеинурия). Un esame del sangue biochimico rivela ipoproteinemia, ipoalbuminemia, aumento delle α-globuline, diminuzione del contenuto di ferro, vitamina B12, acido folico, zinco, magnesio e potassio. I dati dell'esame scatologico consentono di valutare indirettamente il livello della lesione. Nel coprogramma con localizzazione del processo nell'intestino tenue si trovano materia polifecale, steatorrea, creatorea; con colon - una miscela di muco, leucociti, eritrociti. La diagnostica a raggi X consente di stabilire la localizzazione e la prevalenza del processo patologico nell'intestino. Le aree dell'intestino interessato si alternano ad aree dell'intestino immodificato. Le anse alterate si irrigidiscono, il quadro è a mosaico con piccoli difetti di riempimento e con la penetrazione del contrasto oltre la parete intestinale sotto forma di tasche. L'intestino nella zona interessata acquisisce il carattere di finemente orlato, con la formazione di pseudodiverticoli. La capacità contrattile della parete intestinale si riduce o si perde completamente, l'evacuazione del bario rallenta. Si osserva un restringimento irregolare del lume intestinale, di conseguenza, diventa così stretto da assumere la forma di un pizzo. Sopra la zona di restringimento, l'intestino si espande. La diagnosi endoscopica è di importanza decisiva nella verifica della diagnosi. Per il morbo di Crohn, il più caratteristico è il cambiamento nell'antro dello stomaco e nella sezione iniziale del duodeno. Endoscopicamente, è possibile rilevare un restringimento circolare dell'antro, simile a una stenosi tumorale. Il periodo iniziale della malattia di Crohn è caratterizzato da scarsi dati endoscopici: una mucosa opaca, contro la quale sono visibili erosioni di tipo afte, circondata da granulazioni biancastre. Il pattern vascolare è assente o levigato. Nel lume dell'intestino e sulle sue pareti viene determinato il muco purulento. Nella remissione clinica, i cambiamenti descritti possono scomparire completamente. Con il progredire della malattia, la mucosa si ispessisce in modo non uniforme, assume un colore biancastro e si notano grandi fessure superficiali o profonde. Il lume intestinale si restringe, rendendo difficile l'avanzamento del colonscopio. La colonscopia consente di eseguire una biopsia mirata della mucosa in qualsiasi parte del colon e nell'ileo terminale. Nella malattia di Crohn, il processo patologico inizia nello strato sottomucoso, quindi la biopsia deve essere eseguita in modo tale che una parte dello strato sottomucoso entri nel materiale bioptico. In connessione con quanto sopra, nel 54% dei casi non viene rilevato il substrato morfologico della malattia. È necessario differenziare il morbo di Crohn da colite ulcerosa aspecifica, tubercolosi gastrointestinale, colite ischemica, morbo di Whipple, malattia diverticolare, colite pseudomembranosa, linfogranulomatosi, amiloidosi primitiva dell'intestino tenue, enterite cronica. Comuni a tutte queste malattie sono la sindrome della dispepsia intestinale e alcune lesioni sistemiche. Tuttavia, la colite ulcerosa è caratterizzata da un cambiamento nelle parti distali del colon con il coinvolgimento obbligatorio del retto e del sigma nel processo. Nella colite ulcerosa non specifica, non c'è segmentazione della lesione; meno spesso che nella malattia di Crohn, le manifestazioni sistemiche sono determinate e la sindrome da malassorbimento è meno pronunciata. Tuttavia, la diagnosi più accurata della malattia di Crohn è confermata dall'endoscopia con biopsia mirata. La forma gastrointestinale della tubercolosi si distingue dalla malattia di Crohn per la frequente localizzazione nell'ileo, reperti endoscopici che consentono l'individuazione di ulcere con bordi rialzati ed esfoliati pieni di contenuto grigiastro. Tali ulcere guariscono con la formazione di una breve cicatrice, che non si osserva nel morbo di Crohn. Negli anziani è necessario differenziare il morbo di Crohn e la colite ischemica. Per questi ultimi, sono tipici attacchi di intenso dolore addominale dopo aver mangiato, alterazioni della colite rilevabili irrigoscopicamente nella flessura splenica, nel colon discendente e sigmoideo. Il segno radiografico più importante della colite ischemica è il sintomo "impronta digitale". L'esame endoscopico e morfologico rivela tipici per la colite ischemica cellule contenenti emosiderina e fibrosi nel materiale bioptico. La diagnosi di linfogranulomatosi e amiloidosi intestinale primitiva viene fatta sulla base dell'esame istologico. Nel primo caso, le cellule di Berezovsky-Sternberg si trovano nella biopsia del linfonodo mesenterico, nel secondo caso ci sono depositi di amiloide nella mucosa rettale. trattamento. Назначают механически и химически щадящую диету с повышенным содержанием белков, витаминов, микроэлементов, с исключением молока при его непереносимости, ограничением грубой растительной клетчатки. Показано применение жидких энтеральных гидролизатов. Salazopreparati e corticosteroidi costituiscono la base della terapia farmacologica patogenetica. La dose giornaliera di farmaci è di 3-6 g Con la localizzazione del processo patologico nell'intestino crasso, l'attività della sulfasalazina supera l'attività del prednisolone. In assenza dell'effetto dell'uso della sulfasalazina, con lesioni prevalentemente dell'intestino tenue e segni pronunciati di infiammazione immunitaria, nonché in presenza di manifestazioni sistemiche della malattia, è indicato l'uso di corticosteroidi. L'effetto del loro uso si nota nelle prime 8 settimane dall'inizio del trattamento. Il prednisolone è prescritto secondo il seguente schema: al culmine di un'esacerbazione, 60 mg al giorno, quindi la dose viene gradualmente ridotta e entro la 6-10a settimana viene regolata a una dose di mantenimento di 5-10 mg al giorno. Al raggiungimento della remissione clinica, il farmaco viene gradualmente cancellato. Se la remissione non viene raggiunta, il trattamento con prednisolone viene continuato in regime ambulatoriale fino a 52 settimane. Nel decorso grave della malattia, in caso di complicanze sotto forma di fistole rettovaginali, cutanee-enteriche, enteroenteriche, la nomina di 6-mercaptopurina per via orale a 0,05 g 2-3 volte al giorno è indicata per corsi di 10 giorni con un intervallo di 3 giorni fino al raggiungimento della remissione clinica. Successivamente, passano all'assunzione di dosi di mantenimento del farmaco durante l'anno. La dose di 6-mercaptopurina in questo caso è di 75 mg al giorno. L'effetto del trattamento con immunosoppressori può essere determinato non prima di 3-4 mesi. L'uso diffuso nel trattamento della malattia di Crohn è stato riscontrato dal metronidazolo, le cui principali indicazioni sono fistole e ragadi perianali, la mancanza di effetto dei salazopreparati e dei glucocorticoidi, nonché le ricadute della malattia dopo la proctectomia. Il farmaco viene prescritto alla dose di 500-1000 mg al giorno. La durata del corso continuo non deve superare le 4 settimane. La terapia sintomatica della malattia di Crohn si riduce alla nomina di brevi cicli (2-3 giorni ciascuno) di farmaci antidiarroici (imodium, loperamide). Le dosi sono selezionate individualmente secondo l'effetto clinico. Non prescrivere antidiarroici per molto tempo (più di 5 giorni). In connessione con la presenza della sindrome da malassorbimento nella malattia di Crohn, i preparati enzimatici che non contengono acidi biliari (pancreatina, mesimforte, solizim, somilasi) vengono utilizzati in una dose da 2 a 6 compresse ad ogni pasto. Secondo le indicazioni, l'anemia e l'ipoalbuminemia vengono corrette prescrivendo preparazioni di ferro (per via parenterale) e somministrando Alvezin, idrolizzatori proteici, aminopeptide, aminosangue. Assegna multivitaminici in pillole, Essentiale in capsule. Il trattamento della dysbacteriosis viene effettuato secondo regole generali. Previsione e prevenzione. При болезни Крона прогноз для жизни при своевременной диагностике и эффективном динамическом наблюдении благоприятный, для трудовой деятельности - неопределенный. У пациентов с тяжелым течением заболевания, при наличии осложнений и системных проявлений, устанавливается I или II группа инвалидности. Болезнь Крона относится к предраковым заболеваниям. Пациента нужно подробно ознакомить с особенностями течения заболевания и предупредить о возможных осложнениях, описав в доступной форме их клинические проявления. CONFERENZA N. 14. Malattie dell'apparato digerente. Malattie del colon. Colite ulcerosa aspecifica La colite ulcerosa aspecifica è una malattia infiammatoria che colpisce la mucosa del colon con alterazioni ulcerative-distruttive, che ha un decorso cronico recidivante, spesso accompagnato dallo sviluppo di complicazioni potenzialmente letali. Eziologia e patogenesi. Неспецифический язвенный колит - идиопатическое заболевание. Причины его возникновения не известны. Tra le molte teorie che spiegano l'origine della malattia (infettiva, enzimatica, allergica, immunitaria, neurogena, ecc.), la teoria infettiva è di maggiore interesse, ma i tentativi di isolare l'agente patogeno dal contenuto del colon non hanno avuto successo. Il processo patologico nella colite ulcerosa cronica inizia nel retto e si diffonde nella direzione prossimale, catturando le parti sovrastanti del colon. L'infiammazione può essere limitata al retto (proctite), retto e sigmoideo (proctosigmoidite), diffondersi all'intera sezione sinistra (colite del lato sinistro) o interessare l'intero colon (colite totale). In termini funzionali, la lunghezza del colon nella colite aspecifica si riduce di circa 1/3. Nello studio del materiale patologico è stata rilevata un'infiammazione diffusa della mucosa del colon (pronunciato gonfiore e pletora, ispessimento delle pieghe). Ulcere di varie dimensioni si formano nella mucosa, di forma irregolare, il cui fondo si trova nella mucosa, meno spesso nello strato sottomucoso, nelle membrane muscolari e sierose. Morfologicamente, nel periodo iniziale, viene determinato un infiltrato nella lamina propria della mucosa, costituito da linfociti con una miscela di leucociti polimorfonucleati, dilatazione dei vasi sanguigni e gonfiore dell'endotelio di questi vasi. La violazione della microcircolazione è accompagnata dallo sviluppo dell'ipossia, che esacerba le violazioni della struttura e della funzione dell'epitelio della mucosa. Lo stadio delle manifestazioni cliniche pronunciate è accompagnato dall'infiltrazione dei leucociti nello strato superficiale dell'epitelio, dallo sviluppo della criptite, in cui si verificano accumuli di neutrofili nel lume delle cripte. Le parti distali delle cripte sono cancellate, compaiono ascessi della cripta, nella cui formazione un ruolo importante è svolto dalla ridotta maturazione degli epiteliociti. Con la necrosi dell'epitelio che riveste le cripte, si aprono ascessi della cripta, si formano ulcere. Durante il periodo di remissione, la mucosa viene ripristinata, ma rimangono la sua atrofia, la deformazione delle cripte e l'ispessimento irregolare della lamina propria. Classificazione (Yu.V. Baltaitis et al., 1986). Caratteristica clinica. 1. Forma clinica: 1) acuto; 2) cronico. 2. Corrente: 1) in rapido progresso; 2) continuamente recidivante; 3) ricorrente; 4) latente. 3. Grado di attività: 1) esacerbazione; 2) esacerbazione in dissolvenza; 3) remissione. 4. Gravità: 1) luce; 2) moderato; 3) pesante. Caratteristica anatomica. 1. Caratteristica macroscopica: 1) proctite: 2) proctosigmoidite; 3) lesione subtotale; 4) sconfitta totale. 2. Caratteristica microscopica: 1) la predominanza di processi distruttivi-infiammatori; 2) riduzione dei processi infiammatori con elementi di riparazione; 3) conseguenze del processo infiammatorio Complicazioni. 1. Locale: 1) sanguinamento intestinale; 2) perforazione del colon; 3) restringimento del colon; 4) pseudopoliposi; 5) infezione intestinale secondaria; 6) scomparsa della mucosa; 7) dilatazione tossica del colon; 8) malignità. 2. Generale: 1) ipocorticismo funzionale; 2) sepsi; 3) manifestazioni sistemiche - artrite, sacroileite, lesioni cutanee, irite, amiloidosi, flebite, colangite sclerosante, distrofia epatica. Quadro clinico. Клиника язвенного колита полиморфна и зависит от остроты течения и тяжести процесса. Течение воспалительного процесса, рассматриваемое чаще как хроническое, в ряде случаев принимает острый характер. Протяженность поражения толстой кишки также может меняться. Для неспецифического язвенного колита характерны 3 ведущих симптома: выделение алой крови при дефекации, нарушение функций кишечника и боль в животе. L'isolamento del sangue (da striature sulla superficie delle feci a 300 ml o più) durante la defecazione è il primo segno della malattia. Nella forma acuta della malattia, il sangue viene secreto da un getto, che porta ad una diminuzione della pressione sanguigna fino allo sviluppo del collasso e dello shock emorragico. La disfunzione intestinale si manifesta sotto forma di disturbi di feci instabili ripetute, che è il risultato di un ampio danno alla mucosa e di una diminuzione dell'assorbimento di acqua e sali. Molto spesso, la diarrea si verifica con una grave colite ulcerosa. Tuttavia, la diarrea non è un indicatore affidabile della gravità del processo. La gravità della diarrea in combinazione con la presenza di sangue rosso nelle feci è importante. In un numero significativo di pazienti con colite ulcerosa, sangue e muco si trovano periodicamente sulla superficie delle feci formate, che è spesso erroneamente considerata una manifestazione di emorroidi. I pazienti lamentano dolore nell'addome inferiore di natura crampiforme o costante, che è più spesso localizzato nell'ipogastrio o nella regione iliaca sinistra, aumenta prima dell'atto della defecazione e scompare dopo di esso. Si nota spesso tenesmo. Quando gli strati sottomucosi, muscolari e sierosi dell'intestino sono coinvolti nel processo, il dolore aumenta; alla palpazione dell'addome compare la difesa dei muscoli della parete addominale anteriore. Il decorso lieve della colite ulcerosa non specifica è caratterizzato da una condizione soddisfacente dei pazienti. Il dolore addominale è moderato e di breve durata. La sedia è decorata, accelerata, fino a 2-3 volte al giorno. Nelle feci si trovano sangue e muco. Il processo è localizzato all'interno del retto e del colon sigmoideo. Il decorso clinico è ricorrente. L'effetto del trattamento con salazopreparati è soddisfacente. Le ricadute si verificano non più di 2 volte l'anno. Le remissioni possono essere lunghe (più di 2-3 anni). Il decorso moderato della malattia viene diagnosticato se il paziente ha la diarrea. La sedia è frequente (fino a 6-8 volte al giorno), in ciascuna porzione è visibile una miscela di sangue e muco. I dolori crampi all'addome sono più intensi. Ci sono febbre intermittente con aumento della temperatura corporea fino a 38 ° C, intensa debolezza generale. Si possono anche notare manifestazioni extraintestinali della malattia (artrite, uveite, eritema nodoso). Il corso è continuamente ricorrente, l'effetto dei salazopreparati è instabile, gli ormoni vengono prescritti durante le esacerbazioni. La forma grave della malattia è caratterizzata da un esordio acuto. Una lesione totale dell'intestino crasso si sviluppa rapidamente con la diffusione del processo patologico in profondità nella parete intestinale. Le condizioni del paziente peggiorano drasticamente. La clinica è caratterizzata da un esordio improvviso, febbre alta, diarrea profusa fino a 24 volte al giorno, sanguinamento intestinale abbondante e un rapido aumento della disidratazione. Appare tachicardia, diminuzione della pressione sanguigna, aumento delle manifestazioni extraintestinali di colite ulcerosa aspecifica. Il trattamento conservativo non è sempre efficace e spesso è necessario un intervento chirurgico d'urgenza. Диагностика и дифференциальный диагноз. В клинических анализах крови при легкой форме заболевания отмечаются незначительный нейтрофильный лейкоцитоз, увеличение СОЭ, показатели красной крови не изменены. По мере нарастания тяжести течения и увеличения продолжительности обострения возникают анемии смешанного генеза (В12-carenza e carenza di ferro), aumento della VES. Nell'analisi biochimica del sangue nelle forme moderate e gravi si notano disproteinemia, ipoalbuminemia, ipergammaglobulinemia, squilibrio elettrolitico e stato acido-base. Nell'analisi generale delle urine, i cambiamenti compaiono solo quando si verificano complicazioni sotto forma di sindrome nefrosica sullo sfondo dell'amiloidosi, quando si notano cambiamenti caratteristici nei test delle urine - proteinuria, sedimento urinario "morto", c'è anche un aumento del sangue e il livello di creatinina, urea. Il ruolo principale nella diagnosi è acquisito dall'esame endoscopico con biopsia mirata, poiché nella colite ulcerosa aspecifica è colpita principalmente la mucosa del colon. Il retto è sempre coinvolto nel processo patologico, cioè durante l'endoscopia vengono rilevati cambiamenti erosivi e ulcerativi immediatamente dietro lo sfintere anale durante la sigmoidoscopia. Nella colite ulcerosa, non è sempre possibile superare la flessura rettosigmoidea a causa di un forte spasmo. Un tentativo di tenere il tubo del proctoscopio è accompagnato da un forte dolore. In questa situazione, il proctoscopio deve essere inserito a una profondità non superiore a 12-15 cm. La colonscopia durante una grave esacerbazione della colite ulcerosa aspecifica non è sicura da eseguire. Dovrebbe essere usato ad alto rischio di malignità. Va notato l'alto contenuto informativo della sigmoidoscopia. L'immagine endoscopica dipende dalla forma della malattia. Con una forma lieve, sono visibili una membrana mucosa opaca edematosa, spessi strati biancastri di muco sulle pareti dell'intestino e un leggero sanguinamento da contatto. Il pattern vascolare dello strato sottomucoso non è determinato visivamente. Con un decorso moderato della malattia, si rilevano iperemia ed edema della mucosa, gravi emorragie da contatto, emorragie, erosioni e ulcere di forma irregolare, spessi strati di muco sulle pareti dell'intestino. In un decorso grave della malattia, la membrana mucosa del colon viene distrutta in misura considerevole. Si trovano una superficie interna granulare sanguinante, estese aree di ulcerazione con depositi fibrinosi, pseudopolipi di varie dimensioni e forme, pus e sangue nel lume intestinale. Le controindicazioni per la colonscopia e la sigmoidoscopia sono forme gravi di colite ulcerosa nella fase acuta della malattia. L'esame a raggi X consente di determinare l'entità della lesione; chiarire la diagnosi in caso di dati endoscopici non sufficientemente convincenti; diagnosi differenziale con morbo di Crohn, malattia diverticolare, colite ischemica; rilevare tempestivamente i segni di malignità. Le radiografie semplici possono rivelare un accorciamento dell'intestino, mancanza di affaticamento, dilatazione tossica, gas libero sotto la cupola del diaframma durante la perforazione. L'irrigoscopia deve essere eseguita con grande attenzione. Può provocare un deterioramento delle condizioni del paziente. In alcuni casi, la preparazione del paziente al clistere di bario con clisteri e lassativi deve essere sostituita con una dieta speciale prescritta 2 giorni prima dello studio. In alcuni casi, l'uso di un clistere di contrasto può accelerare la perforazione o causare una dilatazione tossica del colon. Pertanto, l'irrigoscopia viene eseguita dopo il cedimento dei fenomeni acuti. Questo metodo rivela irregolarità e "granulosità" della mucosa, ispessimento della parete intestinale, ulcerazione, pseudopoliposi, mancanza di austrazione. La diagnosi differenziale della colite ulcerosa aspecifica viene effettuata principalmente con le infezioni intestinali acute. In presenza di un'epidemia di infezioni intestinali, la diagnosi è facilmente stabilita. Ma anche nel caso di morbilità sporadica nelle infezioni intestinali acute, la sindrome della colite scorre senza ricadute, mentre la colite ulcerosa ha un decorso recidivante. I metodi più accurati per identificare l'infezione intestinale acuta includono batteriologico e sierologico. Spesso, la colite ulcerosa è differenziata dal morbo di Crohn. In casi tipici, la malattia di Crohn differisce dalla colite aspecifica per l'assenza di danni al retto, frequente coinvolgimento dell'ileo nel processo patologico e lesioni segmentali della parete intestinale. La diagnosi definitiva può essere fatta rilevando i granulomi linfoidi specifici per il morbo di Crohn nei campioni bioptici. Con la colite granulomatosa, la paraproctite e le fistole pararettali vengono rilevate più spesso rispetto alla colite ulcerosa non specifica. In alcuni casi, diventa necessario distinguere tra colite ulcerosa e tubercolosi intestinale. Per la tubercolosi intestinale, è caratteristica una certa localizzazione del processo (ileo, regione ileocecale), danno intestinale segmentale. Ma a volte con la tubercolosi intestinale, il retto e l'intero intestino crasso sono colpiti. Il quadro colonscopico della tubercolosi intestinale è caratterizzato dalla presenza di ulcere con bordi rialzati pieni di contenuto grigiastro. Le ulcere tubercolari tendono a diffondersi in direzione trasversale e lasciano brevi cicatrici in cui le ulcere ricompaiono. Con la colite ulcerosa non specifica, le cicatrici non si formano nel sito delle ex ulcere. Nei pazienti anziani e senili, la colite ulcerosa aspecifica deve essere differenziata dalla colite ischemica. Quest'ultimo è caratterizzato da un intenso dolore parossistico all'addome 20-30 minuti dopo aver mangiato, mentre nella colite ulcerosa il dolore si manifesta prima dell'atto della defecazione. Il segno radiologico più importante è il sintomo "impronta digitale". Il quadro endoscopico della colite ischemica è caratterizzato da confini ben definiti della lesione, emorragie sottomucose, formazioni pseudopolipiche cianotiche che sporgono nel lume intestinale. L'esame istologico rivela cellule contenenti emosiderina e fibrosi. L'assenza di sanguinamento da contatto al momento della biopsia è anche più indicativa di colite ischemica. trattamento. Отсутствие единого этиологического фактора и сложность патогенеза неспецифического язвенного колита затрудняют лечение этого заболевания. Применяют препараты, оказывающие противовоспалительное и антибактериальное действие: салазопиридазин, сульфасалазин, салазодиметоксин, салофальк. Принятый внутрь сульфасалазин при участии кишечной микрофлоры распадается на 5-аминосалициловую кислоту и сульфапиридин. Неабсорбированный сульфапиридин подавляет в кишечнике рост анаэробной микрофлоры, в том числе клостридий и бактериодов. А благодаря 5-аминосалициловой кислоте препарат не только вызывает изменения в кишечной микрофлоре, но и модулирует иммунные реакции, блокирует медиаторы воспалительного процесса. Назначают препарат в дозе 2-6 г в сутки на весь период активного воспаления. При стихании колитического синдрома дозу сульфасалазина уменьшают постепенно, доводя до поддерживающей (в среднем по 1-1,5 таблетки в день). La nomina di derivati dell'acido 5-aminosalicilico (salofalk, mesacol, salosan, tidikol) è il metodo di base e può essere utilizzato come monoterapia per forme lievi e moderate di colite ulcerosa. Il trattamento viene effettuato sullo sfondo della terapia dietetica ad eccezione dei latticini, in presenza di un contenuto equilibrato di proteine, grassi, carboidrati e vitamine nella dieta. Si consiglia di escludere frutta fresca, verdura, cibo in scatola. Il cibo dovrebbe essere meccanicamente e chimicamente delicato. Dai da mangiare frazionario 4-5 volte al giorno. Lo squilibrio vitaminico interrompe il processo di assorbimento dei microelementi ed è compensato dalla nomina di preparati complessi in compresse ("Duovit", "Oligovit", "Unicap"). Nella sindrome diarroica grave in individui con malattia da lieve a moderata, è indicata la nomina di sandostatina, che inibisce la sintesi di ormoni gastrointestinali e ammine biogene (peptide intestinale vasoattivo, gastrina, serotonina), la cui produzione è fortemente aumentata nella colite ulcerosa e Morbo di Crohn. E anche il farmaco riduce la secrezione e migliora l'assorbimento nell'intestino, inibisce il flusso sanguigno viscerale e riduce la motilità. Quando si utilizza la sandostatina (entro 7 giorni alla dose di 0,1 mg 2 volte, per via sottocutanea), la diarrea diminuisce, il tenesmo praticamente scompare e l'escrezione di sangue con le feci diminuisce. In una forma grave di colite ulcerosa aspecifica, il trattamento viene effettuato sullo sfondo della nutrizione parenterale. Il contenuto proteico in queste preparazioni dovrebbe essere di circa 1,5-2,0 g/kg di peso corporeo. I corticosteroidi, che vengono somministrati per via parenterale, sono un trattamento patogenetico per una forma grave della malattia: durante il primo giorno, il prednisone viene somministrato per via endovenosa a intervalli di 12 ore (90-120 mg o più), nei successivi 5 giorni - per via intramuscolare, riducendo gradualmente la dose. Con un effetto positivo, passano ai farmaci per via orale (prednisolone 40 mg al giorno). La somministrazione a lungo termine di ormoni durante un periodo di remissione stabile non è consigliabile. Nei pazienti con un decorso grave della malattia, è stato notato un effetto positivo dell'ossigenazione iperbarica (HBO). L'uso di un ciclo di HBO (7-10 procedure) durante il periodo di remissione può ridurre la frequenza delle ricadute. Indicazioni per il trattamento chirurgico d'urgenza: perforazione intestinale, dilatazione tossica, sanguinamento intestinale abbondante, neoplasie. Nella forma moderata del decorso dell'ulcera ulcerosa non specifica, è necessaria una dieta rigorosa con una restrizione di fibre, latticini e un alto contenuto proteico. Il prednisolone viene somministrato per via orale ad una dose iniziale di 20-40 mg al giorno. Il trattamento può essere integrato con sulfasalazina e suoi analoghi, che vengono assunti per via orale o somministrati in microclisteri e supposte nel retto. La dose iniziale di sulfasalazina è di 1 g al giorno, quindi viene aumentata a 4-6 g. Come metodo ausiliario di trattamento, possono essere utilizzati decotti di erbe con effetti antinfiammatori ed emostatici (radice di bruciacchia, foglia di ortica, lichene, pigne di ontano grigio, radice di liquirizia), la fitoterapia spesso consente di ridurre la dose di salazopreparati, prolungare remissione. Previsione e prevenzione. При тяжелом течении и наличии системных и местных осложнений прогноз серьезный. Больные абсолютно нетрудоспособны. При легкой и среднетяжелой формах болезни прогноз для жизни благоприятен. Пациенты нуждаются в переводе на легкий труд. Durante la remissione, si raccomanda un trattamento di mantenimento con salazopreparati, agenti batterici, psicoterapia e terapia dietetica. I pazienti che soffrono di colite ulcerosa da molto tempo (più di 5-7 anni) devono essere assegnati al gruppo a rischio per l'insorgenza di cancro all'intestino e archiviati nei registri del dispensario. Questi pazienti vengono mostrati una volta all'anno la colonscopia con biopsia mirata. CONFERENZA N. 15. Malattie dei reni. Glomerulonefrite acuta La glomerulonefrite acuta (AGN) è una malattia renale diffusa acuta di natura infettiva-allergica, localizzata nei glomeruli. L'AGN può essere una malattia indipendente (primaria) o essere secondaria come parte di un'altra malattia, complicando il quadro clinico e la diagnosi di quest'ultima. L'AGN di solito colpisce uomini giovani e di mezza età. eziologia. L'AGN si verifica più spesso dopo un'infezione coccica (influenza, tonsillite acuta, faringite causata dai cosiddetti ceppi di microrganismi nefritogeni). Nel 60-80% dei pazienti viene rilevato streptococco β-emolitico di gruppo A; in 1/3 dei casi non è possibile stabilire l'eziologia dell'AGN. L'ipotermia prolungata, soprattutto in condizioni di elevata umidità, contribuisce allo sviluppo dell'AGN. Anche la vaccinazione è un fattore di insorgenza della malattia e nel 75% dei casi i reni vengono colpiti dopo la seconda o la terza iniezione. patogenesi. La patogenesi della malattia ha un meccanismo immunitario: quando gli antigeni (streptococco, medicinali, proteine estranee) entrano nel corpo, in risposta si formano anticorpi, che legano questi antigeni e, insieme alla 3a frazione del complemento, formano complessi immunitari circolanti nel sistema vascolare letto. I complessi sono in grado di depositarsi sulla faccia esterna della membrana basale dei capillari glomerulari, provocandone il danneggiamento attraverso il rilascio di prodotti di degradazione del complemento, che aumentano la permeabilità dei capillari e provocano alterazioni locali in questi ultimi. I neutrofili si precipitano nei siti di deposizione degli immunocomplessi, i cui enzimi lisosomiali aggravano il danno all'endotelio e alla membrana basale, separandoli l'uno dall'altro. La degranulazione piastrinica provoca il rilascio di serotonina, portando all'emocoagulazione e alla deposizione di fibrina sulla membrana basale. L'eliminazione degli immunocomplessi dal corpo è facilitata da una reazione dei macrofagi sotto forma di proliferazione delle cellule mesangiali ed endoteliali, con l'efficacia di questo processo, si verifica il recupero. Quadro clinico. Il quadro clinico della malattia è costituito dalle seguenti sindromi. sindrome urinaria. 1. Proteinuria dovuta al passaggio di molecole proteiche attraverso gli spazi della parete capillare del glomerulo, formati durante la deposizione di immunocomplessi su di essi. La proteinuria è di natura selettiva, in cui prevalentemente le albumine passano attraverso il "filtro" glomerulare. 2. Ematuria dovuta al coinvolgimento nel processo patologico del mesangio capillare e del tessuto interstiziale. Gli eritrociti penetrano attraverso le più piccole rotture della membrana basale, cambiando la loro forma. 3. Cilindruria - escrezione urinaria di cellule cilindriche dei tubuli. Durante i processi distrofici nei tubuli delle cellule disintegrate dell'epitelio renale, si formano cilindri granulari, costituiti da una massa granulare densa; i cilindri cerosi hanno contorni netti e una struttura omogenea; i calchi ialini sono formazioni proteiche. La sindrome ipertensiva si osserva a causa di: 1) ritenzione di sodio e acqua; 2) attivazione dei sistemi renina-angiotensina-aldosterone e simpatico surrenale; 3) diminuzione della funzione del sistema depressore dei reni. La sindrome dell'edema è associata ai seguenti fattori: 1) una diminuzione della filtrazione glomerulare dovuta alla loro sconfitta; 2) una diminuzione della carica di filtrazione del sodio e un aumento del suo riassorbimento; 3) ritenzione idrica dovuta alla ritenzione di sodio nel corpo; 4) un aumento delle BCC; 5) iperaldosteronismo secondario; 6) un aumento della secrezione di ADH e un aumento della sensibilità del nefrone distale ad esso, con conseguente ritenzione di liquidi; 7) un aumento della permeabilità delle pareti capillari e il rilascio di plasma nei tessuti; 8) una diminuzione della pressione oncotica plasmatica con proteinuria massiva. I reclami presentati in AGN non sono specifici e si verificano in varie malattie. È molto importante indicare nell'anamnesi un recente mal di gola, esacerbazione di tonsillite cronica, ipotermia, ecc. Alcuni pazienti notano una diminuzione della produzione di urina, combinata con un po 'di gonfiore (pastoso) del viso al mattino. In 1/3-3/4 pazienti nei primi giorni della malattia, non ci sono dolori molto forti e doloranti nella regione lombare associati ad un aumento delle dimensioni dei reni. Ci sono anche aumento della fatica, mal di testa, mancanza di respiro durante lo sforzo fisico, un aumento a breve termine della temperatura corporea fino al subfebbrile. L'ipertensione arteriosa, rilevata solo nella metà dei pazienti, è caratterizzata da un aumento dei numeri a 140-160 / 85-90 mm Hg. Arte. (raramente - fino a 180/100 mm Hg. Art.). diagnostica. Nel 100% dei casi, l'esame delle urine rivela proteinuria di varia gravità, cilindruria e, cosa più importante per la diagnosi, ematuria di varia gravità - dalla microematuria (fino a 10 globuli rossi nel campo visivo) alla macroematuria (anche se piuttosto rara ). Tuttavia, se si sospetta l'AGN, è necessario eseguire una serie di test delle urine ripetuti o eseguire il test Nechiporenko (per determinare il numero di elementi formati in 1 μl), poiché i globuli rossi potrebbero non essere rilevati in una singola porzione di urina. Quando si esamina il sangue, vengono rilevati indicatori di fase acuta (aumento del contenuto di fibrinogeno e α2-globulina, proteina C-reattiva, accelerazione ESR), il numero di leucociti cambia poco, anemia moderata. Con un decorso semplice di AGN, il contenuto di sostanze azotate (creatinina, indican, urea) nel sangue non cambia. Nella fase iniziale della malattia si osserva un cambiamento nel test di Reberg: una diminuzione della filtrazione glomerulare e un aumento del riassorbimento tubulare, che si normalizza man mano che si riprende. Un esame radiografico in pazienti con grave ipertensione arteriosa può mostrare un moderato aumento del ventricolo sinistro, che assume le stesse dimensioni del paziente che si riprende. Esistono 3 varianti cliniche di AGN. 1) Variante monosintomatica: disturbi minori, assenza di edema e ipertensione arteriosa, c'è solo sindrome urinaria; la variante più comune del decorso della malattia (86% dei casi). 2) Variante nefrosica: edema, oliguria sono pronunciati, è possibile aumentare la pressione sanguigna a numeri relativamente bassi, viene rilevato nell'8% dei pazienti. 3) Versione estesa: ipertensione arteriosa, raggiungendo numeri elevati (180/100 mm Hg), edema moderatamente pronunciato, insufficienza circolatoria, si verifica nel 6% dei casi. Diagnosi differenziale. L'AGN deve essere distinto dalla glomerulonefrite cronica, cosa non difficile con l'esordio acuto dell'AGN e la successiva completa regressione dei sintomi. Tuttavia, in assenza di un esordio acuto, nonché in caso di persistenza a lungo termine di alcuni segni della malattia, la diagnosi diventa notevolmente più complicata. Se la differenziazione è difficile, si ricorre ad una biopsia puntura del rene. È difficile differenziare l'AGN dalla pielonefrite a causa della presenza di leucocituria in entrambe le malattie. Tuttavia, l'AGN è accompagnato da una proteinuria più massiccia e, in alcuni casi, da edema. La diagnosi differenziale è anche aiutata dai sintomi clinici della pielonefrite sotto forma di dolore più pronunciato nella parte bassa della schiena, accompagnato da febbre e disturbi disurici. Anche di valore diagnostico è la determinazione della batteriuria nella pielonefrite, l'identificazione di leucociti "attivi", nonché studi radiografici (deformazione delle coppe) e isotopo-renografici (asimmetria della funzione renale). L'AGN come malattia indipendente deve essere differenziata dalle malattie croniche diffuse del tessuto connettivo, in cui l'AGN è una delle manifestazioni della malattia. Questa situazione di solito si verifica con la gravità delle sindromi urinarie, ipertensive ed edematose e l'insufficiente chiarezza di altri sintomi della malattia, più spesso con LES (lupus eritematoso sistemico). La diagnosi corretta nel LES può essere fatta tenendo conto della sindrome articolare, del danno alla pelle e di altri organi (cuore), cambiamenti immunologici pronunciati (rilevamento di anticorpi anti-organo ad alto titolo, cellule del lupus eritematoso, anticorpi contro DNA e RNA ), nonché il monitoraggio della dinamica del quadro clinico. trattamento. Il trattamento per l'AGN è complesso e comprende le seguenti misure. 1. Modalità. Se si sospetta AGN o immediatamente dopo che è stata stabilita la diagnosi, il paziente deve essere immediatamente ricoverato in ospedale. Il rigoroso riposo a letto deve essere osservato per circa 2-4 settimane fino all'eliminazione dell'edema e alla normalizzazione della pressione sanguigna. Stare a letto fornisce un riscaldamento uniforme del corpo, che porta ad una diminuzione del vasospasmo (quindi, ad una diminuzione della pressione sanguigna) e ad un aumento della filtrazione glomerulare e della diuresi. Dopo la dimissione dall'ospedale, il trattamento domiciliare è indicato per un massimo di 4 mesi dalla data di insorgenza della malattia, che è la migliore prevenzione del passaggio dell'AGN allo stadio cronico. 2. Dieta. A seconda della gravità dei sintomi clinici, è molto importante limitare i liquidi e il cloruro di sodio. Con una forma espansa e nefrosica, si consiglia un digiuno completo per 1-2 giorni con assunzione di liquidi in quantità pari alla diuresi. Il 2-3° giorno viene mostrato il consumo di alimenti ricchi di sali di potassio (porridge di riso, patate). La quantità totale di acqua bevuta al giorno dovrebbe essere uguale al volume di urina escreto nel giorno precedente più 300-500 ml. Dopo 3-4 giorni, il paziente viene trasferito a una dieta con restrizione proteica (fino a 60 g al giorno) e la quantità totale di sale non supera i 3-5 g / giorno. Tale dieta è raccomandata fino alla scomparsa di tutti i sintomi extrarenali e un netto miglioramento del sedimento urinario. 3. La terapia farmacologica comprende principalmente la terapia antibiotica, che, tuttavia, dovrebbe essere eseguita solo se la natura infettiva dell'AGN è accertata in modo affidabile (l'agente patogeno è stato isolato e non sono trascorse più di 3 settimane dall'inizio della malattia). Solitamente prescritto penicillina o suoi analoghi semisintetici in dosaggi convenzionali. Anche la presenza di focolai evidenti di infezione cronica (tonsillite, sinusite, ecc.) è un'indicazione diretta per la terapia antibiotica. I diuretici nel trattamento dell'AGN sono indicati solo con ritenzione di liquidi, aumento della pressione sanguigna e comparsa di insufficienza cardiaca. La furosemide più efficace (40-80 mg), utilizzata fino all'eliminazione di edemi e ipertensione. Non è necessaria una prescrizione a lungo termine di questi farmaci, sono sufficienti 3-4 dosi. In assenza di edema, ma ipertensione persistente o con insufficiente effetto antipertensivo dei saluretici, vengono prescritti farmaci antipertensivi (clophelin, dopegyt) con una durata di somministrazione che dipende dalla persistenza dell'ipertensione arteriosa. Nella forma nefrosica di AGN viene prescritta una terapia immunosoppressiva (corticosteroidi - prednisolone 60-120 mg al giorno, seguita da una graduale riduzione della dose, durata dell'uso per 4-8 settimane). In caso di AGN con edema grave e una significativa diminuzione della diuresi, l'eparina viene somministrata a 20-000 UI al giorno per 30-000 settimane, ottenendo un aumento del tempo di coagulazione del sangue di 4-6 volte. Con proteinuria prolungata, l'indometacina o il voltaren vengono prescritti a 75-150 mg al giorno (in assenza di ipertensione e oliguria). La prognosi è favorevole, tuttavia, con forme prolungate, c'è la possibilità che il processo diventi cronico. La prevenzione dell'AGN si riduce al trattamento efficace dell'infezione focale, all'indurimento razionale. Al fine di rilevare tempestivamente l'insorgenza della malattia dopo la vaccinazione, trasferita la SARS in tutti i pazienti, è necessario esaminare le urine. CONFERENZA N. 16. Malattie dei reni. Pielonefrite La pielonefrite è una malattia infettiva in cui sono coinvolti nel processo la pelvi renale, i suoi calici e la sostanza dei reni, con una lesione predominante del tessuto interstiziale. A questo proposito, la pielonefrite è una nefrite interstiziale (interstiziale). Questo è un concetto più ampio della pielonefrite. Denota, in primo luogo, un tipo di infiammazione dei reni di qualsiasi eziologia con coinvolgimento predominante dell'interstizio e, in secondo luogo, una malattia speciale in cui questa infiammazione è la sua unica e principale espressione. Vicino alla nefrite interstiziale c'è la cosiddetta nefrite tubulo-interstiziale, in cui c'è una lesione amichevole dei tubuli e dello stroma dei reni. Classificazione. Sulla base dei dati clinici e morfologici, si distingue la pielonefrite acuta e cronica, che di solito ha un decorso ricorrente sotto forma di attacchi di pielonefrite acuta. Inoltre, la pielonefrite può essere unilaterale e bilaterale. Secondo la forma del corso (per pielonefrite cronica): forma ricorrente, pielonefrite cronica latente, rene rugoso pielonefritico. Eziologia e patogenesi. La pielonefrite è una malattia infettiva. I suoi agenti causali sono agenti infettivi di natura non specifica: E. coli, enterococco, stafilococco e altri batteri, ma nella maggior parte dei casi si tratta di E. coli (40%) e flora mista (38%). Si richiama l'attenzione sulle forme L di batteri, protoplasti (i corpi dei batteri, privi di membrane che possono supportare l'infezione), candida, che possono causare pielonefrite cronica. Le fonti di infezione possono essere tonsille, malattie degli organi genitali e dell'intestino crasso, ad es. agenti infettivi possono penetrare nel rene, compreso il bacino, con il flusso sanguigno (pielonefrite discendente ematogena), che si osserva in molte malattie infettive (febbre tifoide, influenza , angina, sepsi). Più spesso, i microbi vengono introdotti nei reni per via ascendente dagli ureteri, dalla vescica, dall'uretra (pielonefrite ascendente urogenica), che è facilitata dalla discinesia degli ureteri e del bacino, dall'aumento della pressione intrapelvica (reflusso vescicorenale e pielorenale), nonché da riassorbimento del contenuto del bacino nelle vene del midollo renale ( reflusso pielovenoso). La pielonefrite ascendente, di regola, complica quelle malattie del sistema genito-urinario, in cui il deflusso delle urine è difficile (calcoli e stenosi degli ureteri, stenosi dell'uretra, tumori del sistema genito-urinario), quindi si sviluppa spesso durante la gravidanza. È anche possibile un'infezione linfogena nei reni (pielonefrite linfogena), quando il colon e gli organi genitali sono la fonte dell'infezione. Per lo sviluppo della pielonefrite, oltre alla penetrazione dell'infezione nei reni, la reattività del corpo e una serie di cause locali che causano una violazione del deflusso delle urine e della stasi urinaria sono di grande importanza. Le stesse ragioni spiegano la possibilità di un decorso cronico ricorrente della malattia. Microrganismi infetti con alterazioni funzionali e morfologiche del tratto urinario che portano alla stasi urinaria, alterato deflusso venoso e linfatico dal rene, contribuendo alla fissazione dell'infezione nei reni, causano zone focali e polimorfiche di infiltrati infiammatori e suppurazione dell'interstizio di uno o entrambi i reni. Viene colpito il tessuto interstiziale dei tubuli e quindi i nefroni. Ci sono endarteriti produttive, iperplasia del guscio medio dei vasi, fenomeni di ialinosi, arteriolosclerosi si sviluppano fino al rene secondariamente rugoso. Negli ultimi anni, un certo ruolo nello sviluppo della pielonefrite cronica è assegnato alle reazioni autoimmuni: sotto l'influenza di antigeni batterici, l'immunoglobulina G e il complemento si depositano sulla membrana basale dei capillari glomerulari, causandone il danno. Il passaggio da pielonefrite acuta a cronica è facilitato da: diagnosi tardiva di pielonefrite acuta, ricovero prematuro, presenza di infezioni croniche, diabete, gotta, abuso di analgesici - fenacetina. La pielonefrite cronica è più comune nelle donne (50%), che è facilitata dalle gravidanze, soprattutto ripetute (gli estrogeni causano l'atonia della muscolatura liscia delle vie urinarie), nell'infanzia nelle ragazze, che è associata alla struttura delle vie urinarie , le loro anomalie. Quadro clinico. Come accennato in precedenza, è possibile il decorso sia acuto che cronico della pielonefrite. Il quadro clinico della fase acuta della malattia è caratterizzato da un improvviso e brusco aumento della temperatura corporea fino a 39-40 ° C, possono verificarsi l'insorgenza di debolezza, mal di testa, brividi, combinati con sudorazione profusa, nausea e vomito. Insieme all'aumento della temperatura corporea, compaiono dolori nella regione lombare, che, di regola, si notano su un lato. La natura del dolore è sordo, la loro intensità è diversa. Nel caso dello sviluppo della malattia sullo sfondo dell'urolitiasi, un attacco di pielonefrite è preceduto da un attacco di colica renale. In assenza di un'adeguata terapia, la malattia può diventare cronica, oppure questo porta allo sviluppo di processi suppurativi nel rene, che si manifestano clinicamente con un deterioramento delle condizioni generali del paziente e improvvisi sbalzi di temperatura (da 35-36 ° C al mattino a 40-41 ° C la sera). La pielonefrite cronica è, di regola, una conseguenza della pielonefrite acuta non trattata, quando è stato possibile rimuovere l'infiammazione acuta, ma non è stato possibile distruggere radicalmente tutti i patogeni nel rene o ripristinare il deflusso fisiologico di urina dal rene. La pielonefrite cronica è preoccupata per i continui dolori dolorosi nella regione lombare, aggravati dal freddo umido. Inoltre, la pielonefrite cronica è soggetta a periodiche esacerbazioni, quando il paziente ha tutti i segni di un processo acuto. diagnostica. Il problema della diagnosi della malattia è dovuto al fatto che i sintomi della pielonefrite sono simili ai sintomi di altre malattie derivanti dall'infiammazione delle vie urinarie. Il piano di esame diagnostico comprende esami del sangue, esami delle urine e studi che mostrano lo stato del sistema urinario: ecografia dei reni, studi a raggi X, analisi PCR per un agente infettivo. Per verificare il tipo di agente infettivo, è necessario condurre una coltura batteriologica di un campione di urina e il metodo della tomografia computerizzata viene utilizzato per escludere i processi tumorali. Pertanto, i metodi di ricerca di laboratorio e speciali sono di grande importanza per il riconoscimento della malattia. E nella pielonefrite cronica, le manifestazioni decisive e talvolta le uniche sono i cambiamenti nelle urine, nel sangue e nel tratto urinario. È necessario monitorare dinamicamente la pressione sanguigna e il peso del paziente. Nel sangue si notano leucocitosi, aumento della VES, spostamento neutrofilo, aumento del livello di azoto residuo (a una norma di 20-40 mg), urea (norma di 40-60 mg), creatinina (norma di 53-106 μmol / l), indican (norma di 1,41, 3,76-180 µmol/l), colesterolo (norma 200-83 mg), cloruri nel sangue (norma XNUMX mmol/l). Importante per la diagnosi dei cambiamenti nelle urine: diminuzione del peso specifico, proteinuria (anche giornaliera), ematuria e cilindruria. Tuttavia, i metodi per la determinazione quantitativa degli elementi formati del sedimento urinario stanno acquisendo sempre più importanza diagnostica: Kakovsky-Addis (leucociti normali fino a 4 milioni di globuli rossi - fino a 1 milione, cilindri - fino a 2mila in 24 ore), Amburger (leucociti normali fino a 2000, eritrociti - fino a 1400, cilindri - fino a 20 per 1 minuto), Nechiporenko (normalmente leucociti fino a 2500, eritrociti - fino a 1000, cilindri - fino a 20 in 1 ml di urina appena rilasciata) . Il rapporto tra il numero assoluto di eritrociti e leucociti nel sedimento urinario nella pielonefrite cambia drasticamente verso una significativa predominanza di leucociti di 10-20 volte. Nella pielonefrite cronica, nelle urine compaiono cellule di Stenheimer-Malbin: grandi leucociti, con movimento browniano dei granuli citoplasmatici, che compaiono con una diminuzione delle proprietà osmotiche dell'urina (peso specifico inferiore a 10-14), colorati di blu con violetta di genziana e safronina, Leucociti "attivi": leucociti alterati, che possiedono il moto browniano del protoplasma, rivelati quando colorati con una soluzione acquosa all'1% di blu di metilene con l'aggiunta di acqua distillata. Il valore diagnostico di un aumento del numero di leucociti "attivi" e cellule di Stenheimer-Malbin (fino al 40%), batteriuria (conta microbica superiore a 100 mila per 1 ml di urina), test dei nitriti (con una conta microbica superiore oltre 100 mila U, i microbi decompongono i nitriti nelle urine). , con l'aggiunta di acido sulfanilico e L-naftilamina, appare un colore rosso), un test TTX colorimetrico (sotto l'azione delle deidrogenasi microbiche, il trifeniltetrazolita cloruro viene ridotto a rosso insolubile trifenilformazan entro 4-10 ore ad una temperatura di -37°C), un test provocatorio del prednisolone (il paziente raccoglie in un piatto sterile, la porzione centrale di urina è quella di controllo, quindi si ottengono 30 mg di prednisolone in 10 ml di soluzione fisiologica iniettato lentamente nella vena e la porzione media di urina viene raccolta tre volte ad intervalli orari e dopo 24 ore; nella pielonefrite cronica, il numero di leucociti, batteri raddoppia, compaiono leucociti "attivi", almeno in una porzione), antibiogrammi. Particolare attenzione dovrebbe essere prestata alla microscopia della tubercolosi dei reni (microscopia di strisci colorati secondo Tsil, semina di urina su supporti speciali - il metodo di Preis e Shkolnikova, il metodo biologico). Se si sospetta un processo unilaterale, è necessario condurre un test delle urine, prelevato separatamente da ciascun rene con cateteri speciali. Un ruolo importante nella diagnosi della pielonefrite cronica è svolto dai metodi di ricerca radiologica: radiografia e tomografia d'indagine (caratterizzare la posizione, le dimensioni e la forma dei reni), la pielografia escretoria e retrograda (diminuzione della concentrazione e della capacità escretoria dei reni, spasmi , anomalie, deformità del bacino, calici), pneumopielografia (per il riconoscimento di calcoli senza contrasto), angiografia renale (rivela una violazione dell'architettura vascolare - arterie e vene). Per determinare la sicurezza della funzione e il parenchima dei reni, in particolare con un processo unilaterale, vengono utilizzati metodi di radioindicazione: renografia (iodio hippurano 131) e scanografia (usando neoidruro Hg 203). La biopsia della puntura in caso di pielonefrite dovuta ai fuochi del processo potrebbe non fornire informazioni. La cromocistoscopia può indicare un danno renale. trattamento. Molto spesso, la terapia per la pielonefrite è conservativa, tuttavia, se la pielonefrite acuta è purulenta, può essere necessario un intervento chirurgico. Il trattamento conservativo consiste in un regime, una dieta, l'uso di antibiotici e vari farmaci che stabilizzano la funzione dei reni e del corpo del paziente nel suo insieme. Nella pielonefrite acuta è indicato un rigoroso riposo a letto. Il cibo dovrebbe essere consumato cibi contenenti la quantità ottimale di proteine, grassi e carboidrati. Nel periodo acuto è necessario alternare alimenti proteici e vegetali. Con una grave intossicazione, devi bere molta acqua. Il trattamento della pielonefrite cronica consiste nell'impatto sull'infezione (etiotropica) nella pielonefrite primaria e nell'eliminazione dell'una o nell'altra causa nella pielonefrite secondaria, nei meccanismi patogenetici e nel trattamento delle complicanze. Il trattamento più efficace è dopo aver determinato l'antibiogramma. Viene effettuato un trattamento continuo (almeno 2 mesi) con farmaci antibatterici. Immediatamente dopo il ricovero, viene prescritto un farmaco antibiotico, sulfanilamide o nitrofurano. Dopo 1-10 giorni, i farmaci vengono cambiati, il trattamento viene effettuato fino alla scomparsa persistente della leucocituria e della batteriuria. Non appena l'esacerbazione viene eliminata, il trattamento intermittente con uno degli agenti antibatterici viene effettuato per 4-5 mesi: il farmaco viene somministrato per 7 giorni, quindi viene presa una pausa per 8-10 giorni o il farmaco viene somministrato per 10 giorni con un intervallo di 15-20 giorni, oppure il farmaco viene somministrato per 15 giorni, l'intervallo viene effettuato per 15 giorni, quindi viene nuovamente prescritta la terapia antimicrobica. La durata del trattamento e gli intervalli sono determinati dai sintomi clinici e dal controllo di laboratorio. Si precisa che in caso di pielonefrite che si è sviluppata in un paziente con tonsillite cronica, i più efficaci sono gli antibiotici della serie delle penicilline; in caso di infezione dei genitali negli uomini e nelle donne, vengono utilizzati antibiotici ad ampio spettro (vedi Tabella 12). In presenza di flora gram-negativa, il trattamento con acido nalidixico dà buoni risultati (neri, ievigramon - 1,0 g 4 volte al giorno per 7 giorni, ma i suoi preparati dovrebbero essere prescritti meno frequentemente rispetto ad altri farmaci (2 volte)). Dai preparati sulfanilammidici vengono utilizzati etazolo (1,0 g 4 volte - 10 giorni), solafur (0,1 g 3 volte), sulfamidici a lunga durata d'azione. Inoltre, i corsi vengono trattati con furazolidone, furadonin, furagin (0,1 g 4 volte al giorno). Va sottolineato che la funzione renale deve essere determinata prima di iniziare il trattamento. La terapia antibiotica a lungo termine deve essere effettuata con una velocità di filtrazione glomerulare di almeno 30 ml/min o con un contenuto residuo di azoto nel siero del sangue non superiore a 70 mg. Un indicatore dell'efficacia del farmaco dopo una settimana di trattamento è una diminuzione della conta microbica a 10 in 000 ml di urina. È possibile ridurre la virulenza della microflora e aumentare l'efficacia degli agenti antibatterici modificando la reazione dell'urina ogni 10-14 giorni. Alimenti alcalinizzanti, citrato di sodio (10 g al giorno), acque minerali alcaline aiutano a ridurre le reazioni del pH. Una certa azione antibatterica ha il benzoato di sodio (4-6 g al giorno), che è abbondante nei mirtilli e nelle uva ursina. La terapia patogenetica dovrebbe mirare ad aumentare la reattività del corpo, migliorare il deflusso di urina e normalizzare la pressione sanguigna. Per attivare la reattività immunobiologica vengono utilizzate α-globulina, autoemoterapia, trasfusione di sangue, terapia vaccinale (il trattamento con autovaccino viene effettuato per 30-40 giorni, 0,1 ml per via sottocutanea o 0,2-0,3 ml ogni 2 giorni), tossoide stafilococcico ( 0,1-0,3- 0,5-0,7-1,0-1,2-1,7-2,0 ml ogni 3 giorni). Le erbe diuretiche (uva ursina, bacche di ginepro, equiseto di campo, foglia di orthosiphon - tè al rene, foglia di mirtillo rosso), antispastici (papaverina, no-shpa, ecc.) Aiutano a normalizzare il deflusso delle urine. Se c'è un'ostruzione al flusso di urina, è indicato un trattamento chirurgico. Con l'ipertensione concomitante, sono indicati i preparati di rauwolfia: isobarine, dopegyt, hemiton, saluretics, antagonisti dell'aldosterone. Prevenzione e prognosi. La prevenzione della pielonefrite consiste in misure primarie e secondarie. La prevenzione primaria comprende, prima di tutto, il trattamento delle malattie che possono portare allo sviluppo della pielonefrite: infezioni focali, malattie urologiche (come urolitiasi, adenoma prostatico, nonché eventuali malattie accompagnate da una violazione del deflusso di urina dal rene), attività ricreative. Tabella 12 Efficacia comparata dei farmaci antibatterici nella pielonefrite
La prevenzione secondaria include il rilevamento della batteriuria durante gli esami preventivi (ad esempio, le donne in gravidanza devono condurre un'analisi batteriologica delle urine almeno una volta al mese), la nomina di un trattamento anti-recidiva: la prima settimana di ogni mese - una pausa nel trattamento: decotto di rosa canina, la seconda, terza settimana - diuretici e antisettici a base di erbe, la quarta settimana - agenti antibatterici (nitrofurani, antibiotici, antisettici, una volta all'anno - nevigramon 1 g 1 volte durante la settimana e 1,0 g - durante la seconda settimana o 4 -NOC 2-5 mg 100 volte al giorno 150-4 giorni). Il trattamento anti-recidiva viene effettuato per 2-3 anni. Gli esami dispensari con trattamento devono essere eseguiti 3-4 volte l'anno o 4-6 volte. Previsione. La prognosi dipende dallo stadio della malattia. Trattamento di sanatorio. Il trattamento in sanatorio è indicato durante il periodo di remissione, soprattutto per i pazienti con pielonefrite calcolitica secondaria dopo interventi urologici (acque minerali Truskavets, Sairme, Zheleznovodsk, Berezovsky), dove i pazienti assumono acque poco mineralizzate. Il trattamento in sanatorio e termale è controindicato in caso di ipertensione elevata, anemia grave e insufficienza renale evidente. Le complicazioni della pielonefrite sono varie. Nella pielonefrite acuta, la progressione del processo purulento porta alla fusione di grandi ascessi e alla formazione di un carbonchio del rene, alla comunicazione di cavità purulente con il bacino (pionefrosi), al passaggio del processo a una capsula fibrosa (perinefrite ) e tessuto perinefrico (paranefrite). La pielonefrite acuta può essere complicata dalla necrosi delle papille delle piramidi (papillonekrosi), che si sviluppa a causa dell'effetto tossico diretto dei batteri in condizioni di stasi urinaria. Questa complicanza della pielonefrite si verifica nella maggior parte dei casi nei pazienti con diabete. Raramente, la pielonefrite diventa una fonte di sepsi. Con la limitazione del processo purulento durante il periodo cicatriziale, possono formarsi ascessi circondati da una membrana piogenica (ascesso renale cronico). Nella pielonefrite cronica, soprattutto unilaterale, è possibile sviluppare ipertensione nefrogenica e arteriolosclerosi nel secondo rene (intatto). Il raggrinzimento pielonefritico bilaterale dei reni porta a insufficienza renale cronica. L'esito della pielonefrite acuta è solitamente il recupero, ma a causa di complicazioni (pionefrosi, sepsi, papilonecrosi) può verificarsi la morte. La pielonefrite cronica con raggrinzimento dei reni spesso termina con azotemia uremia. Con lo sviluppo dell'ipertensione arteriosa di origine renale, l'esito letale nella pielonefrite cronica è talvolta associato alle complicanze che si verificano nell'ipertensione (emorragia cerebrale, infarto del miocardio, ecc.). Autore: Mostovaya OS
▪ Diritto costituzionale di paesi esteri. Culla ▪ Psicologia legata all'età. Culla
Pelle artificiale per l'emulazione del tocco
15.04.2024 Lettiera per gatti Petgugu Global
15.04.2024 L'attrattiva degli uomini premurosi
14.04.2024
▪ Il sapone antibatterico è pericoloso per la natura ▪ Abilitare e disabilitare la gola
▪ sezione del sito Trasferimento dati. Selezione di articoli ▪ articolo Vissero a lungo e morirono lo stesso giorno. Espressione popolare ▪ articolo Distributore di carburante. Istruzioni standard sulla protezione del lavoro
Homepage | Biblioteca | Articoli | Mappa del sito | Recensioni del sito www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese








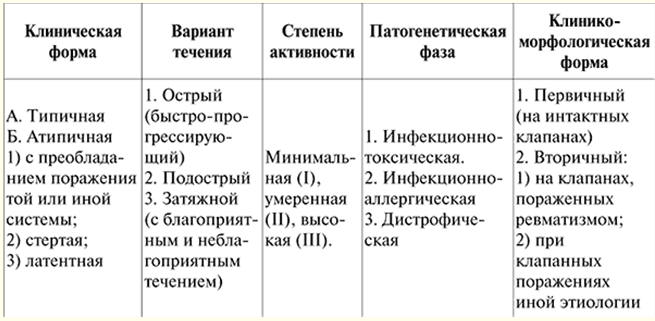








 Vedi altri articoli sezione
Vedi altri articoli sezione 