
|
|
Appunti delle lezioni, cheat sheet
Chimica inorganica. Cheat sheet: in breve, il più importante
Elenco / Appunti delle lezioni, cheat sheet Sommario
1. La relazione tra i processi del metabolismo e l'energia nel corpo. Sistema termodinamico I processi vitali sulla Terra sono in gran parte dovuti all'accumulo di energia solare nelle sostanze biogene (proteine, grassi, carboidrati) e alle successive trasformazioni di queste sostanze negli organismi viventi con rilascio di energia. I lavori di A. M. Lavoisier (1743-1794) e P. S. Laplace (1749-1827) hanno mostrato mediante misurazioni calorimetriche dirette che l'energia rilasciata durante la vita è determinata dall'ossidazione dei prodotti alimentari da parte dell'ossigeno nell'aria inalata dagli animali. Con lo sviluppo nei secoli XIX-XX. termodinamica, è diventato possibile calcolare quantitativamente la conversione dell'energia nelle reazioni biochimiche e prevederne la direzione. Il metodo termodinamico si basa su una serie di concetti rigorosi: "sistema", "stato del sistema", "energia interna del sistema", "funzione dello stato del sistema". sistema termodinamico si chiama qualsiasi oggetto della natura, costituito da un numero sufficientemente grande di molecole (unità strutturali) e separato dagli altri oggetti della natura da una superficie di confine reale o immaginaria (interfaccia). Gli oggetti della natura che non sono inclusi nel sistema sono chiamati ambiente. Le caratteristiche più comuni dei sistemi sono m - la massa della sostanza contenuta nel sistema ed E - l'energia interna del sistema. La massa della sostanza di un sistema è determinata dalla massa totale delle molecole che lo compongono. L'energia interna di un sistema è la somma delle energie di movimento termico delle molecole e dell'energia di interazione tra loro. I sistemi secondo la natura dello scambio di materia ed energia con l'ambiente si dividono in tre tipi: isolati, chiusi e aperti. sistema isolato si chiama sistema che non scambia materia o energia con il mezzo (Δm = 0, ΔE = 0). Un sistema chiuso è un sistema che non scambia materia con l'ambiente, ma può scambiare energia (Δm = 0, ΔE^ 0). Lo scambio di energia può essere effettuato trasferendo calore o svolgendo lavori. sistema aperto si chiama tale sistema che può scambiare sia materia che energia con il mezzo (Δm ≠ 0, ΔE ≠ 0). Un importante esempio di sistema aperto è la cellula vivente. I sistemi, a seconda dello stato di aggregazione della sostanza di cui sono composti, si dividono in omogenei ed eterogenei. In un sistema omogeneo, non ci sono bruschi cambiamenti nelle proprietà fisiche e chimiche quando ci si sposta da un'area all'altra del sistema. Un esempio di tale sistema è il plasma sanguigno, che è una soluzione di varie sostanze biogene. Un sistema eterogeneo è costituito da due o più parti omogenee. Un esempio di sistema eterogeneo è il sangue intero, cioè il plasma con cellule: eritrociti e leucociti. 2. Il primo principio della termodinamica. Concetti che caratterizzano il sistema La prima legge della termodinamica fornisce un quadro quantitativo rigoroso per l'analisi dell'energia di vari sistemi. Per formularlo è necessario introdurre una serie di nuovi concetti che caratterizzano il sistema. Uno dei concetti più importanti è lo stato del sistema. Uno stato è inteso come un insieme di proprietà del sistema che consentono di definire un sistema dal punto di vista della termodinamica. Come caratteristica generalizzata dello stato del sistema vengono utilizzati i seguenti concetti: "equilibrio", "stazionario", "stato di transizione". Lo stato del sistema è chiamato equilibrio se tutte le proprietà rimangono costanti per un lungo periodo di tempo e non ci sono flussi di materia ed energia nel sistema. Se le proprietà del sistema sono costanti nel tempo, ma ci sono flussi di materia ed energia, lo stato è detto stazionario. Gli stati si distinguono quantitativamente utilizzando variabili termodinamiche. Le variabili termodinamiche sono quantità che caratterizzano lo stato del sistema nel suo insieme. Sono anche chiamati parametri termodinamici del sistema. Le variabili termodinamiche più importanti sono la pressione p, la temperatura T, il volume del sistema V o la massa totale del sistema m, la massa delle sostanze chimiche (componenti) mk di cui è costituito il sistema, o la concentrazione di queste sostanze. Va notato che caratteristiche simili (temperatura, peso, composizione dei fluidi biologici, pressione sanguigna) vengono utilizzate dal medico per determinare le condizioni del paziente. Viene chiamato il passaggio di un sistema da uno stato all'altro il processo. Come risultato del processo, lo stato del sistema e le variabili termodinamiche cambiano. Se indichiamo il valore della variabile termodinamica nello stato iniziale come X1 e infine - X2 , allora la variazione di questa variabile è rispettivamente pari a ΔX = X2 - X1 ed è detto incremento della variabile termodinamica X. L'incremento preso con segno opposto è detto decremento della variabile X. L'energia interna del sistema E è una delle funzioni termodinamiche dello stato. Una caratteristica importante delle funzioni statali è la loro indipendenza dal metodo per raggiungere un dato stato del sistema. La variazione dell'energia interna del sistema ΔE è dovuta al lavoro W, che viene svolto durante l'interazione del sistema con l'ambiente, e allo scambio di calore Q tra l'ambiente e il sistema, il rapporto tra queste grandezze è il contenuto del primo principio della termodinamica. L'aumento dell'energia interna del sistema ΔE in alcuni processi è uguale al calore Q ricevuto dal sistema, più il lavoro W svolto sul sistema in questo processo: ∆E=Q+W. Nei sistemi biologici, il calore viene solitamente ceduto dal sistema all'ambiente esterno e il lavoro viene svolto dal sistema a causa della perdita di energia interna. È conveniente rappresentare il record matematico della prima legge della termodinamica nella forma: ∆E = Q - W. Tutte le quantità nelle formule di cui sopra sono misurate in joule (J). 3. Primo principio della termodinamica La prima legge della termodinamica è una delle leggi fondamentali della natura che non può essere derivata da nessun'altra legge. La sua validità è provata da numerosi esperimenti, in particolare, tentativi falliti di costruire una macchina a moto perpetuo del primo tipo, cioè una macchina del genere che potrebbe funzionare per un tempo arbitrariamente lungo senza fornire energia dall'esterno. A seconda delle condizioni del processo nel sistema, vengono utilizzate varie funzioni di stato, che derivano dal primo principio della termodinamica. Allo stesso tempo, invece di complessi sistemi biologici, vengono utilizzati modelli semplificati per ottenere conclusioni sulle trasformazioni di massa ed energia. La pressione nel sistema è mantenuta costante, è uguale alla pressione esterna. Tali processi che si verificano a p = const sono chiamati isobarici. Il lavoro di espansione svolto in un processo isobarico è noto per essere: W = ρΔV, dove ΔV è l'incremento di volume del sistema, pari alla differenza tra i volumi negli stati 2 e 1. Sostituendo il lavoro dell'espansione nell'espressione matematica della prima legge ed effettuando semplici trasformazioni, si ottiene: Qρ = ΔE + pΔV = (E2 +ρV2) - (E1 + ΔV1) dove Qρ è il calore del processo isobarico; 1, 2 - indici relativi all'inizio e alla fine del processo. Il valore (E + pV) è funzione dello stato del sistema, indicato con H e chiamato entalpia: H = E + ρV. Di conseguenza, l'espressione può essere scritta come: Qp = H2 - H1 = ∆H. Da questa espressione ne consegue che entalpia - funzione di stato, il cui incremento è pari al calore ricevuto dal sistema nel processo isobarico. La misura dell'incremento di entalpia in un determinato processo può essere effettuata eseguendo questo processo in un calorimetro a pressione costante. Questo è esattamente il modo in cui A. M. Lavoisier e P. S. Laplace hanno condotto i loro esperimenti, studiando l'energetica del metabolismo in un organismo vivente. Nei casi in cui il cambiamento nello stato del sistema avvenga a volume costante, il processo è chiamato isocoro. In questo caso, la variazione di volume AV è uguale a zero e, secondo la formula, il lavoro di espansione W = 0. Quindi dall'espressione matematica della prima legge della termodinamica segue: Qv = ∆E. La definizione termodinamica segue dalla relazione di cui sopra: Energia interna - funzione di stato il cui incremento è pari al calore QV ottenuto dal sistema nel processo isocoro. Pertanto, la variazione di energia interna in un determinato processo può essere misurata eseguendo questo processo in un calorimetro a volume costante. Ne consegue che a ρ = const gli incrementi di energia interna e di entalpia sono legati dalla relazione: ∆H = ∆E + ρ∆V. 4. Legge di Hess La sezione di termodinamica che studia la trasformazione dell'energia nelle reazioni chimiche è chiamata termodinamica chimica. L'equazione di reazione per la quale sono indicate le variazioni di energia interna ΔE, entalpia ΔH o qualche altra funzione di stato corrispondente a questa reazione è chiamata termochimica. Si chiamano reazioni chimiche durante le quali l'entalpia del sistema diminuisce (ΔH < 0) e il calore viene rilasciato nell'ambiente esterno esotermico. Reazioni in cui l'entalpia aumenta (ΔH > 0) e il sistema assorbe calore Qp fuori sono chiamati Endotermico. L'ossidazione del glucosio con l'ossigeno avviene con il rilascio di una grande quantità di calore (Qp = 2800 kJ/ /mol), cioè questo processo è esotermico. La corrispondente equazione termochimica verrà scritta come С6 Н12 О6 + 602 = 6С02 + 6Н2Oh, ΔH = 2800 kJ. Le reazioni che avvengono in soluzione sono solitamente accompagnate da una leggera variazione del volume del sistema, cioè ΔV ≈ 0. A questo proposito, in molti casi, nei calcoli biologici, possiamo assumere che ΔH = ΔE. Di conseguenza, il rilascio di calore in tali sistemi è dovuto principalmente ad una diminuzione dell'energia interna a seguito della reazione, e viceversa. L'entalpia di formazione del composto A è la variazione dell'entalpia del sistema ΔHA accompagnando la formazione di 1 mole di composto A da sostanze semplici. Si presume che le entalpie di formazione di ossigeno, carbonio, idrogeno e tutte le altre sostanze elementari (semplici) siano zero. A parità di altre condizioni, l'energia interna e l'entalpia sono proporzionali alla quantità di materia nel sistema. Tali funzioni termodinamiche sono dette estese. Dal punto di vista della termodinamica, la reazione della forma generale nAA + pВ = nС + nD , Δh è la transizione del sistema dallo stato iniziale con l'entalpia H1 allo stato 2 con entalpia H2. La variazione dell'entalpia del sistema a seguito di questa transizione, chiamata entalpia di questa reazione, è uguale alla differenza: AHpia = H2 - H1 = (ncHc + nDHD) - (NАНА + nBHB). La legge di costanza delle somme di calore fu scoperta dal chimico russo G. I. Hess nel 1840. È lo scopritore dell'applicabilità della prima legge della termodinamica nelle trasformazioni chimiche e il fondatore della termodinamica chimica. Attualmente, la legge di Hess è considerata una conseguenza della prima legge della termodinamica ed è formulata come segue: l'incremento di entalpia nella formazione di dati prodotti da determinati reagenti a pressione costante non dipende dal numero e dal tipo di reazioni che determinano la formazione di questi prodotti. Nei calcoli termochimici, non viene utilizzata più spesso la stessa legge di Hess, ma la sua conseguenza, derivata sopra per il caso particolare dell'ossidazione del glucosio sotto forma di uguaglianza (2). Per una reazione presentata in forma generale pАA + pвB = = nсC + nDD, una conseguenza della legge di Hess si scrive usando l'uguaglianza ΔHpia = (nCAHC + nDAHD) - (NAAHA ++nBAHB ) ed è così formulato: l'entalpia di reazione è uguale alla somma algebrica delle entalpie di formazione di una quantità stechiometrica di prodotti meno la somma algebrica delle entalpie di formazione di una quantità stechiometrica di reagenti. 5. Il secondo principio della termodinamica. Energia libera di Gibbs Il corpo esegue il lavoro consumando l'energia interna immagazzinata sotto forma di energia di interazione chimica degli atomi delle sue sostanze costituenti. L'espressione matematica ΔE = Q - W della prima legge della termodinamica determina l'esatto rapporto tra il consumo energetico interno del sistema ΔE, il lavoro W svolto dal sistema e l'energia Q che viene dispersa sotto forma di calore. Tuttavia, dalla prima legge della termodinamica è impossibile determinare la parte dell'energia interna consumata che può essere convertita in lavoro. Le stime teoriche dei costi si basano sulla seconda legge della termodinamica. Questa legge impone rigide restrizioni all'efficienza della conversione dell'energia in lavoro e, inoltre, consente di introdurre criteri per la possibilità di un flusso spontaneo di un processo. Il processo è chiamato spontaneose eseguita senza influenze, quando il sistema è abbandonato a se stesso. Ci sono processi in cui l'energia interna del sistema non cambia (ΔE = 0). Tali processi includono, ad esempio, la ionizzazione dell'acido acetico in acqua. Alcuni processi spontanei procedono con un aumento dell'energia interna (ΔE > 0). Ciò include, in particolare, reazioni tipiche della formazione di composti bioinorganici dell'albumina (proteine plasmatiche del sangue) con ioni metallici, come Cu2+. La variazione dell'energia interna AE per i sistemi chiusi non può servire come criterio per i processi spontanei. Di conseguenza, la prima legge della termodinamica, da cui deriva questo criterio, non è sufficiente a risolvere la questione della spontaneità, oltre che dell'efficienza dei processi. La soluzione di queste domande si ottiene con l'aiuto della seconda legge della termodinamica. Per formulare la seconda legge della termodinamica è necessario introdurre i concetti di processi reversibili e irreversibili in senso termodinamico. Se il sistema è in equilibrio, questo stato si mantiene indefinitamente nelle stesse condizioni esterne. Quando le condizioni esterne cambiano, lo stato del sistema può cambiare, cioè un processo può aver luogo nel sistema. Un processo si dice termodinamicamente reversibile se, durante il passaggio dallo stato iniziale 1 allo stato finale 2, tutti gli stati intermedi sono in equilibrio. Un processo è detto termodinamicamente irreversibile se almeno uno degli stati intermedi è disequilibrio. Un processo reversibile può essere eseguito solo con una variazione sufficientemente lenta dei parametri del sistema: temperatura, pressione, concentrazione di sostanze, ecc. La velocità di variazione dei parametri deve essere tale che le deviazioni dall'equilibrio che si verificano durante il processo siano trascurabili. Va notato che la reversibilità è associata a un importante problema medico: la conservazione dei tessuti a basse temperature. I processi reversibili sono il caso limite dei processi reali che si verificano in natura ed eseguiti nell'industria o nei laboratori. 6. Il secondo principio della termodinamica. Entropia Lavoro massimo Wмакс, ottenibile con una data perdita di energia interna ΔE nel processo di transizione dallo stato 1 allo stato 2, si ottiene solo se questo processo è reversibile. In accordo con l'espressione per la prima legge della termodinamica, il calore minimo Qmin Qmin = ΔE - Wмакс . Il massimo fattore di efficienza ottenibile, che caratterizza l'efficienza dei costi dell'energia interna del sistema, è rispettivamente pari a ηмакс=Wмакс / ΔE. In un processo irreversibile di transizione dallo stato 1 allo stato 2, il lavoro svolto dal sistema è inferiore a W. Per calcolare il fattore massimo hмакс con valore noto di ΔE, è necessario conoscere il valore di Wмакс o Qmin Wмакс = ΔE - Qmin , quindi, ηмакс = 1 - ∆E / Qmin . Valore Qmin può essere calcolato dalla seconda legge della termodinamica usando una funzione di stato termodinamico chiamata entropia. Il concetto di entropia fu introdotto (1865) dal fisico tedesco R. Yu Clausius (1822-1888), uno dei fondatori della termodinamica e della teoria cinetica molecolare dei processi termici. Definizione termodinamica dell'entropia secondo Clausius: l'entropia è una funzione di stato il cui incremento ΔS è uguale al calore Qmin portato all'impianto in un processo isotermico reversibile, diviso per la temperatura assoluta T a cui si svolge il processo: ∆S = Qmin / T. Dalla formula segue che l'unità di entropia è J/K. Un esempio di processo isotermico reversibile è lo scioglimento lento del ghiaccio in un thermos con acqua a 273°K. È stato sperimentalmente stabilito che per sciogliere 1 mole di ghiaccio (18 g) è necessario fornire almeno 6000 J di calore. In questo caso l'entropia del sistema acqua ghiacciata nel thermos aumenta di ΔS = 6000 J: 273°K = 22 J/K. Quando un thermos con acqua viene raffreddato a 273°K, 6000 J di calore possono essere rimossi lentamente e durante la cristallizzazione dell'acqua si forma 1 mole di ghiaccio. Per questo processo, Qmin ha un valore negativo nella formula. Di conseguenza, l’entropia del sistema ghiaccio-acqua quando si forma 1 mole di ghiaccio diminuisce di ΔS = 22 J/K. Allo stesso modo, è possibile calcolare la variazione di entropia per eventuali processi fisici e chimici isotermici, se è noto il calore fornito al sistema o da esso sottratto durante questi processi. Come è noto dalla fisica, questo calore può essere determinato utilizzando misurazioni calorimetriche. Pertanto, la variazione di entropia, così come altre due funzioni dello stato del sistema: energia interna ed entalpia, è una quantità determinata sperimentalmente. Il significato fisico dell'entropia, così come dell'energia interna, si rivela chiaramente quando si considerano i processi che si verificano in sistemi isolati dal punto di vista cinetico molecolare. 7. Formula di Boltzmann I sistemi isolati, per definizione, non scambiano né materia né energia con l'ambiente. Naturalmente, tali sistemi non esistono realmente in natura. Tuttavia, è possibile ottenere un ottimo isolamento posizionando il sistema in un thermos sigillato con un tappo di sughero. Si scopre che qualsiasi processo spontaneo può avvenire in un sistema isolato solo se caratterizzato da un aumento di entropia; in equilibrio, l'entropia del sistema è costante: ∆S ≥ 0. Questa affermazione, basata su osservazioni sperimentali, è una delle possibili formulazioni del secondo principio della termodinamica. Un processo inverso allo spontaneo, secondo la seconda legge della termodinamica, non può procedere in un sistema isolato, poiché tale processo è caratterizzato da una diminuzione dell'entropia. L'esame di vari sistemi isolati mostra che i processi spontanei sono sempre associati ad un aumento del numero di microstati w del sistema. Negli stessi processi, l'entropia S del sistema aumenta, cioè l'entropia aumenta con l'aumento del numero di microstati. Per la prima volta l'esistenza di tale dipendenza fu notata dal fisico austriaco L. Boltzmann, che nel 1872 propose la relazione: КБ =R/NA = 1,38-1023 J/K, dove KБ - Costante di Boltzmann, uguale al rapporto tra la costante del gas R e la costante di Avogadro NA . Questa relazione è chiamata formula di Boltzmann. La formula di Boltzmann consente di calcolare teoricamente l'entropia di un sistema dal numero dei suoi possibili microstati. Tali calcoli sono in buon accordo con i valori determinati sperimentalmente. In particolare è noto che il numero di microstati di sostanze cristalline a 0°K è prossimo a w0 "1. Pertanto, è possibile determinare i valori assoluti dell'entropia delle sostanze cristallizzanti, in contrasto con l'energia interna E e l'entalpia H, per le quali possono essere determinati solo valori relativi. Un aumento del numero di microstati di un sistema in molti casi può essere associato ad un aumento del disordine in questo sistema, con una transizione verso distribuzioni più probabili dell'energia del sistema. Sulla base della relazione di Boltzmann, si può dare una definizione cinetico-molecolare dell'entropia. L'entropia è una misura della probabilità che un sistema si trovi in un dato stato o una misura del disordine del sistema. L'importanza del concetto di entropia è dovuta al fatto che sulla base di questo valore è possibile prevedere la direzione dei processi spontanei. Tuttavia, l'applicabilità della misurazione dell'entropia come criterio per la direzione dei processi è limitata ai sistemi isolati secondo la formulazione della seconda legge della termodinamica. 8. Energia di Gibbs Come criterio per la spontaneità dei processi nei sistemi aperti e chiusi, viene introdotta una nuova funzione di stato: l'energia di Gibbs. Questa funzione prende il nome dal grande fisico americano D. W. Gibbs (1839-1903), che derivò questa funzione e poi la utilizzò nel lavoro termodinamico. L'energia di Gibbs è determinata in termini di entalpia H ed entropia S utilizzando le relazioni: SOL = H - S, ∆G = ∆H - ∆S. Sulla base dell'energia di Gibbs, la seconda legge della termodinamica può essere formulata come segue: in condizioni isobariche isotermiche (p, T = const), solo tali processi possono verificarsi spontaneamente nel sistema, per cui l'energia di Gibbs del sistema diminuisce (ΔG < 0).Nello stato di equilibrio, l'energia di Gibbs di il sistema non cambia (G = cost, AG = 0). ΔG < 0, p, T = cost. Ne consegue che l'energia di Gibbs gioca un ruolo importante nello studio dei processi bioenergetici. Con questa funzione di stato è possibile prevedere la direzione dei processi spontanei nei sistemi biologici e calcolare la massima efficienza ottenibile. L'energia di Gibbs G, come l'entalpia H, è una funzione dello stato del sistema. Pertanto, la variazione dell'energia di Gibbs ΔG può essere utilizzata per caratterizzare le trasformazioni chimiche in modo simile alla variazione dell'entalpia ΔН. Le equazioni di reazione per le quali è indicata la variazione dell'energia di Gibbs corrispondente a queste reazioni sono anche dette termochimiche. Le reazioni chimiche, durante le quali l'energia di Gibbs del sistema diminuisce (ΔG < 0) e il lavoro è terminato, sono dette esergoniche. Le reazioni, a seguito delle quali l'energia di Gibbs aumenta (ΔG > 0) e si lavora sul sistema, sono dette endergoniche. Derivata dalla seconda legge della termodinamica, l'energia di Gibbs è una funzione di stato. Pertanto, proprio come per l'entalpia, la legge di Hess per l'energia di Gibbs può essere formulata nella forma seguente: la variazione dell'energia di Gibbs durante la formazione di determinati prodotti da determinati reagenti a pressione e temperatura costanti non dipende dal numero e dal tipo di reazioni che determinano la formazione di questi prodotti. Un importante esempio di applicazione della legge di Hess è il calcolo dell'energia di Gibbs della reazione di ossidazione del glucosio con il diossigeno. La variazione dell'energia di Gibbs in questa reazione a p = 101 kPa e T = 298°K, determinata all'esterno del corpo, è ΔG° = 2880 kJ/mol. L'equazione termochimica corrispondente è scritta come: С6Н12О6 + 6O2 = 6CO2 + 6Н2Oh, ΔGpia° = 2880 kJ/mol. Nelle cellule del corpo, questa reazione viene effettuata attraverso una serie di fasi successive studiate dai biochimici. Si può prevedere dalla legge di Hess che la somma delle variazioni di energia di Gibbs in tutte le reazioni intermedie è ΔGpia: G1 +ΔG2 +ΔG3 + … + ∆Gn = ∆Gpia 🇧🇷. L'energia di Gibbs di una reazione è uguale alla somma algebrica delle energie di Gibbs di formazione di una quantità stechiometrica di prodotti meno la somma algebrica delle energie di Gibbs di formazione di una quantità stechiometrica di reagenti: Gpia = (ncGc + nDGD)(NAGA + nBGB). 9. Soluzioni. Classificazione delle soluzioni In base allo stato di aggregazione, le soluzioni possono essere gassose, liquide e solide. Qualsiasi soluzione è costituita da soluti e un solvente, sebbene questi concetti siano alquanto arbitrari. Ad esempio, a seconda del rapporto tra la quantità di alcol e acqua, questo sistema può essere una soluzione di alcol in acqua o acqua in alcol. Solitamente, il solvente è considerato il componente che si trova nella soluzione nello stesso stato di aggregazione di prima della dissoluzione. Lo studio delle soluzioni è di particolare interesse per i medici perché i fluidi biologici più importanti - sangue, linfa, urina, saliva, sudore - sono soluzioni di sali, proteine, carboidrati, lipidi in acqua. I fluidi biologici sono coinvolti nel trasporto di nutrienti (grassi, aminoacidi, ossigeno), farmaci verso organi e tessuti, nonché nell'escrezione di metaboliti (urea, bilirubina, anidride carbonica, ecc.) Dal corpo. Il plasma sanguigno è un mezzo per le cellule: linfociti, eritrociti, piastrine. Nel mezzo liquido del corpo viene mantenuta la costanza dell'acidità, la concentrazione di sali e sostanze organiche. Questa costanza è chiamata omeostasi della concentrazione. Classificazione delle soluzioni Le soluzioni di sostanze con una massa molare inferiore a 5000 g/mol sono chiamate soluzioni di composti a basso peso molecolare (LMC) e le soluzioni di sostanze con una massa molare superiore a 5000 g/mol sono chiamate soluzioni di composti ad alto peso molecolare ( HMC). In base alla presenza o all'assenza di dissociazione elettrolitica, le soluzioni NMS sono divise in due classi: soluzioni di elettroliti e non elettroliti. Soluzioni elettrolitiche - soluzioni di sali, acidi, basi, anfoliti che si dissociano in ioni. Ad esempio, le soluzioni KNO3, HCl, KOH, Al(OH)3 , glicina. La conducibilità elettrica delle soluzioni elettrolitiche è superiore a quella del solvente. Soluzioni di non elettroliti - soluzioni di sostanze che praticamente non si dissociano nell'acqua. Ad esempio, soluzioni di saccarosio, glucosio, urea. La conduttività elettrica delle soluzioni non elettrolitiche differisce poco da quella di un solvente. Le soluzioni di NMS (elettroliti e non elettroliti) sono dette vere, in contrasto con le soluzioni colloidali. Le vere soluzioni sono caratterizzate dall'omogeneità della composizione e dall'assenza di un'interfaccia tra il soluto e il solvente. La dimensione delle particelle disciolte (ioni e molecole) è inferiore a 109m La maggior parte degli IUD sono polimeri le cui molecole (macromolecole) sono costituite da un gran numero di gruppi ripetuti o unità monomeriche interconnesse da legami chimici. Le soluzioni IUD sono chiamate soluzioni di polielettroliti. I polielettroliti includono poliacidi (eparina, acido poliadenilico, acido poliaspartico, ecc.), Polibasi (polilisina), poliamfoliti (proteine, acidi nucleici). Le proprietà delle soluzioni HMS differiscono notevolmente da quelle delle soluzioni NMS. Pertanto, saranno discussi in una sezione separata. Questo capitolo è dedicato alle soluzioni di elettroliti a basso peso molecolare, anfoliti e non elettroliti. 10. Acqua come solvente Il solvente più comune sul nostro pianeta è l'acqua. Il corpo di una persona media che pesa 70 kg contiene circa 40 kg di acqua. Allo stesso tempo, circa 25 kg di acqua cadono sul liquido all'interno delle cellule e 15 kg sono liquidi extracellulari, che includono plasma sanguigno, liquido intercellulare, liquido cerebrospinale, liquido intraoculare e contenuto liquido del tratto gastrointestinale. Negli organismi animali e vegetali, l'acqua è generalmente superiore al 50% e in alcuni casi il contenuto di acqua raggiunge il 90-95%. Per le sue proprietà anomale, l'acqua è un solvente unico, perfettamente adattato alla vita. Innanzitutto, l'acqua dissolve bene molti composti ionici e polari. Questa proprietà dell'acqua è associata in larga misura alla sua elevata costante dielettrica (78,5). Un'altra vasta classe di sostanze altamente solubili in acqua comprende composti organici polari come zuccheri, aldeidi, chetoni e alcoli. La loro solubilità in acqua è spiegata dalla tendenza delle molecole d'acqua a formare legami polari con i gruppi funzionali polari di queste sostanze, ad esempio con i gruppi ossidrilici di alcoli e zuccheri o con l'atomo di ossigeno del gruppo carbonile di aldeidi e chetoni. I seguenti sono esempi di legami idrogeno importanti per la solubilità delle sostanze nei sistemi biologici. A causa della sua elevata polarità, l'acqua provoca l'idrolisi delle sostanze. Poiché l'acqua è la parte principale dell'ambiente interno del corpo, fornisce i processi di assorbimento, movimento dei nutrienti e prodotti metabolici nel corpo. Va notato che l'acqua è il prodotto finale dell'ossidazione biologica delle sostanze, in particolare del glucosio. La formazione di acqua come risultato di questi processi è accompagnata dal rilascio di una grande quantità di energia - circa 29 kJ/mol. Importanti sono anche altre proprietà anomale dell'acqua: alta tensione superficiale, bassa viscosità, alti punti di fusione e di ebollizione e una densità maggiore allo stato liquido che allo stato solido. L'acqua è caratterizzata dalla presenza di associati - gruppi di molecole collegate da legami idrogeno. A seconda dell'affinità per l'acqua, i gruppi funzionali delle particelle disciolte si dividono in idrofili (che attirano l'acqua), facilmente solubilizzati dall'acqua, idrofobi (che respingono l'acqua) e anfifilici. I gruppi idrofili includono gruppi funzionali polari: idrossile -OH, ammino -NH2 , tiolo -SH, carbossile -COOH. A gruppi idrofobici - non polari, ad esempio radicali idrocarburici: CHXNUMX-(CH2)п -, DA6Н5 -. Le sostanze ifiliche comprendono sostanze (amminoacidi, proteine), le cui molecole contengono entrambi i gruppi idrofili (-OH, -NH2 , -SH, -COOH) e gruppi idrofobici: (CH3 - (cap2)п ,-DA6Н5🇧🇷 Quando le sostanze anfifile vengono sciolte, la struttura dell'acqua cambia a causa dell'interazione con i gruppi idrofobici. Il grado di ordinamento delle molecole d'acqua situate vicino ai gruppi idrofobici aumenta e il contatto delle molecole d'acqua con i gruppi idrofobici è ridotto al minimo. I gruppi idrofobici, associandosi, spingono le molecole d'acqua fuori dalla loro area di localizzazione. 11. La concentrazione della soluzione e come esprimerla soluzione Si chiama sistema omogeneo di composizione variabile di due o più sostanze in uno stato di equilibrio. Le sostanze che compongono una soluzione sono chiamate componenti della soluzione. Una caratteristica importante di una soluzione è la sua concentrazione. Questo valore determina molte proprietà della soluzione. Concentrazione di sostanza (componente della soluzione) è una quantità misurata dalla quantità di un soluto contenuta in una certa massa o volume di una soluzione o solvente. I modi più comunemente usati per esprimere la concentrazione sono: frazione di massa, concentrazione molare, concentrazione molare equivalente, frazione molare, frazione di volume, titolo. Frazione di massa W(X) espresso in frazioni di unità, percentuale (%), ppm (un millesimo di percento) e in parti per milione (ppm). La frazione di massa si calcola con le formule: W(X) = m(X)/m(anni), W(X) = m(X)/m(anni) × 100%, dove m(X) - massa del dato componente X (soluto), kg (g); m (anni) è la massa della soluzione, kg (g). La concentrazione molare è espressa in mol/m3 , mol/dm3 , mol/cm3 , mol/l, mol/ml. In medicina è preferibile l'uso di unità di mol/l. La concentrazione molare si calcola con la formula: C(X) =n(X)/V(pp) = m(X)/M(X) ×V(rr), dove n(X) - quantità della sostanza disciolta del sistema, mol; M(X) è la massa molare del soluto, kg/mol o g/mol; m(X) è la massa della sostanza disciolta, rispettivamente, kg o g; V(rr) - volume di soluzione, l. concentrazione molare b(X) espresso in unità di mol/kg. Modulo di registrazione, ad esempio: b (HCl) \u0,1d XNUMX mol / kg. Calcola la concentrazione molare con la formula: b(X) =n(X)/m(rl) = m(X)/M(X) ×m(rl) dove m(rl) - massa di solvente, kg. In chimica, il concetto di equivalente e di fattore di equivalenza è ampiamente utilizzato. Equivalente è chiamata una particella reale o condizionale della sostanza X, che in una data reazione acido-base equivale a uno ione idrogeno, o in una data reazione redox - un elettrone, o in una data reazione di scambio tra sali - un'unità di carica . Frazione in volume f(X) espresso in frazioni di unità o in percentuale, si calcola con la formula: Ф(X) = V(X)/V(rr) dove v(X) - il volume di questo componente X della soluzione; V(rr) è il volume totale del solvente. Il titolo della soluzione è indicato con T(X), unità di misura - kg/cm3 , g/cm3 , g/ml. Il titolo della soluzione può essere calcolato utilizzando la formula: Т(X) = m(X)/V(rr) dove m(X) è la massa della sostanza, generalmente g; V(rr) volume della soluzione, ml. 12. Processo di scioglimento La natura del processo di scioglimento è complessa. Naturalmente sorge la domanda sul perché alcune sostanze siano facilmente solubili in alcuni solventi e poco solubili o praticamente insolubili in altri. La formazione di soluzioni è sempre associata a determinati processi fisici. Uno di questi processi è la diffusione di un soluto e di un solvente. A causa della diffusione, le particelle (molecole, ioni) vengono rimosse dalla superficie della sostanza disciolta e sono distribuite uniformemente su tutto il volume del solvente. Ecco perché, in assenza di agitazione, la velocità di dissoluzione dipende dalla velocità di diffusione. Tuttavia, è impossibile spiegare la disuguale solubilità delle sostanze in vari solventi solo mediante processi fisici. Il grande chimico russo D. I. Mendeleev (1834-1907) credeva che i processi chimici giocassero un ruolo importante nella dissoluzione. Ha dimostrato l'esistenza di idrati di acido solforico H2SO4H2OH2SO42H2OH2SO44H2O e alcune altre sostanze, ad esempio C2Н5OH3H2R. In questi casi la dissoluzione è accompagnata dalla formazione di legami chimici tra le particelle del soluto e del solvente. Questo processo è chiamato solvatazione, nel caso particolare quando il solvente è l'acqua - idratazione. Come è stato stabilito, a seconda della natura della sostanza disciolta, si possono formare solvati (idrati) a seguito di interazioni fisiche: interazione ione-dipolo (ad esempio durante la dissoluzione di sostanze con struttura ionica (NaCI, ecc. ); Interazione dipolo-dipolo - durante la dissoluzione di sostanze con una struttura molecolare (sostanze organiche )). Le interazioni chimiche sono effettuate a causa di legami donatore-accettore. Qui, gli ioni soluto sono accettori di elettroni e i solventi (Н2Oh, NH3) - donatori di elettroni (ad esempio la formazione di acquacomplessi), nonché come risultato della formazione di legami idrogeno (ad esempio la dissoluzione dell'alcol in acqua). La prova dell'interazione chimica di un soluto con un solvente è fornita dagli effetti termici e dal cambiamento di colore che accompagna la dissoluzione. Ad esempio, quando l'idrossido di potassio viene sciolto in acqua, viene rilasciato calore: KOH + xN2O \uXNUMXd KOH (N2Oh; ΔH°soluzione = 55 kJ/mol. E quando il cloruro di sodio si scioglie, il calore viene assorbito: NaCI + xH2O = NaCl(H2Oh; ΔH°soluzione = +3,8 kJ/mol. Viene chiamato il calore rilasciato o assorbito quando 1 mole di una sostanza viene dissolta calore di soluzione Qsoluzione Secondo il primo principio della termodinamica Qsoluzione = ΔHsoluzione, dove ΔHsoluzione è la variazione di entalpia alla dissoluzione di una data quantità di una sostanza. La dissoluzione del solfato di rame bianco anidro in acqua porta alla comparsa di un colore blu intenso. La formazione di solvati, il cambiamento di colore, gli effetti termici e una serie di altri fattori indicano un cambiamento nella natura chimica dei componenti della soluzione durante la sua formazione. Pertanto, secondo i concetti moderni, la dissoluzione è un processo fisico-chimico in cui giocano un ruolo i tipi di interazione sia fisici che chimici. 13. Termodinamica del processo di dissoluzione Secondo la seconda legge della termodinamica, a p, T = const, le sostanze possono dissolversi spontaneamente in qualsiasi solvente se, a seguito di questo processo, l'energia di Gibbs del sistema diminuisce, cioè ΔG = (ΔН - TΔS) < 0. Il valore di ΔН è chiamato fattore di entalpia e il valore di TΔS è chiamato fattore di entropia di dissoluzione. Quando le sostanze liquide e solide vengono disciolte, l'entropia del sistema solitamente aumenta (ΔS > 0), poiché le sostanze disciolte passano da uno stato più ordinato a uno meno ordinato. Il contributo del fattore di entropia, che contribuisce all'aumento della solubilità, è particolarmente evidente a temperature elevate, perché in questo caso il fattore T è grande ed è grande anche il valore assoluto del prodotto TΔS, rispettivamente la diminuzione del Gibbs l'energia aumenta. Quando si dissolvono i gas in un liquido, l'entropia del sistema di solito diminuisce (ΔS < 0), poiché il soluto da uno stato meno ordinato (grande volume) passa in uno stato più ordinato (piccolo volume). Una diminuzione della temperatura favorisce la dissoluzione dei gas, perché in questo caso il fattore T è piccolo e il valore assoluto del prodotto TΔS sarà tanto minore e tanto maggiore sarà la diminuzione dell'energia di Gibbs quanto minore sarà il valore di T. Durante la formazione di una soluzione, l'entalpia del sistema può anche aumentare (NaCl) e diminuire (KOH). La variazione dell'entalpia del processo di dissoluzione deve essere considerata secondo la legge di Hess come la somma algebrica dei contributi endo ed esotermici di tutti i processi che accompagnano il processo di dissoluzione. Questi sono gli effetti endotermici della distruzione del reticolo cristallino delle sostanze, la rottura dei legami delle molecole, la distruzione della struttura iniziale del solvente e gli effetti esotermici della formazione di vari prodotti di interazione, compresi i solvati. Per semplicità di presentazione, l'incremento dell'entalpia di dissoluzione ΔНsoluzione può essere rappresentato come la differenza di energia Ecr, speso per la distruzione del reticolo cristallino della sostanza disciolta, e l'energia Esale, rilasciato durante la solvatazione delle particelle di soluto dalle molecole di solvente. In altre parole, la variazione di entalpia è la somma algebrica della variazione di entalpia ΔНcr come risultato della distruzione del reticolo cristallino e di un cambiamento nell'entalpia ΔНsale per solvatazione da particelle di solvente: ΔNsoluzione = ΔHcr + ΔHsale, dove ΔHsoluzione - variazione di entalpia durante la dissoluzione. Tuttavia, la dissoluzione dei gas nobili in solventi organici è spesso accompagnata dall'assorbimento di calore, ad esempio elio e neon in acetone, benzene, etanolo e cicloesano. Quando si dissolvono solidi con una struttura cristallina molecolare e liquidi, i legami molecolari non sono molto forti e quindi di solito ΔHsale > ΔNcr Ciò porta al fatto che la dissoluzione, ad esempio, di alcoli e zuccheri è un processo esotermico (ΔНsoluzione <0). Quando si dissolvono i solidi con un reticolo ionico, il rapporto energetico Ecr ed Esale potrebbe essere diverso. Tuttavia, nella maggior parte dei casi, l'energia rilasciata durante la solvatazione degli ioni non compensa l'energia spesa per la distruzione del reticolo cristallino, quindi il processo di dissoluzione è endotermico. Pertanto, i dati termodinamici consentono di prevedere la dissoluzione spontanea di varie sostanze sulla base del primo e del secondo principio della termodinamica. 14. Solubilità Se un soluto viene a contatto con un solvente, il processo di formazione della soluzione in molti casi procede spontaneamente fino al raggiungimento di una certa concentrazione limite (si verifica la saturazione). Questo accade quando si raggiunge l'equilibrio, quando i fattori di entalpia ed entropia sono uguali, cioè ΔН = TΔS. Ad esempio, quando i cristalli vengono introdotti in un liquido, le molecole o gli ioni passano dalla superficie del cristallo alla soluzione. A causa della diffusione, le particelle sono distribuite uniformemente in tutto il volume del solvente. Lo scioglimento procede a saturazione. Una soluzione che contiene la massima quantità di soluto ad una data temperatura ed è in equilibrio con un eccesso di soluto si dice satura. Una soluzione supersatura è una soluzione la cui concentrazione è superiore a quella di una soluzione satura. Una soluzione con una concentrazione inferiore a una soluzione satura è chiamata insatura. La capacità di una sostanza di dissolversi in un particolare solvente è chiamata solubilità. Numericamente, la solubilità di una sostanza è uguale alla concentrazione della sua soluzione satura. La solubilità può essere espressa nelle stesse unità della concentrazione, ad esempio in termini di quantità di soluto contenuta in 1 litro di una soluzione satura, mol/l, o in termini di massa di un soluto in 100 g di una soluzione satura . L'unità di solubilità è di grammi per 100 g di solvente. Il valore corrispondente è chiamato coefficiente di solubilità. La solubilità dipende dalla natura del soluto e del solvente, dalla temperatura, dalla pressione e dalla presenza di altre sostanze nella soluzione. Influenza sulla solubilità della natura dei componenti La capacità delle sostanze di dissolversi è determinata dalla natura delle forze di interazione tra le molecole dei componenti della soluzione X1 loro2 : solvente - solvente (X1 - X1 ), soluto - soluto (X2 - X2 ), solvente - soluto (X1 - X2 ) (i punti indicano il legame molecolare). La solubilità delle sostanze varia ampiamente. Gli esempi mostrano la solubilità di diversi sali nello stesso solvente (acqua) e la solubilità della stessa sostanza (AgNO3 ) in vari solventi. Le sostanze con un legame di tipo ionico e le sostanze costituite da molecole polari si dissolvono meglio in solventi polari, come acqua, alcoli. Questi solventi sono caratterizzati da un'elevata costante dielettrica. L'elevata solubilità delle sostanze è molto spesso dovuta alla formazione di legami intermolecolari, in particolare idrogeno. Pertanto, la solubilità reciproca illimitata di acqua e alcol è spiegata dalla formazione di legami idrogeno tra le molecole di acqua e alcol, e la dissoluzione dei cristalli AgcI in una soluzione acquosa di ammoniaca è spiegata dalla formazione di un legame chimico donatore-accettore dell'argento ione con molecole di ammoniaca (AgCI è praticamente insolubile in acqua). Per lo stesso motivo la piridina, un solvente a bassa costante dielettrica, presenta una solubilità molto elevata. Poiché la solubilità caratterizza il vero equilibrio, l'influenza delle condizioni esterne su questo stato (pressione, temperatura) può essere stimata qualitativamente utilizzando il principio di Le Chatelier. Tali valutazioni sono necessarie nella pratica dell'immersione profonda, quando si lavora in negozi caldi, ecc. 15. Solubilità dei gas nei liquidi. Leggi di Henry-Dalton e Sechenov La dissoluzione dei gas nei liquidi è quasi sempre accompagnata dal rilascio di calore. Pertanto, la solubilità dei gas diminuisce all'aumentare della temperatura secondo il principio di Le Chatelier. Questo schema viene spesso utilizzato per rimuovere i gas disciolti dall'acqua (ad es. CO02) mediante ebollizione. A volte la dissoluzione di un gas è accompagnata dall'assorbimento di calore (ad esempio la dissoluzione di gas nobili in alcuni solventi organici). In questo caso, un aumento della temperatura aumenta la solubilità del gas. Un gas non si dissolve in un liquido indefinitamente. Ad una certa concentrazione di gas X si stabilisce un equilibrio:  Quando un gas si dissolve in un liquido, si verifica una significativa diminuzione del volume del sistema. Pertanto, un aumento della pressione, secondo il principio di Le Chatelier, dovrebbe portare ad uno spostamento dell'equilibrio verso destra, cioè ad un aumento della solubilità del gas. Se il gas è leggermente solubile in un dato liquido e la pressione è bassa, la solubilità del gas è proporzionale alla sua pressione. Questa dipendenza è espressa dalla legge di Henry (1803): la quantità di gas disciolto a una data temperatura in un dato volume di liquido all'equilibrio è direttamente proporzionale alla pressione del gas. La legge di Henry può essere scritta nella forma seguente: с (X) = kr(X) × p(X) dove è la concentrazione di gas in una soluzione satura, mol/l; P(X) - pressione del gas X sulla soluzione, Pa; Kr(X) - Costante di Henry per il gas X, mol × l1 × Pa1 . La costante di Henry dipende dalla natura del gas, del solvente e della temperatura. La legge di Henry vale solo per soluzioni relativamente diluite, a basse pressioni e in assenza di interazione chimica tra le molecole del gas disciolto e il solvente. La legge di Henry è un caso speciale della legge generale di Dalton. Se stiamo parlando della dissoluzione non di una sostanza gassosa, ma di una miscela di gas, la solubilità di ciascun componente obbedisce alla legge di Dalton: la solubilità di ciascuno dei componenti della miscela gassosa a temperatura costante è proporzionale alla pressione parziale del componente al di sopra del liquido e non dipende dalla pressione totale della miscela e dall'individualità degli altri componenti. In altre parole, nel caso della dissoluzione di una miscela di gas in un liquido, la pressione parziale p! questo componente. La pressione parziale di un componente è intesa come la proporzione della pressione del componente rispetto alla pressione totale della miscela di gas: Рi/ Rобщ La pressione parziale del componente è calcolata dalla formula Studiando la solubilità dei gas nei liquidi in presenza di elettroliti, il fisiologo russo I. M. Sechenov (1829-1905) stabilì il seguente schema (legge di Sechenov): la solubilità dei gas nei liquidi in presenza di elettroliti diminuisce; i gas vengono rilasciati. Рi = Pобщ ×(xi) dove pagi - pressione parziale del componente Xi; Робщ pressione totale della miscela di gas; x(Xi) è la frazione molare dell'i-esimo componente. Studiando la solubilità dei gas nei liquidi in presenza di elettroliti, il fisiologo russo I. M. Sechenov (1829-1905) stabilì il seguente schema (legge di Sechenov): la solubilità dei gas nei liquidi in presenza di elettroliti diminuisce; i gas vengono rilasciati. 16. Il ruolo della diffusione nei processi di trasferimento di sostanze nei sistemi biologici La diffusione gioca un ruolo importante nei sistemi biologici. Innanzitutto, il movimento dei nutrienti e dei prodotti metabolici nei fluidi tissutali avviene per diffusione. Inoltre, in molti casi, la velocità dei processi fisico-chimici negli organismi viventi è determinata dalla velocità di diffusione dei reagenti, poiché la diffusione dei reagenti è solitamente la fase più lenta del processo, mentre le reazioni biochimiche che coinvolgono gli enzimi procedono molto rapidamente. Ogni cellula vivente è circondata da una membrana che serve a proteggere e regolare l'ambiente intracellulare. Le sostanze attraversano le membrane attraverso due meccanismi principali: per diffusione ordinaria (trasporto passivo) e per trasferimento energicamente attivato (trasporto attivo). Lo strato interno della membrana è costituito da catene di idrocarburi. Pertanto, molte piccole molecole neutre e molecole HMS non polari sono solubili in questo strato e possono passare attraverso la membrana per diffusione normale lungo un gradiente di concentrazione. Tale trasporto di sostanze è chiamato passivo. La diffusione gioca un ruolo importante nel processo di ossigenazione del sangue nei polmoni. A causa della grande ramificazione, la superficie degli alveoli polmonari è grande (~ 80 m2), quindi l'ossigeno si dissolve attivamente nel plasma ed entra nei globuli rossi. Il sangue venoso è privo di ossigeno: la concentrazione di ossigeno nel sangue venoso tende a zero. Di conseguenza, il gradiente di concentrazione di ossigeno tra l'atmosfera e il sangue che entra nei polmoni è elevato, il che porta ad un assorbimento attivo (secondo la legge di Fick). Il trasferimento di sostanze da un'area a concentrazione minore a un'area a concentrazione maggiore contro un gradiente è chiamato trasporto attivo. Un tale processo non può avvenire spontaneamente e richiede un dispendio energetico. La fonte di energia è la reazione esergonica dell'idrolisi di un composto bioinorganico: l'adenosina trifosfato (ATP). Una distribuzione stazionaria stabile delle concentrazioni di ioni K all'interno e all'esterno della cellula si ottiene quando il flusso di ioni K attraverso la membrana nella cellula diventa uguale al flusso di ioni K dalla cellula a causa della diffusione passiva. La distribuzione (omeostasi ionica) si ottiene in modo simile per gli ioni Na, solo il trasporto attivo e la diffusione passiva compensativa degli ioni sono diretti di fronte ai corrispondenti flussi di ioni K. Il processo di diffusione è ampiamente utilizzato in medicina. Ad esempio, nella pratica clinica viene utilizzato un metodo di dialisi basato sulla selettività della diffusione di sostanze a basso peso molecolare attraverso una membrana semipermeabile lungo un gradiente di concentrazione per creare un dispositivo “rene artificiale”. Le particelle IUD non passano attraverso una membrana semipermeabile, quindi i fluidi biologici (ad esempio il plasma sanguigno) possono essere purificati mediante dialisi da sostanze dannose a basso peso molecolare - "scorie" (urea, acido urico, bilirubina, ammine, ioni K in eccesso ) che si accumulano in varie malattie. Durante la purificazione, il sangue del paziente, drenato da una vena, entra in speciali camere con membrane semipermeabili attraverso le quali la NMS può diffondersi ed essere rimossa dal plasma. In una serie di malattie infiammatorie si verifica la distruzione delle proteine e nel plasma sanguigno, insieme alla NMS, ci sono frammenti proteici (peptidi e polipeptidi) che devono anche essere rimossi. 17. Abbassamento del punto di congelamento e aumento del punto di ebollizione delle soluzioni Una diretta conseguenza della diminuzione della pressione del vapore sulla soluzione è una variazione del punto di congelamento ΔTз e punto di ebollizione delle soluzioni ΔТк rispetto ai valori di queste quantità per un solvente puro. Le relazioni tra queste quantità derivano anche dalla seconda legge della termodinamica. Il punto di ebollizione di un liquido è la temperatura alla quale la sua pressione di vapore diventa uguale alla pressione esterna (ad esempio, a 101,3 kPa, il punto di ebollizione dell'acqua è 100 ° C). Il punto di congelamento (cristallizzazione) di un liquido è la temperatura alla quale la tensione di vapore sul liquido è uguale alla pressione di vapore sulla fase solida. Se designiamo i punti di congelamento e di ebollizione della soluzione T3 e Tk, e gli stessi valori per il solvente T°3 e T°к , quindi otteniamo: ∆Tk = Tк - T°к > 0 , XNUMX, ΔT3 = T°3 - T3 > 0. Gli effetti dell'aumento del punto di ebollizione e dell'abbassamento del punto di congelamento delle soluzioni possono essere spiegati qualitativamente utilizzando il principio di Le Chatelier. Infatti, se in un sistema di equilibrio "liquido - vapore" (ad esempio, H2О(H) - H2О(G)), introdurre una sostanza solubile non volatile, quindi la pressione di vapore del solvente sulla soluzione diminuirà. Per compensare la diminuzione della tensione di vapore e raggiungere il precedente stato di equilibrio, la soluzione deve essere riscaldata ad una temperatura superiore (oltre 373°K), poiché il processo è endotermico. Sia presente un sistema di equilibrio "fase solida - liquido", ad esempio H2О(T) > H2О(H), a 273°K. Se una certa quantità di una sostanza non volatile (insolubile nella fase solida) viene disciolta nella fase liquida, la concentrazione delle molecole d'acqua nella fase liquida diminuirà. Secondo il principio di Le Chatelier, inizierà un processo che aumenta la quantità di acqua nella fase liquida: lo scioglimento del ghiaccio. Per stabilire un nuovo equilibrio è necessario raffreddare la soluzione, cioè abbassare la temperatura, poiché il processo è esotermico. Secondo la legge di Raoult per le soluzioni diluite, la diminuzione della tensione di vapore è proporzionale alla concentrazione della soluzione. Pertanto, l'aumento del punto di ebollizione e la diminuzione del punto di congelamento di tali soluzioni dovrebbero aumentare all'aumentare della loro concentrazione. Studiando il congelamento e l'ebollizione delle soluzioni, Raul ha riscontrato: un aumento del punto di ebollizione ΔTк e abbassando il punto di congelamento ΔТ3 soluzioni diluite di non elettroliti è direttamente proporzionale alla concentrazione molare della soluzione: ΔTк = Kэb(X), ΔT3 = Kз b(X), dove b(X) - concentrazione molare, mol/kg; Кз e Kэ - coefficienti di proporzionalità, kg × K × mol1 , che sono chiamate rispettivamente costanti ebulliometriche e criometriche. Il significato fisico delle costanti Kэ e Kз diventa chiaro se accettiamo b(X) = 1. Quindi Kэ = ΔTк , e Kз = ΔTз . In altre parole, la costante ebulliometrica è numericamente uguale all'aumento del punto di ebollizione di una soluzione unmolare, e la costante criometrica è uguale alla diminuzione della temperatura di congelamento di una soluzione unmolare. Le costanti ebulimetriche e criometriche dipendono solo dalla natura del solvente e non dalla natura del soluto (soluzioni ideali). 18. Pressione osmotica L'osmosi è la penetrazione prevalentemente unilaterale di molecole di solvente (diffusione) attraverso una membrana semipermeabile da un solvente in una soluzione o da una soluzione con una concentrazione inferiore in una soluzione con una concentrazione maggiore. Condizione necessaria per il verificarsi dell'osmosi è la presenza di un solvente e una soluzione o due soluzioni di diverse concentrazioni, separate da una membrana semipermeabile. Dal punto di vista della termodinamica, la forza trainante dell'osmosi è il desiderio del sistema di equalizzare le concentrazioni, poiché in questo caso l'entropia del sistema aumenta, poiché il sistema passa in uno stato meno ordinato, l'energia di Gibbs del sistema diminuisce di conseguenza e i potenziali chimici sono equalizzati. Pertanto, l'osmosi è un processo spontaneo. Un semplice esperimento può servire come illustrazione per spiegare la connessione tra il meccanismo dell'osmosi e una variazione della pressione del vapore su una soluzione. Se in un recipiente di vetro chiuso vengono posti un becher con un solvente puro e un becher con una soluzione di qualche sostanza non volatile (i livelli dei liquidi nei recipienti sono gli stessi), dopo un po' il livello del liquido nel il primo bicchiere diminuirà e il livello della soluzione nel secondo bicchiere aumenterà. In questo caso, il solvente passa dal primo al secondo becher, il che è dovuto (secondo la legge di Raoult) a una tensione di vapore del solvente sulla soluzione inferiore rispetto al solvente puro. Pertanto, lo spazio d'aria tra il solvente e la soluzione agisce come una membrana semipermeabile. Riempiamo un recipiente con pareti semipermeabili con una soluzione acquosa di glucosio e poniamolo in un altro recipiente con acqua in modo che i livelli dei liquidi in questi recipienti coincidano. Come risultato dell'osmosi, il volume della soluzione nel primo recipiente aumenta e il livello del liquido in questo recipiente aumenta gradualmente. Questo crea una pressione idrostatica aggiuntiva che impedisce l'osmosi. La pressione idrostatica della colonna di liquido all'equilibrio osmotico determina la pressione osmotica della soluzione. Pressione osmotica chiamato il valore misurato dalla pressione idraulica minima che deve essere applicata alla soluzione per fermare l'osmosi. Leggi della pressione osmotica. Van't Hoff ha proposto un'equazione empirica per calcolare la pressione osmotica di soluzioni diluite di non elettroliti: π = C(X)rt, dove π - pressione osmotica, kPa; С(X) - concentrazione molare, mol/l; R è la costante universale del gas uguale a 8,31 kPa - l / (mol - K); T è la temperatura assoluta, K. Sebbene la legge di van't Hoff sia stata stabilita sulla base di dati sperimentali, essa può essere derivata dalle condizioni di equilibrio termodinamico a ΔG = 0. Pertanto, tale legge va considerata come una conseguenza della seconda legge della termodinamica. L'espressione nella forma sopra è simile all'equazione di Clapeyron-Mendeleev per i gas ideali, tuttavia, queste equazioni descrivono processi diversi. 19. Il ruolo dell'osmosi e della pressione osmotica nei sistemi biologici Il fenomeno dell'osmosi gioca un ruolo importante in molti sistemi chimici e biologici. L'osmosi regola il flusso dell'acqua nelle cellule e nelle strutture intercellulari. L'elasticità delle cellule (turgore), che garantisce l'elasticità dei tessuti e la conservazione di una certa forma degli organi, è dovuta alla pressione osmotica. Le cellule animali e vegetali hanno gusci o uno strato superficiale di protoplasma che ha le proprietà delle membrane semipermeabili. Quando queste cellule vengono poste in soluzioni con diverse concentrazioni, si osserva l'osmosi. Le soluzioni che hanno la stessa pressione osmotica sono dette isotoniche. Se due soluzioni hanno pressioni osmotiche diverse, allora la soluzione con pressione osmotica maggiore è ipertonica rispetto alla seconda, e la seconda è ipotonica rispetto alla prima. Quando le cellule vengono poste in una soluzione isotonica, mantengono le loro dimensioni e funzionano normalmente. Quando le cellule vengono poste in una soluzione ipotonica, l'acqua da una soluzione esterna meno concentrata passa nelle cellule, il che porta al loro gonfiore, quindi alla rottura delle membrane e al deflusso del contenuto cellulare. Questa distruzione delle cellule è chiamata lisi, nel caso dei globuli rossi questo processo è chiamato emolisi. Il sangue con contenuto cellulare che fuoriesce durante l'emolisi è chiamato sangue di vernice a causa del suo colore. Quando le cellule vengono poste in una soluzione ipertonica, l'acqua lascia le cellule in una soluzione più concentrata e si osserva l'increspatura (essiccamento) delle cellule. Questo fenomeno è chiamato plasmolisi. I fluidi biologici umani (sangue, linfa, fluidi tissutali) sono soluzioni acquose di composti a basso peso molecolare - NaCl, KCl, CaCl, composti ad alto peso molecolare - proteine, polisaccaridi, acidi nucleici ed elementi formati - eritrociti, leucociti, piastrine. Il loro effetto totale determina la pressione osmotica dei fluidi biologici. La pressione osmotica del sangue umano a 310°K (37°C) è di 780 kPa (7,7 atm). La stessa pressione è creata da una soluzione acquosa allo 0,9% di NaCl (0,15 mol/l), che quindi è isotonica con il sangue (soluzione salina). Tuttavia, oltre agli ioni Na e C1, ci sono altri ioni nel sangue, così come IUD ed elementi formati. Pertanto, ai fini medici, è più corretto utilizzare soluzioni contenenti gli stessi componenti e nella stessa quantità di quelle che compongono il sangue. Queste soluzioni sono utilizzate come sostituti del sangue in chirurgia. Il corpo umano, oltre alla pressione osmotica, è caratterizzato dalla costanza (omeostasi) e da altri indicatori fisico-chimici del sangue, come l'acidità. Le fluttuazioni ammissibili della pressione osmotica del sangue sono molto piccole e anche in patologie gravi non superano diverse decine di kPa. In varie procedure, solo soluzioni isotoniche possono essere iniettate in grandi quantità nel sangue di esseri umani e animali. Con grandi perdite di sangue (ad esempio, dopo operazioni importanti, lesioni), ai pazienti vengono iniettati diversi litri di soluzione isotonica per compensare la perdita di liquidi con il sangue. Il fenomeno dell'osmosi è ampiamente utilizzato nella pratica medica. Quindi, in chirurgia, vengono utilizzate medicazioni ipertoniche (garza imbevuta di una soluzione ipertonica di NaCl al 10%), che vengono iniettate in ferite purulente. Secondo la legge dell'osmosi, la corrente del fluido della ferita attraverso la garza viene diretta verso l'esterno, a seguito della quale la ferita viene costantemente pulita da pus, microrganismi e prodotti di decomposizione. 20. Grado di dissociazione (ionizzazione). La forza degli elettroliti Gli elettroliti che si dissociano quasi completamente in ioni (ionizzati) sono detti forti, mentre gli elettroliti che non si ionizzano completamente sono detti deboli. In una soluzione di elettroliti deboli, insieme agli ioni, ci sono molecole non ionizzate. Fu per ionizzazione incompleta che S. Arrhenius spiegò perché il coefficiente isotonico delle soluzioni di elettroliti deboli non è uguale a un intero. Per caratterizzare quantitativamente la completezza della dissociazione, viene introdotto il concetto di grado di dissociazione (ionizzazione). Il grado di dissociazione (ionizzazione) di un elettrolita è il rapporto tra il numero di molecole decomposte in ioni e il numero totale delle sue molecole introdotte nella soluzione. In altre parole, an è la proporzione di molecole elettrolitiche decomposte in ioni. Il grado di dissociazione an è espresso in percentuale o frazioni di unità: αн = Nн/ Np, dove N è il numero di molecole elettrolitiche decomposte in ioni; Np il numero di molecole di elettrolita introdotte nella soluzione (disciolte). Quindi, per C(CHXNUMXCOOH) = 0,1 mol/l, grado di dissociazione αн = 0,013 (o 1,3%). A seconda del grado di dissociazione, gli elettroliti sono convenzionalmente divisi in forti (αн > 30%) e debole (αн < 3%). Nell'intervallo, gli elettroliti sono considerati di media forza. Quasi tutti i sali sono considerati elettroliti forti. Tra gli acidi e le basi più importanti, H2SO4 , HCI, HBr, HI, HNO3 , NaOH, KOH, Ba(OH)2 . La maggior parte degli acidi organici, così come alcuni composti inorganici, appartengono agli elettroliti deboli - H2S, HCN, N2CON3 , COSÌ3 , HCl0, N2SU3IN3 ,Hg2CI2 ,Fe(SCN)3 . An è determinato sperimentalmente misurando la deviazione delle proprietà collative delle soluzioni elettrolitiche dalle dipendenze teoriche per soluzioni ideali. Ad esempio, il coefficiente isotonico i viene determinato con il metodo crioscopico, quindi viene calcolato il grado di dissociazione Per elettroliti forti, il grado di dissociazione è evidente, poiché si dissociano quasi completamente in ioni. La deviazione del coefficiente isotonico i dalla conoscenza intera è spiegata per loro non dalla presenza di molecole non associate nella soluzione, ma da altri motivi. La dissociazione è accompagnata dal rilascio o dall'assorbimento di calore. Pertanto, il grado di dissociazione deve dipendere dalla temperatura. L'influenza della temperatura può essere stimata secondo il principio di Le Chatelier. Se la dissociazione elettrolitica avviene con l'assorbimento di calore, all'aumentare della temperatura aumenta an, se con il rilascio di calore diminuisce. Il grado di dissociazione elettrolitica è influenzato dalla concentrazione della soluzione. Quando la soluzione viene diluita, il grado di dissociazione aumenta in modo significativo. A questo proposito, la classificazione indicata della forza degli elettroliti in base al grado di dissociazione αн valido solo per soluzioni con concentrazione di circa 0,1 mol/l. Se consideriamo la dissociazione elettrolitica come un processo reversibile di equilibrio, allora, secondo il principio di Le Chatelier, la diluizione con acqua aumenta il numero di molecole distillate, cioè il grado di dissociazione aumenta. Il grado di dissociazione degli elettroliti deboli è influenzato anche dall'aggiunta di ioni con lo stesso nome. Pertanto, l'introduzione di un elettrolita debole nel sistema di equilibrio aumenta la concentrazione di ioni, che, secondo il principio di Le Chatelier, porta a uno spostamento significativo dell'equilibrio di dissociazione a sinistra, ovvero una diminuzione del grado di dissociazione . Pertanto, l'aggiunta di ioni con lo stesso nome a una soluzione elettrolitica debole riduce il grado della sua dissociazione. 21. Costante di dissociazione. La legge sull'allevamento di Ostwald. Teoria delle soluzioni di elettroliti forti Quantitativamente, la dissociazione elettrolitica come processo reversibile di equilibrio può essere caratterizzata da una costante di dissociazione (ionizzazione) determinata dalla legge dell'azione di massa. La legge dell'azione di massa, in senso stretto, è applicabile alle reazioni reversibili, cioè alle soluzioni di elettroliti deboli. Ad esempio, la dissociazione dell'elettrolita KtnAnm può essere rappresentata come un processo di equilibrio: Ktn Anm × nKtm+ +mAn . Secondo la legge dell'azione di massa, la costante di equilibrio si scrive come segue: КД = (ktm+)n+(Unn)m + (ktnAnm) dove (Ktm+) e unn ) - concentrazioni di equilibrio molare di ioni elettroliti; (KtnAnm) è la concentrazione di equilibrio molare delle molecole di elettrolita non dissociate; КД è la costante di equilibrio, detta costante di dissociazione. Questa equazione è valida solo per soluzioni diluite di elettroliti deboli. Quando lo si applica a soluzioni concentrate ea soluzioni di elettroliti forti, l'equazione deve essere modificata. Maggiore è la costante di dissociazione KД , più l'elettrolita si dissocia. Contrariamente al grado di dissociazione KД dipende solo dalla natura del solvente, dell'elettrolita e della temperatura, ma non dipende dalla concentrazione della soluzione. Pertanto, sia la costante che il grado di dissociazione elettrolitica sono caratteristiche quantitative della dissociazione. Naturalmente c'è una connessione tra loro. Gli acidi polibasici e le basi poliacide si dissociano gradualmente. Ad esempio, la dissociazione dell'acido fosforico avviene in tre fasi:  Allo stesso modo per le basi poliacidi (ad esempio Ca (OH)2) - la dissociazione avviene in due fasi. La dissociazione graduale è caratterizzata dal fatto che la decomposizione dell'elettrolita in ogni fase successiva avviene in misura minore rispetto a quella precedente. Questo carattere del cambiamento nelle costanti di dissociazione può essere spiegato dall'attrazione elettrostatica sulla base della legge di Coulomb. L'energia di ionizzazione è minima quando uno ione viene staccato da una molecola di elettrolita neutra. Il distacco di uno ione ad ogni fase successiva della dissociazione richiede energia crescente, poiché la rimozione di uno ione avviene da una particella la cui carica diventa più grande nelle fasi successive. La dissociazione quasi completa degli elettroliti forti in ioni, indipendentemente dalla concentrazione delle loro soluzioni, è confermata da metodi di ricerca fisica e fisico-chimica. Pertanto, i valori del calore di neutralizzazione di tutti gli acidi forti da parte di basi forti in soluzioni diluite sono quasi gli stessi. Indipendentemente dalla natura dell'acido e della base si ottiene lo stesso valore AH = 56,5 kJ/mol. Questo fatto è una chiara prova della completa dissociazione delle soluzioni diluite di acidi e basi. In tutti i casi, il processo comune che avviene durante la neutralizzazione è la combinazione di ioni in una mole 22. Teoria degli acidi e delle basi Molti elettroliti, in particolare idrossidi di vari elementi E, presentano le proprietà di acidi o basi. La dissociazione dell'EON idrossido può procedere in due tipi: 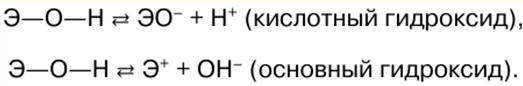 Il divario può verificarsi lungo entrambi i legami del gruppo EONE. Come è noto, la polarità e la forza dei legami dipendono dalla differenza di elettronegatività degli elementi, dalla dimensione e dalla carica effettiva degli atomi. Se l'energia di rottura del legame OH è molto inferiore all'energia di rottura del legame EO, la dissociazione dell'idrossido procede secondo il tipo di acido. Se, al contrario, l'energia di rottura del legame OH è molto maggiore dell'energia di rottura del legame EO, allora la dissociazione procede secondo il tipo principale. Negli idrossidi di metalli alcalini e alcalino terrosi, nonché nei metalli di transizione in stati di ossidazione bassi, la forza del legame EO è relativamente bassa, l'ossigeno è legato più fortemente all'idrogeno e la dissociazione E-O-H procede principalmente secondo il tipo di base, cioè, con l'eliminazione dell'idrossido dione. Ciò è dovuto al fatto che gli ioni di tali elementi sono di dimensioni piuttosto grandi e hanno una piccola carica effettiva, cioè hanno una debole capacità di polarizzazione. Con l'aumento del grado di ossidazione, l'effetto polarizzante dell'atomo E aumenta (aumento della carica specifica), l'ossigeno è legato più saldamente all'elemento E e la dissociazione di E-O-H avviene prevalentemente in base al tipo di acido, cioè allo ione idrogeno. è diviso. Quest'ultimo è associato alla ridistribuzione della densità elettronica nell'atomo di ossigeno. Di conseguenza, il legame E-O diventa più forte e il legame OH diventa più debole. Attualmente non esiste una definizione univoca dei concetti di acido e base, che potrebbero ugualmente essere utilizzati per caratterizzare le interazioni acido-base in qualsiasi solvente. Per caratterizzare molti elettroliti in soluzioni acquose, è ancora possibile utilizzare i concetti di acido e base dati da Arrhenius: 1) un acido è un elettrolita che si dissocia in soluzioni per formare ioni idrogeno H; 2) la base è un elettrolita che si dissocia in soluzioni con formazione di ioni idrossido OH; 3) l'anfolita (idrossido anfotero) è un elettrolita che si dissocia in soluzione per formare sia ioni idrogeno che ioni idrossido. Gli anfoliti includono idrossidi di zinco, alluminio, cromo e altri elementi anfoteri, nonché amminoacidi, proteine, acidi nucleici. L'applicazione del principio di Le Chatelier a una catena di equilibri acido-base mostra che con un aumento della concentrazione di idrossidioni OH nel sistema, aumenta la probabilità di dissociazione di tipo acido. Un aumento della concentrazione di ioni idrogeno H+ nel sistema porta ad una dissociazione preferenziale secondo la tipologia principale. Ciò significa che in un ambiente acido l'anfolita presenta un carattere basico, mentre in un ambiente alcalino presenta un carattere acido. Ad esempio, l'idrossido di zinco si comporta come una base quando interagisce con gli acidi: Zn (OH)2 + 2HCI-ZnCI2 + 2Н2Oh, e quando si interagisce con alcali - come acido: Zn(OH)2+2NaOH→Na2[Zn(OH)4]. 23. Sistemi tampone ematico Plasma sanguigno I sistemi tampone sono di grande importanza nel mantenimento dell'equilibrio acido-base degli organismi. I fluidi intracellulari ed extracellulari di tutti gli organismi viventi sono caratterizzati da un valore di pH costante, che viene mantenuto con l'aiuto di sistemi tampone. Il valore del pH della maggior parte dei fluidi intracellulari è compreso tra 6,8 e 7,8. L'equilibrio acido-base dell'equilibrio di CO nel sangue umano è fornito da sistemi tampone idrogeno-carbonato, fosfato e proteine. Il valore normale del pH del plasma sanguigno è 7,40 ± 0 05. Ciò corrisponde all'intervallo dei valori di acidità attiva da 3,7 a 4,0x108 mol/l. Poiché nel sangue sono presenti vari elettroliti (HC03 , H2CO3 H2RO4 , NRO42 ), proteine, amminoacidi, il che significa che si dissociano a tal punto che l'attività di a (H +) è nell'intervallo indicato. A causa del fatto che il contenuto di sostanze inorganiche e organiche nel plasma e nelle cellule del sangue non è lo stesso, è consigliabile considerare questi componenti del sangue separatamente. plasma del sangue Sistema tampone HCO3 / N2CON3 è costituito da acido carbonico2CON3 e base coniugata HCO3 . Questo è il sistema tampone più importante del sangue. Uno dei componenti è l'acido carbonico H2CON3 - formato dall'interazione di CO disciolto nel plasma2 con acqua: CON2(r) + H2Gallina2CON3. dove CO2(r) - concentrazione di CO disciolta2 . La costante di equilibrio di questa reazione è: K = [N2CON3] / [CO2] Tra CO2 negli alveoli e nel tampone idrogenocarbonato nel plasma sanguigno che scorre attraverso i capillari dei polmoni, si stabilisce una catena di equilibri. Il sistema tampone di carbonato di idrogeno agisce come un tampone fisiologico efficace vicino a pH 7,4. All'ingresso nel sangue degli acidi - i donatori di H+ l'equilibrio nella catena secondo il principio di Le Chatelier si sposta a sinistra per il fatto che gli ioni HCO3 legano gli ioni H nelle molecole H2CON3 . Allo stesso tempo, la concentrazione di H2CON3 aumenta e la concentrazione di ioni HCO3 scende. Aumentando la concentrazione di H2CON3 porta a uno spostamento dell'equilibrio a sinistra, (principio di Le Chatelier). Provoca decadimento2CON3 e un aumento della concentrazione di CO2 disciolto nel plasma. Di conseguenza, l'equilibrio si sposta a sinistra e la pressione di CO aumenta.2 nei polmoni. Eccesso di CO2 espulso dal corpo. Di conseguenza, il sistema idrogeno-carbonato del sangue raggiunge rapidamente l'equilibrio con la CO2 negli alveoli e mantiene efficacemente la costanza del pH del plasma sanguigno. 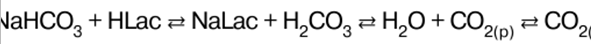 Pertanto, un valore di pH del sangue normale viene mantenuto con uno spostamento del pH leggermente pronunciato a causa dell'acidosi. Negli spazi chiusi, spesso sperimentano soffocamento (mancanza di ossigeno), aumento della respirazione. Tuttavia, il soffocamento è associato non tanto alla mancanza di ossigeno quanto ad un eccesso di CO2. Eccesso di CO2 nell'atmosfera secondo la legge di Henry porta a un'ulteriore dissoluzione di CO2 nel sangue. E questo porta ad una diminuzione del pH del sangue, cioè all'acidosi. Il sistema tampone idrogenocarbonato risponde più rapidamente alle variazioni del pH del sangue. La sua capacità tampone acido è Vк \u40d XNUMX mmol / l di plasma sanguigno e la capacità del tampone per gli alcali è molto inferiore ed è approssimativamente uguale a Vщ = 1-2 mmol/l di plasma sanguigno. 24. Reazioni di neutralizzazione Le reazioni di neutralizzazione sono chiamate reazioni di scambio dell'interazione di acidi e basi, a seguito delle quali si formano sale e acqua. Considera diversi tipi di reazioni di neutralizzazione. 1. Neutralizzazione di una base forte con un acido forte: KOH + HNO3 -NO3 + H2O. L'equazione ionica molecolare per tale reazione H+ + OH → Í2O ed il valore negativo dell'energia di Gibbs ΔG° mostrano che l'equilibrio è praticamente spostato verso la formazione dell'acqua. Un caso comune di una reazione di neutralizzazione è l'interazione di acidi e basi che differiscono per forza (il grado di dissociazione). Queste reazioni non si completano a causa della reazione inversa dell'idrolisi del sale. 2. Neutralizzazione di un acido debole con una base forte:  o in forma molecolare:  In questo caso, la reazione di neutralizzazione è reversibile. Anche la reazione di neutralizzazione di una base debole con un acido forte è reversibile:  o in forma molecolare: 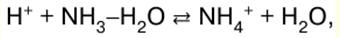 e anche - una base debole con un acido debole: 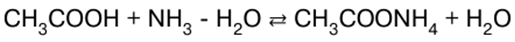 o in forma molecolare:  In questi sistemi, l'equilibrio è fortemente spostato a destra, poiché l'acqua è un elettrolita molto più debole dell'acido cianidrico, dell'ammoniaca e dell'acido acetico. Le reazioni di neutralizzazione costituiscono la base del metodo di neutralizzazione. Questo metodo viene utilizzato nei laboratori clinici per determinare l'acidità del succo gastrico, la capacità tampone del plasma sanguigno. In farmacologia viene utilizzato per l'analisi quantitativa di acidi inorganici (cloridrico, solforico, borico) e organici (acetico, benzoico, tartarico, citrico, salicilico). Negli studi biofarmaceutici, il pKa degli acidi e il pKa delle basi sono determinati dalla neutralizzazione, poiché il valore di questi valori può predire la capacità dei farmaci di passare attraverso le membrane biologiche. La titolazione acido-base viene utilizzata per determinare il pKа amminoacidi e pKа gruppi dissociativi nelle proteine. Le curve di titolazione delle proteine ottenute a due diverse temperature possono essere utilizzate per determinare il numero di carbossile, imidazolo e altri gruppi. La titolazione di amminoacidi e proteine permette di determinarne i punti isoelettrici. L'idrolisi è la decomposizione di una sostanza da parte dell'acqua. I composti chimici di varie classi possono subire idrolisi: proteine, grassi, carboidrati, esteri, sali, ecc. Nella chimica inorganica, si incontrano più spesso con l'idrolisi dei sali. 25. Idrolisi del sale Idrolisi del sale - questa è l'interazione del sale con le molecole d'acqua, che porta alla formazione di composti a bassa dissociazione. Il processo di idrolisi consiste nel passaggio di un protone da una molecola d'acqua a un dato ione (CO32 + HOH * HCO3+ OH ) o da un dato ione, anche da un catione metallico idratato, a una molecola d'acqua. A seconda della natura del sale, l'acqua funge da acido o da base e il sale è, rispettivamente, la base coniugata o l'acido coniugato. Sono possibili quattro varianti di idrolisi a seconda del tipo di sale. 1. Sali formati da un acido forte e da una base debole:  2. Sali formati da una base forte e da un acido debole: CH3COONa + HOH → CH3COOH + NaOH. 3. Sali formati da un acido debole e da una base debole. Il cianuro di ammonio viene idrolizzato dalla reazione: 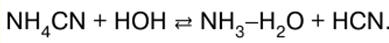 4. Sali formati da un acido forte e da una base forte. NaCl, KNO3 non subiscono idrolisi. Il meccanismo dell'idrolisi del sale consiste nell'interazione di polarizzazione degli ioni di sale con il loro guscio di idratazione. Più forte è questa interazione, più intensa è l'idrolisi. Tutti i casi di idrolisi considerati riguardavano sali formati da basi monoacide e acidi monobasici. I sali degli acidi polibasici e delle basi poliacidi vengono idrolizzati gradualmente, formando sali acidi e basici. Quantitativamente, l'idrolisi come equilibrio di CO è caratterizzata dal grado di idrolisi e dalla costante di idrolisi. Il grado di idrolisi è misurato dal rapporto tra la quantità di sostanza idrolizzata e la quantità totale di soluto. Il grado di idrolisi dipende dalla natura del sale, dalla sua concentrazione e temperatura. Secondo la legge dell'azione di massa, il grado di idrolisi aumenta con la diluizione della soluzione. Quindi, a concentrazione Na2CO3 0,001 mol/l, il grado di idrolisi è del 34%. Nel caso generale, sono vere le seguenti regolarità. 1. L'idrolisi del sale dovrebbe aumentare con l'aumento della temperatura e della diluizione della soluzione. 2. Nell'idrolisi reversibile, secondo il principio di Le Chatelier, il processo dovrebbe essere soppresso per acidificazione (se questo sale è formato da un acido forte e una base debole, gli ioni H si accumulano) o per alcalinizzazione (se il sale è formato da un acido debole e una base forte, si accumulano ioni OH). 3. L'idrolisi dei sali, che porta alla formazione di prodotti scarsamente solubili o gassosi che vengono rimossi dalla sfera di reazione (principio dello spostamento dell'equilibrio), è irreversibile. Ad esempio, l'idrolisi di Pb(SO4)2 procede interamente a causa della formazione di un precipitato di PbO2: Pb(SO4)2 + 2Н2O→PbO2 + 2H2SO4. L'idrolisi è caratteristica di molte classi di composti inorganici e organici. L'idrolisi dei composti inorganici è importante per valutarne la tossicità. L'idrolisi dei composti organici viene utilizzata per ottenere prodotti preziosi da legno, grassi, esteri e altre cose, ma l'idrolisi gioca un ruolo particolarmente importante nella vita degli organismi viventi. 26. Reazione di precipitazione e dissoluzione Le reazioni di scambio che si verificano nella soluzione elettrolitica includono le reazioni di precipitazione e dissoluzione. Le reazioni di precipitazione sono accompagnate da precipitazione. Le reazioni accompagnate dalla dissoluzione dei precipitati sono chiamate reazioni di dissoluzione. Sono ampiamente utilizzati sistemi costituiti da un deposito di un elettrolita scarsamente solubile e da una soluzione satura sopra di esso. In tali sistemi si stabilisce un equilibrio dinamico tra la soluzione satura e il precipitato. A causa della bassa solubilità, la concentrazione dell'elettrolita scarsamente solubile nella soluzione è molto bassa, pertanto si può ritenere che sia completamente dissociato nella soluzione. In altre parole, si stabilisce l'equilibrio dinamico in una soluzione satura tra la fase solida della sostanza e gli ioni che sono passati nella soluzione. Ad esempio, in una soluzione satura di AgCl, si verifica il seguente equilibrio: AgCl(T) → Ag+(P) + Cl(R). La concentrazione della fase solida AgCl come valore costante è esclusa dall'espressione per la costante di equilibrio. Di conseguenza, la costante di equilibrio è determinata solo dal prodotto delle concentrazioni di ioni nella soluzione ed è chiamata costante o prodotto di solubilità. Nel caso generale, per l'elettrolita Ktn Anm, la costante di solubilità è determinata dal prodotto stechiometrico delle concentrazioni ioniche: Кпр= [ktm+ ]n[Unn]m Questo valore caratterizza la solubilità dell'elettrolita a temperatura costante in assenza di sostanze estranee. Costanza Kпр non significa la costanza delle concentrazioni dei singoli ioni in soluzione. Pertanto, è possibile aumentare la concentrazione di ioni Ag in una soluzione satura di AgCl aggiungendo, ad esempio, AgNO3 , mentre l'equilibrio secondo il principio di Le Chatelier si sposterà a sinistra, il che comporterà un aumento della velocità di deposizione di ioni. Dopo qualche tempo, i tassi di dissoluzione di AgCl e la precipitazione degli ioni Ag e Cl diventeranno uguali. L'equilibrio appena stabilito sarà, come prima, caratterizzato dal valore Kпр(AgCl), ma le concentrazioni di equilibrio degli ioni Ag e Cl cambieranno. Quindi, sulla base di Kпр è possibile prevedere la formazione e la dissoluzione dei precipitati elettrolitici sulla base di due regole. 1. Un elettrolita precipita quando il prodotto stechiometrico delle concentrazioni dei suoi ioni in soluzione è maggiore della costante di solubilità. 2. Il precipitato elettrolitico si dissolve quando il prodotto stechiometrico delle concentrazioni dei suoi ioni costituenti in soluzione diventa inferiore alla costante di solubilità. Le reazioni di precipitazione sono la base del metodo di precipitazione, utilizzato nell'analisi quantitativa dei prodotti farmaceutici. Il metodo della precipitazione viene utilizzato nell'analisi clinica dei cloruri nelle urine, nel succo gastrico, nel sangue e nella pratica sanitaria e igienica - nell'analisi dell'acqua potabile. Gli scienziati ritengono che la diversa solubilità dei composti naturali degli elementi nell'acqua abbia avuto una grande influenza sul loro contenuto negli organismi viventi. Esiste una stretta relazione tra la solubilità dei composti nell'acqua e l'effetto tossico degli ioni di un numero di elementi. Ad esempio, l'introduzione di Al3 + nel corpo a causa della formazione di fosfato di alluminio scarsamente solubile AlPO4 27. Reazioni redox Uno dei concetti base della chimica inorganica è il concetto di stato di ossidazione (CO). Lo stato di ossidazione di un elemento in un composto è la carica formale dell'atomo dell'elemento, calcolata partendo dal presupposto che gli elettroni di valenza passino ad atomi con un'elettronegatività relativa maggiore (REO) e che tutti i legami nella molecola del composto siano ionici. Lo stato di ossidazione dell'elemento E è indicato nella parte superiore del simbolo dell'elemento con un segno “+” o “-” prima del numero. Lo stato di ossidazione degli ioni realmente esistenti in soluzione o nei cristalli coincide con il loro numero di carica ed è indicato analogamente con un segno “+” o “-” dopo il numero, ad esempio Cl,Circa2+. Il metodo Stock viene utilizzato anche per indicare il grado di ossidazione in numeri romani dopo il simbolo dell'elemento: Mn (VII), Fe (III). La questione del segno dello stato di ossidazione degli atomi in una molecola viene risolta sulla base del confronto delle elettronegatività degli atomi interconnessi che formano la molecola. In questo caso, un atomo con elettronegatività inferiore ha uno stato di ossidazione positivo, mentre un atomo con elettronegatività maggiore ha uno stato di ossidazione negativo. È bene precisare che lo stato di ossidazione non può essere identificato con la valenza di un elemento. La valenza, definita come il numero di legami chimici mediante i quali un dato atomo è collegato ad altri atomi, non può essere uguale a zero e non ha segno “+” o “-”. Lo stato di ossidazione può avere sia valore positivo che negativo, e può assumere anche valore zero o addirittura frazionario. Quindi, in una molecola di CO2 lo stato di ossidazione di C è +4 e nella molecola CH4 lo stato di ossidazione di C è 4. La valenza di carbonio4 a in entrambi i composti è IV. Nonostante gli svantaggi di cui sopra, l'uso del concetto di grado di ossidazione è conveniente nella classificazione dei composti chimici e nella formulazione di equazioni per le reazioni redox. Quando un elemento viene ossidato, lo stato di ossidazione aumenta, in altre parole, l'agente riducente durante la reazione aumenta lo stato di ossidazione. Al contrario, quando l'elemento si riduce, lo stato di ossidazione diminuisce, cioè durante la reazione l'agente ossidante riduce lo stato di ossidazione. Pertanto, è possibile dare la seguente formulazione di reazioni redox: le reazioni redox sono reazioni che si verificano con un cambiamento dello stato di ossidazione degli atomi degli elementi che compongono le sostanze reagenti. 28. Agenti ossidanti e riducenti Per prevedere i prodotti e la direzione delle reazioni redox, è utile ricordare che gli agenti ossidanti tipici sono sostanze semplici i cui atomi hanno un EER elevato> 3,0 (elementi dei gruppi VIA e VIIA). Di questi, gli agenti ossidanti più potenti sono il fluoro (OEO = 4,0), l'ossigeno (OEO = 3,0), il cloro (OEO = 3,5). Importanti ossidanti includono PbO2 , KMnO4 , Ca(SO4)2 , K2Cr2O7 , HClO, HClO3, KSIO4, NaBio3, H2SO4(fine), H.N.O.3(fine) , N / A2O2 , (N4)2S2O8 , KSIO3 , H2O2 e altre sostanze che contengono atomi di CO superiori o superiori. Tipici agenti riducenti includono sostanze semplici i cui atomi hanno un EER piccolo < 1,5 (metalli dei gruppi IA e IIA e alcuni altri metalli). Importanti agenti riducenti includono H2S, NH3, CIAO, KI, SnCl2 , FeSO4 ,C,H2 , CO, H2SO3 , cre2(SO4)3 , CuCl, Na2S2O3 e altre sostanze che contengono atomi di CO a basso contenuto di CO. Le sostanze contenenti atomi negli stati di ossidazione massimo e minimo, rispettivamente, possono essere solo agenti ossidanti, ad esempio K2sg2O7 , KMPO4 , PbO2 , HClO4 o solo agenti riducenti, come NH3 , H2S, CIAO. Le sostanze contenenti atomi in stati di ossidazione intermedi sono in grado sia di aumentare che di abbassare lo stato di ossidazione, cioè possono essere sia agenti riducenti (sotto l'azione di un agente ossidante più attivo di loro) che agenti ossidanti (sotto l'azione di un agente più attivo di loro, agente riducente). Tali sostanze mostrano dualità redox. Quando si compilano equazioni per le reazioni redox, è possibile utilizzare due metodi: il metodo del bilancio elettronico e il metodo ionico-elettronico (metodo della semireazione). Un'idea più corretta dei processi redox nelle soluzioni è fornita dal metodo ionico-elettronico. Utilizzando questo metodo, i cambiamenti effettivamente esistenti in una soluzione vengono previsti da ioni e molecole. Oltre a prevedere i prodotti di reazione, le equazioni di semireazione ionica sono necessarie per comprendere i processi redox che si verificano durante l'elettrolisi e nelle cellule galvaniche. Questo metodo riflette il ruolo dell'ambiente come partecipante al processo. E infine, quando si utilizza questo metodo, non è necessario conoscere in anticipo tutte le sostanze formate, poiché molte di esse si ottengono compilando l'equazione delle reazioni redox. Va tenuto presente che, sebbene le semireazioni riflettano i processi reali che si verificano durante le reazioni redox, non possono essere identificate con gli stadi reali (meccanismo) delle reazioni redox. Molti fattori influenzano la natura e la direzione delle reazioni redox: la natura dei reagenti, la reazione del mezzo, la concentrazione, la temperatura ei catalizzatori. Va tenuto presente che un valore negativo non porta sempre a una decisione univoca sull'andamento effettivo della reazione in una determinata direzione, poiché è inoltre necessario tenere conto del fattore cinetico. 29. Significato biologico dei processi redox Le reazioni redox sono processi chimici accompagnati dal trasferimento di elettroni da una molecola o ione a un altro. Nelle reazioni redox si verificano due processi correlati: ossidazione e riduzione. L'ossidazione è il processo di perdita di elettroni. Il recupero è il processo di aggiunta di elettroni. Le sostanze i cui atomi o ioni donano elettroni sono chiamate agenti riducenti. Le sostanze i cui atomi o ioni aggiungono elettroni (o attirano a se stessi una coppia comune di elettroni) sono chiamate agenti ossidanti. Nella reazione dello zinco con CuSO4 Cu2 + aggiungi elettroni: se stessi2+ + 2e־ - Si0 . Gli atomi di zinco donano elettroni: Zn0 -Zn2 + 2e־. Di conseguenza, CuSO4 - agente ossidante, Zn - agente riducente. Processi importanti negli organismi animali sono reazioni di ossidazione enzimatica delle sostanze substrato: carboidrati, grassi, amminoacidi. Come risultato di questi processi, gli organismi ricevono grandi quantità di energia. Circa il 90% dell'intero fabbisogno energetico di un maschio adulto è soddisfatto dall'energia prodotta nei tessuti dall'ossidazione dei carboidrati e dei grassi. Il resto dell'energia - circa il 10% - proviene dalla degradazione ossidativa degli aminoacidi. L'ossidazione biologica procede attraverso meccanismi complessi con la partecipazione di un gran numero di enzimi. Nei mitocondri, l'ossidazione si verifica come risultato del trasferimento di elettroni da substrati organici. Come trasportatori di elettroni, la catena respiratoria dei mitocondri comprende varie proteine contenenti vari gruppi funzionali progettati per trasportare elettroni. Mentre si spostano lungo la catena da un intermedio all'altro, gli elettroni perdono la loro energia libera. Per ogni coppia di elettroni trasferiti attraverso la catena respiratoria all'ossigeno, vengono sintetizzate 3 molecole di ATP. L'energia libera rilasciata durante il trasferimento di 2 elettroni all'ossigeno è di 220 kJ/mol. La sintesi di 1 molecola di ATP in condizioni standard consuma 30,5 kJ. Da ciò risulta chiaro che una parte abbastanza significativa dell'energia libera rilasciata durante il trasferimento di una coppia di elettroni viene immagazzinata nelle molecole di ATP. Da questi dati, diventa chiaro anche il ruolo del trasferimento di elettroni multistadio dall'agente riducente iniziale all'ossigeno. La grande energia (220 kJ) rilasciata durante il trasferimento di una coppia di elettroni all'ossigeno viene suddivisa in un numero di porzioni corrispondenti ai singoli stadi di ossidazione. In tre di questi stadi, la quantità di energia rilasciata corrisponde approssimativamente all'energia richiesta per la sintesi di 1 molecola di ATP. Le reazioni redox sono la base dei metodi ossidimetrici, che vengono utilizzati nell'analisi clinica per determinare gli ioni Ca, l'acido urico, gli enzimi catalasi e perossidasi, lo zucchero nel sangue e nelle analisi sanitarie e igieniche - per determinare l'ossidabilità dell'acqua, il contenuto di cloro attivo nella candeggina, cloro residuo nell'acqua potabile domestica 30. Legame chimico e sue caratteristiche sperimentali Lo sviluppo di un moderno modello atomico e la previsione delle proprietà dei singoli atomi sulla sua base è un risultato molto importante della meccanica quantistica. Tuttavia, gli atomi isolati si trovano raramente in condizioni terrestri. I corpi della natura inanimata e vivente che ci circondano sono costituiti da una varietà di molecole. A. M. Butlerov (1828-1886) ha creato la teoria della struttura chimica delle sostanze organiche (1861). Da quel momento, i concetti di "valenza" e "legame chimico" iniziarono gradualmente ad entrare nella chimica. La valenza è la capacità di un atomo di legare un certo numero di altri atomi per formare una molecola. La valenza è indicata da trattini accanto al simbolo dell'elemento. L'idrogeno (H) è monovalente, l'ossigeno (0=) è bivalente. Il numero di barre di valenza determina il numero di legami chimici che un dato atomo può formare con altri atomi. Un legame chimico è un insieme di interazioni tra elettroni e nuclei, che portano alla combinazione di atomi in una molecola. Le proprietà di un legame chimico sono studiate con vari metodi. Con l'aiuto di metodi chimici, viene determinato il numero di legami degli atomi (valenza) e la loro reattività. Utilizzando metodi fisici, vengono determinate la lunghezza, la forza, l'orientamento e la polarità dei legami chimici. Lunghezza del legame chimico rс detto valore misurato dalla distanza tra i nuclei degli atomi legati. Come unità di lunghezza del legame chimico gс picometro comodo da usare (pm): 1:10 = XNUMX12 m Forza di adesione chimica Eс - valore misurato dall'entalpia ΔЕс formazione della connessione. Come unità di forza del legame chimico Eс Viene utilizzato kJ/mol. Orientamento del legame chimico aс - il valore misurato dall'angolo tra le direzioni dei legami di un dato atomo con atomi vicini della molecola. L'angolo ac è detto angolo di valenza. Unità angolo di legame aс - livello. Polarità del legame chimico μс - il valore misurato dal momento elettrico di questo collegamento. Il momento elettrico per due cariche elettriche +q e ־q, uguali in valore assoluto e opposte in segno, è pari a μ = qr, dove r è la distanza tra le cariche. Queste due cariche formano un dipolo elettrico. Un legame chimico è polarizzato quando 2 atomi di diversa elettronegatività (EOE) si legano. Di conseguenza, un eccesso di carica negativa δ appare su un atomo con un valore OEO elevato e un eccesso di carica positiva +δ appare su un altro atomo con un valore OEO inferiore. La polarità della connessione si calcola utilizzando la formula: μс = δrс. È conveniente utilizzare l'unità Debye non sistemica (D) come unità per misurare la polarità di un legame chimico - 1 D = 3,3 x 1030 C/m. La polarità del legame OH in una molecola d'acqua è μegli = 1,5 D. Lo studio del legame chimico ha mostrato che nella maggior parte dei casi la lunghezza, la forza, l'orientamento, la polarità dello stesso legame chimico in diversi composti hanno approssimativamente gli stessi valori. Ne consegue che le interazioni che portano alla formazione di un dato legame tra atomi sono della stessa natura in molecole diverse. Le teorie quantomeccaniche del legame chimico forniscono una spiegazione per questo fatto. 31. Legame idrogeno. Legame idrogeno intermolecolare e intramolecolare I legami chimici nelle molecole sono generalmente molto forti, la loro energia è compresa tra 100 e 150 kJ/mol. Inoltre, esistono i cosiddetti legami idrogeno, la cui forza è di 10-40 kJ/mol. La lunghezza di queste obbligazioni è rispettivamente di 270-230 pm. Legame idrogeno tra atomi EА ed EВ detta interazione compiuta da un atomo di idrogeno connesso a EА o EВ legame chimico. L'immagine di un legame idrogeno nel caso generale ha la forma: ЭА-N...Eв.. Ovviamente il legame idrogeno è tricentrico, poiché 3 atomi prendono parte alla sua formazione. Per il verificarsi di un tale legame, è necessario che gli atomi EА ed EВ hanno un'elevata elettronegatività. Questi sono gli atomi degli elementi più negativi: azoto (REO = 3,0), ossigeno (REO = 3,5), fluoro (REO = 4,0) e cloro (REO = 3,0). Un legame idrogeno si forma come risultato di una combinazione di idrogeno ls-AO e due atomi di 2pAO EА ed EВ; 2rorbitali sono orientati lungo una linea retta. Pertanto, il legame idrogeno è lineare. Il legame idrogeno si chiama: 1) intramolecolare, se gli atomi EА ed EВ , legati da questo legame, appartengono alla stessa molecola; 2) intermolecolare, se gli atomi EА ed EВ sono in diverse molecole. I legami idrogeno intramolecolari svolgono un ruolo biologico vitale, poiché determinano, ad esempio, la struttura elicoidale delle molecole proteiche polimeriche. Nelle proteine, questi sono legami N-H...O tra residui di amminoacidi. I legami idrogeno intermolecolari non sono meno importanti. Con il loro aiuto, le catene di acidi nucleici sono collegate per formare una doppia elica. Esistono due tipi di legami tra le basi nucleiche: NHN e N-H-O. L'energia cinetica media del moto termico delle molecole è dell'ordine di 3/2RT. Ad una temperatura corporea di 37°C (310°K), questo è di circa 4 kJ/mol. La forza dei legami idrogeno è compresa tra 10 e 40 kJ / mol, quindi sono abbastanza forti da resistere agli impatti costanti delle molecole circostanti e garantire la costanza della forma delle strutture biologiche polimeriche. Allo stesso tempo, durante gli impatti delle molecole attive, i legami idrogeno vengono periodicamente rotti, quindi ripristinati nuovamente, garantendo il flusso di vari processi vitali. Gli esempi considerati illustrano chiaramente una gamma più ampia di applicazioni del metodo MO LCAO rispetto al metodo VS. Tuttavia, il metodo VS può essere utilizzato con successo per prevedere le proprietà e la struttura di molte sostanze, compresi i composti complessi. 32. Macro e microelementi nell'ambiente e nel corpo umano Esistono varie classificazioni degli elementi chimici contenuti nel corpo umano. Quindi, V. I. Vernadsky, a seconda del contenuto medio (frazione di massa w, %) negli organismi viventi, ha diviso gli elementi secondo il sistema di dieci giorni. Secondo questa classificazione, gli elementi contenuti negli organismi viventi sono divisi in tre gruppi: macro, micro e ultramicroelementi. macronutrienti Questi sono elementi il cui contenuto nel corpo è superiore a 102%. Questi includono ossigeno, carbonio, idrogeno, azoto, fosforo, zolfo, calcio, magnesio, sodio e cloro. Elementi di traccia Questi sono elementi il cui contenuto nel corpo è nell'intervallo 103 a 105%. Questi includono iodio, rame, arsenico, fluoro, bromo, stronzio, bario, cobalto. Ultramicroelementi Questi sono elementi il cui contenuto nel corpo è inferiore a 105%. Questi includono mercurio, oro, uranio, torio, radio, ecc. Attualmente, gli ultramicroelementi sono combinati con i microelementi in un gruppo. Questa classificazione riflette solo il contenuto degli elementi negli organismi viventi, ma non indica il ruolo biologico e il significato fisiologico di questo o quell'elemento. V. V. Kovalsky, in base alla loro importanza per la vita, ha diviso gli elementi chimici in tre gruppi. Elementi vitali (insostituibili). Sono costantemente contenuti nel corpo umano, fanno parte di enzimi, ormoni e vitamine: H, O, Ca, N, K, P, Na, S, Mg, d, C, I, Mn, Cu, Co, Fe, Zn, Mo, V. La loro carenza porta all'interruzione della normale vita umana. elementi di impurità Questi elementi si trovano costantemente nel corpo degli animali e dell'uomo: Ga, Sb, Sr, Br, F, B, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. Il loro ruolo biologico è poco compreso o sconosciuto. elementi di impurità Sc, Tl, In, La, Pr, Sm, W, Re, Tb, ecc. Trovato nell'uomo e negli animali. I dati sul numero e sul ruolo biologico non sono stati ancora chiariti. Gli elementi necessari per la costruzione e l'attività vitale di varie cellule e organismi sono chiamati elementi biogenici. È ancora impossibile elencare con precisione tutti gli elementi biogenici a causa della difficoltà di determinare concentrazioni molto basse di oligoelementi e stabilirne le funzioni biologiche. Per 24 elementi, la biogenicità è stata stabilita in modo affidabile. Questi sono elementi del primo e alcuni elementi del secondo gruppo (secondo Kowalski). 33. Topografia dei più importanti elementi biogenici nel corpo umano Gli organi umani concentrano in modo diverso vari elementi chimici in se stessi, ad es. micro e macro elementi sono distribuiti in modo non uniforme tra diversi organi e tessuti. La maggior parte degli oligoelementi si accumula nel fegato, nelle ossa e nei tessuti muscolari. Questi tessuti sono i principali depositi (depositi) di molti oligoelementi. Gli elementi possono mostrare un'affinità specifica per determinati organi ed essere contenuti in essi in elevate concentrazioni. È noto che lo zinco si concentra nel pancreas, lo iodio nella ghiandola tiroidea, il fluoro nello smalto dei denti, l'alluminio, l'arsenico, il vanadio si accumulano nei capelli e nelle unghie, il cadmio, il mercurio, il molibdeno nei reni, lo stagno nell'intestino. tessuti, stronzio - nella ghiandola prostatica, tessuto osseo, bario - nel pigmento della retina, bromo, manganese, cromo - nella ghiandola pituitaria, ecc. Negli organismi, i microelementi possono trovarsi allo stato legato e sotto forma di forme ioniche libere. È noto che il silicio, l'alluminio, il rame e il titanio nel tessuto cerebrale si presentano sotto forma di complessi con proteine, mentre il manganese è in forma ionica. Idrogeno e ossigeno sono macroelementi. Fanno parte dell'acqua, che in media ne contiene circa il 65% nel corpo umano adulto. L’acqua è distribuita in modo non uniforme negli organi, nei tessuti e nei fluidi biologici umani. Pertanto, nel succo gastrico, nella saliva, nel plasma sanguigno, nella linfa, l'acqua costituisce dall'89,5 al 90%, nelle urine, nella materia grigia del cervello, nei reni - 80%, nella sostanza bianca del cervello, nel fegato, nella pelle, nel midollo spinale , muscoli, polmoni, cuore - 70-80%. Meno di tutto - il 40% di acqua - è contenuta nello scheletro. I macroelementi - carbonio, idrogeno, ossigeno, azoto, zolfo, fosforo - fanno parte di proteine, acidi nucleici e altri composti biologicamente attivi del corpo. Il contenuto di carbonio nelle proteine è del 51-55%, ossigeno - 22-24%, azoto - 15-18%, idrogeno - 6,5-7%, zolfo - 0,3-2,5%, fosforo - circa 0,5%. Anche il carbonio, l'idrogeno e l'ossigeno sono inclusi nella composizione dei carboidrati, il cui contenuto nei tessuti animali è piccolo - circa il 2%. Questi elementi fanno parte dei lipidi (grassi). Inoltre, i fosfolipidi contengono fosforo sotto forma di gruppi fosfato. I lipidi sono concentrati maggiormente nel cervello (12%), poi nel fegato (5%), nel latte (2-3%) e nel siero sanguigno (0,6%). Tuttavia, la maggior parte del fosforo (600 g) è contenuta nel tessuto osseo. Ciò rappresenta l'85% della massa di tutto il fosforo presente nel corpo umano. Il fosforo è concentrato anche nei tessuti duri dei denti, nei quali è compreso insieme a calcio, cloro, fluoro sotto forma di idrossile, cloro, fluorapatiti della formula generale Ca5 (PO4)3X, dove X = OH, CI, F, rispettivamente. Il calcio è concentrato prevalentemente nelle ossa e anche nei tessuti dentali. Il sodio e il cloro si trovano principalmente nei liquidi extracellulari, mentre il potassio e il magnesio si trovano principalmente nei liquidi intracellulari. Sotto forma di fluoruri, sodio e potassio fanno parte dei tessuti ossei e dentali. Magnesio come fosfato di Mg3 (PO4)2 contenuto nei tessuti duri del dente. Gli ormoni sono coinvolti nel mantenimento di un certo contenuto di macro e microelementi nel corpo. 34. Il ruolo biologico degli elementi chimici nel corpo Il ruolo biologico degli elementi chimici nel corpo umano è estremamente vario. La funzione principale dei macronutrienti è quella di costruire tessuti, mantenere una pressione osmotica costante, una composizione ionica e acido-base. I microelementi, facenti parte di enzimi, ormoni, vitamine, sostanze biologicamente attive come agenti complessanti o attivatori, sono coinvolti nel metabolismo, nei processi di riproduzione, nella respirazione dei tessuti e nella neutralizzazione delle sostanze tossiche. I microelementi influenzano attivamente i processi di emopoiesi, ossidazione, riduzione, permeabilità dei vasi sanguigni e dei tessuti. Macro e microelementi - calcio, fosforo, fluoro, iodio, alluminio, silicio - determinano la formazione delle ossa e dei tessuti dentali. Sono state identificate molte malattie associate alla carenza o all'accumulo eccessivo di vari microelementi. La carenza di fluoro provoca la carie dentale, la carenza di iodio provoca il gozzo endemico e l’eccesso di molibdeno provoca la gotta endemica. Questi tipi di modelli sono associati al fatto che il corpo umano mantiene un equilibrio di concentrazioni ottimali di elementi biogenici: l'omeostasi chimica. La violazione di questo equilibrio dovuta a carenza o eccesso dell'elemento può portare a varie malattie. Oltre ai sei principali macroelementi - organogeni (carbonio, idrogeno, azoto, ossigeno, zolfo e fosforo), che costituiscono carboidrati, grassi, proteine e acidi nucleici, per la normale alimentazione di esseri umani e animali sono necessari macroelementi inorganici: calcio, cloro , magnesio, potassio, sodio - e oligoelementi - rame, fluoro, iodio, ferro, molibdeno, zinco e anche, possibilmente (provato sugli animali), selenio, arsenico, cromo, nichel, silicio, stagno, vanadio. L'analisi del contenuto e del rapporto dei microelementi nel corpo umano viene utilizzata anche nell'esame medico legale. Ad esempio, in caso di avvelenamento da alcol, sotto l'influenza dell'alcol etilico, il contenuto di calcio nel fegato aumenta e il sodio e il potassio diminuiscono. Allo stesso tempo, nel cuore e nei reni, al contrario, il contenuto di calcio diminuisce. La mancanza di elementi come ferro, rame, fluoro, zinco, iodio, calcio, fosforo, magnesio e alcuni altri nella dieta porta a gravi conseguenze per la salute umana. Tuttavia, va ricordato che non solo una carenza, ma anche un eccesso di elementi biogenici è dannoso per l'organismo, poiché ciò interrompe l'omeostasi chimica. I componenti minerali, che sono vitali in quantità trascurabili, diventano tossici a concentrazioni più elevate. Un certo numero di elementi (argento, mercurio, piombo, cadmio, ecc.) Sono considerati tossici, poiché il loro ingresso nel corpo, anche in tracce, porta a gravi fenomeni patologici. Vari elementi e loro composti sono ampiamente usati come medicinali. Pertanto, lo studio del ruolo biologico degli elementi chimici, la delucidazione della relazione tra lo scambio di questi elementi e altre sostanze biologicamente attive (enzimi, ormoni, vitamine) contribuisce alla creazione di nuovi farmaci e allo sviluppo di regimi posologici ottimali per finalità sia terapeutiche che profilattiche. 35. Elementi S e loro composti L’acqua è uno dei composti dell’idrogeno più importanti e diffusi sulla Terra. Lo spazio acquatico occupa quasi il 75% della superficie terrestre. Il corpo di un adulto contiene in media il 65-67% di acqua, un feto (4 mesi) - 94% e un neonato - 74%. Tutte le reazioni chimiche nel corpo si verificano solo nell'ambiente acquatico. La vita senza acqua è impossibile. L'acqua distillata è una preparazione farmacopea. Nella pratica medica viene utilizzato un altro composto di idrogeno: il perossido di idrogeno H2 02. Questo composto è un importante sottoprodotto del metabolismo. Il perossido di idrogeno è un liquido incolore e trasparente. Provoca bruciore a contatto con la pelle e le mucose. Molecola H2О2 polare. La presenza di coppie solitarie di elettroni sugli atomi di ossigeno consente di formare legami donatore-accettore di perossido di idrogeno con ligandi - accettori di elettroni. Lo stato di ossidazione dell'ossigeno in H2О2 è uguale a 1, cioè ha un valore intermedio tra lo stato di ossidazione dell'ossigeno nell'acqua (2) e nell'ossigeno elementare O2 . Ne consegue che il perossido di idrogeno può presentare sia le proprietà di un agente ossidante che le proprietà di un agente riducente (dualità redox). Tuttavia, a giudicare dai potenziali di semireazione redox standard, il perossido di idrogeno è più caratterizzato da proprietà ossidanti. Il perossido di idrogeno puro è termodinamicamente instabile e, stando in piedi, si decompone in modo esplosivo in acqua e ossigeno, rilasciando una grande quantità di calore. Le soluzioni acquose di perossido di idrogeno sono più stabili, in un luogo fresco possono essere conservate a lungo. Il perossido di idrogeno viene solitamente venduto sotto forma di una soluzione acquosa al 30% - peridrolo. Il coprocesso di decomposizione del perossido di idrogeno è notevolmente accelerato in presenza di sali di metalli pesanti. La decomposizione del perossido di idrogeno catalizzata da ioni metallici può portare alla formazione di radicali, i più importanti dei quali sono l'idrossido HXNUMXO e l'idroperossido. La tossicità è dovuta al fatto che2О2 e O2 interagiscono con lo strato lipidico delle membrane cellulari e le danneggiano. Nella pratica medica, il perossido di idrogeno viene utilizzato principalmente come agente battericida esterno. Azione H2О2 basato sulla capacità ossidante del perossido di idrogeno e sull'innocuità del suo prodotto di riduzione: l'acqua. Nel trattamento delle ferite, l'ossigeno rilasciato svolge un duplice ruolo: 1) ha un effetto antimicrobico, deodorante e depigmentante, uccidendo i corpi microbici; 2) forma schiuma, contribuendo alla transizione delle particelle di decadimento dei tessuti in uno stato sospeso e alla pulizia delle ferite. Come preparazione farmacopea viene utilizzata una soluzione acquosa al 3% di perossido di idrogeno, una soluzione al 6% di perossido di idrogeno viene utilizzata per decolorare i capelli. Sotto forma di una soluzione al 30%, il perossido di idrogeno viene utilizzato nel trattamento della forma verrucosa del lichen planus e per rimuovere le verruche giovanili. 36. Il ruolo biologico degli elementi s del gruppo IA (litio, rubidio, cesio, francio) In termini di contenuto nel corpo umano, sodio (0,08%) e potassio (0,23%) sono macroelementi e i restanti metalli alcalini sono litio (104%), rubidio (105%), cesio (104%) - per tracciare elementi. litio Il contenuto di litio nel corpo umano è di circa 70 mg (10 mmol) - 104%. I composti del litio negli animali superiori sono concentrati nel fegato, nei reni, nella milza, nei polmoni, nel sangue e nel latte. La quantità massima di litio si trova nei muscoli umani. Il ruolo biologico del litio come oligoelemento non è stato ancora completamente chiarito. È stato dimostrato che a livello delle membrane cellulari, gli ioni Li (a una concentrazione sufficiente) competono con gli ioni sodio quando penetrano nelle cellule. Ovviamente, la sostituzione degli ioni Na nelle cellule con ioni Li è associata ad una maggiore covalenza dei composti del litio, per cui si dissolvono meglio nei fosfolipidi. È stato stabilito che alcuni composti di litio hanno un effetto positivo sui pazienti con depressione maniacale. Assorbiti dal tratto gastrointestinale, gli ioni Li si accumulano nel sangue. Quando la concentrazione di ioni Li raggiunge 0,6 mmol / le oltre, c'è una diminuzione della tensione emotiva e un indebolimento dell'eccitazione maniacale. Allo stesso tempo, il contenuto di ioni Li nel plasma sanguigno deve essere rigorosamente controllato. Nei casi in cui la concentrazione di ioni Li supera 1,6 mmol/l, sono possibili fenomeni negativi. rubidio e cesio Secondo il contenuto di rubidio nel corpo umano (105%) e cesio (104%) appartengono agli oligoelementi. Sono costantemente contenuti nel corpo, ma il loro ruolo biologico non è stato ancora chiarito. Essendo un analogo completo del potassio, il rubidio si accumula anche nel liquido intracellulare e può sostituire una quantità equivalente di potassio in vari processi. isotopi radioattivi 13rC e 87Rb è utilizzato nella radioterapia dei tumori maligni, nonché nello studio del metabolismo del potassio. A causa della loro rapida rottura, possono anche essere introdotti nel corpo senza timore di effetti dannosi a lungo termine. Francia Questo è un elemento chimico radioattivo ottenuto con mezzi artificiali. Ci sono prove che il francio possa accumularsi selettivamente nei tumori nelle prime fasi del loro sviluppo. Queste osservazioni possono essere utili nella diagnosi del cancro. Pertanto, degli elementi del gruppo IA, Li, Rb, Cs sono fisiologicamente attivi e Na e K sono vitali. La somiglianza delle proprietà fisico-chimiche di Li e Na, dovuta alla somiglianza della struttura elettronica dei loro atomi, si manifesta anche nell'azione biologica dei cationi (accumulo nel fluido extracellulare, intercambiabilità). Una natura simile dell'azione biologica dei cationi di elementi di lunghi periodi - K+, Rb+, Cs+ (accumulo nel fluido intracellulare, intercambiabilità) è dovuto anche alla somiglianza della loro struttura elettronica e delle proprietà fisico-chimiche. Questa è la base per l'uso di preparati di sodio e potassio in caso di avvelenamento con sali di litio e rubidio. 37. Il ruolo biologico degli elementi s del gruppo IA (sodio, potassio) Il contenuto di sodio nel corpo umano di 70 kg è di circa 60 g (2610 mmol) - 0,08%. Di questa quantità, il 44% del sodio si trova nel liquido extracellulare e il 9% nel liquido intracellulare. La quantità rimanente di sodio si trova nel tessuto osseo, che è il sito di deposizione degli ioni Na nel corpo. Circa il 40% del sodio contenuto nel tessuto osseo è coinvolto nei processi metabolici e, grazie a ciò, lo scheletro è un donatore o un accettore di ioni Na, il che aiuta a mantenere una concentrazione costante di ioni Na nel fluido extracellulare. Il sodio è il principale ione extracellulare. Nel corpo umano il sodio si trova sotto forma di sali solubili, principalmente cloruro, fosfato e carbonato acido. Il sodio è distribuito in tutto il corpo: nel siero del sangue, nel liquido cerebrospinale, nel liquido oculare, nei succhi digestivi, nella bile, nei reni, nella pelle, nel tessuto osseo, nei polmoni, nel cervello. Gli ioni Na svolgono un ruolo importante nel garantire la costanza dell'ambiente interno del corpo umano, sono coinvolti nel mantenimento di una pressione osmotica costante del biofluido (omeostasi osmotica). Gli ioni Na sono coinvolti nella regolazione del metabolismo dell'acqua e influenzano il funzionamento degli enzimi. Insieme agli ioni K, Mg, Ca, Cl, lo ione Na è coinvolto nella trasmissione degli impulsi nervosi e mantiene la normale eccitabilità delle cellule muscolari. Quando il contenuto di sodio nel corpo cambia, si verificano disfunzioni del sistema nervoso, cardiovascolare e di altro tipo, della muscolatura liscia e scheletrica. Il cloruro di sodio NaCl è la principale fonte di acido cloridrico per il succo gastrico. Il sodio entra nel corpo umano principalmente sotto forma di sale da cucina. Il vero fabbisogno giornaliero di sodio dell'organismo è di 1 g, sebbene l'assunzione media di questo elemento raggiunga 4-7 g L'assunzione eccessiva continua di NaCl contribuisce all'ipertensione. Quando le cellule microbiche sono esposte agli alcali, si verifica la precipitazione delle proteine cellulari e, di conseguenza, la morte dei microrganismi. Solfato di sodio (sale di Glauber) Na2SO4 × 10 ore2O è usato come lassativo. Sodio tetraborato Na2B4О7 × 10 ore2O è usato esternamente come antisettico per risciacquo, lavaggio, lubrificazione. L'idrossido di sodio sotto forma di una soluzione al 10% fa parte del silicio utilizzato nella pratica ortopedica per la colata di modelli refrattari nella produzione di protesi fuse da una lega di cobalto-cromo. Il contenuto di potassio nel corpo umano di 70 kg è di circa 160 g (4090 mmol) - 0,23%. Il potassio è il principale catione intracellulare e rappresenta i 2/3 del totale dei cationi cellulari attivi. Della quantità totale di potassio contenuta nel corpo, il 98% si trova all'interno delle cellule e solo il 2% circa nel liquido extracellulare. Il potassio è distribuito in tutto il corpo. La sua topografia: fegato, reni, cuore, tessuto osseo, muscoli, sangue, cervello, ecc. Gli ioni K svolgono un ruolo importante nei processi fisiologici: contrazione muscolare, normale funzionamento del cuore, conduzione degli impulsi nervosi, reazioni metaboliche. Gli ioni K sono importanti attivatori di enzimi situati all'interno della cellula. 38. Ruolo biologico degli elementi-s del gruppo IIA. Il loro uso in medicina (berillio, magnesio, calcio) Il berillio si trova nelle piante e negli organismi animali. Il contenuto di berillio negli organismi viventi è del 107%, ovvero è un ultramicroelemento di impurità. Il ruolo biologico del berillio non è stato studiato a sufficienza. I composti del berillio sono tossici e causano numerose malattie (rachitismo da berillio, berilliosi, ecc.). I composti volatili del berillio sono particolarmente tossici. L'effetto negativo di Be2 + sui processi fisiologici è spiegato dalle sue proprietà chimiche. Il magnesio è formalmente classificato come macronutriente. Il suo contenuto totale nel corpo è dello 0,027% (circa 20 g). La topografia del magnesio nel corpo umano è la seguente: il magnesio è concentrato maggiormente nella dentina e nello smalto dei denti e nel tessuto osseo. Si accumula anche nel pancreas, nei muscoli scheletrici, nei reni, nel cervello, nel fegato e nel cuore. In un adulto il fabbisogno giornaliero di magnesio è di circa 0,7 g. Lo ione Mg, come lo ione K, è un catione intracellulare. Nei fluidi e nei tessuti biologici del corpo, il magnesio si trova sia sotto forma di ione acquoso che in uno stato legato alle proteine in una quantità < 102%, ovvero, in sostanza, è un microelemento. La concentrazione di ioni Mg all'interno delle cellule è circa 2,5-3 volte superiore rispetto ai fluidi extracellulari. Gli ioni di magnesio svolgono un ruolo biologico importante nel corpo umano. A causa del raggio ionico più piccolo e della maggiore energia di ionizzazione del Mg2+ forma legami più forti dello ione Ca ed è quindi un catalizzatore più attivo per i processi enzimatici. Essendo parte di vari sistemi enzimatici, lo ione Mg è il loro componente essenziale e attivatore (enzimi come carbossipeptidasi, colinesterasi e alcuni altri sono specifici dello ione Mg). L'idrolisi dell'ATP, associata a una serie di reazioni enzimatiche, a seguito delle quali si forma l'idrofosfatione HPO2 e viene rilasciata una grande quantità di energia, avviene con un eccesso di Mg2+. Il calcio è un macronutriente. Il suo contenuto totale nel corpo è dell'1,4%. Il calcio si trova in ogni cellula del corpo umano. La maggior parte del calcio si trova nelle ossa e nei tessuti dentali. In media, un adulto dovrebbe consumare 1 g di calcio al giorno, sebbene il fabbisogno di calcio sia di soli 0,5 g Il calcio somministrato con il cibo viene assorbito solo per il 50% nell'intestino. Un assorbimento relativamente scarso è una conseguenza della formazione nel tratto gastrointestinale di fosfato di calcio scarsamente solubile Ca3(PO4)2 e sali di calcio degli acidi grassi. Nel corpo, la concentrazione di ioni Ca è regolata dagli ormoni. Nelle ossa e nei denti di un adulto, circa 1 kg di calcio si trova sotto forma di un minerale cristallino insolubile: l'idrossiapatite Ca10(RO4)6(OH)2 , la cui formazione avviene durante l'interazione degli ioni Ca con i fosfationi. Nel sangue e nella linfa, il calcio si trova sia nello stato ionizzato che non ionizzato, in combinazione con proteine, carboidrati, ecc. Il meccanismo di coagulazione del sangue consiste in una serie di fasi a seconda della presenza di Ca ionizzato. Gli ioni Ca prendono parte alla trasmissione degli impulsi nervosi, alla contrazione muscolare e alla regolazione del funzionamento del muscolo cardiaco. La concentrazione di ioni Ca all'interno e all'esterno della cellula, rispettivamente, è 106 e (2,25-2,8) 103 mol/l. Poiché il calcio non viene praticamente utilizzato all'interno della cellula, agisce come materiale da costruzione nel corpo, nelle ossa e nei denti. Lo scheletro è la principale riserva di calcio nel corpo. 39. Ruolo biologico degli elementi d del gruppo VIB. Il loro uso in medicina Il cromo si trova negli organismi vegetali e animali. Il corpo di un adulto contiene circa 6 g di Cr (0,1%). Il cromo metallico non è tossico, mentre i composti Cr(III) e Cr(VI) sono pericolosi per la salute. Provocano irritazione della pelle, che porta a dermatiti. Si presume che i derivati del cromo (VI) abbiano proprietà cancerogene. 0,25-0,3 g di bicromato di potassio provocano la morte. I composti del cromo (VI) sono usati come fungicidi (mordenti, funghi - "fungo", caldere - "uccidere"). I composti del cromo (III) hanno un effetto benefico sulla crescita delle piante. Il molibdeno appartiene ai "metalli della vita", essendo uno dei bioelementi più importanti. La sua posizione speciale è stata notata 20-25 anni fa da F. Krin e L. Oril. Questi scienziati hanno avanzato l'idea che l'emergere della vita sulla Terra non sia avvenuta per evoluzione, ma che sia stata portata da una civiltà sconosciuta dallo spazio dalle stelle di molibdeno, dove la vita esisteva molto prima di noi. Nei processi biochimici, il molibdeno è coinvolto negli stati di ossidazione di VI e VI. In questi stati, crea forme oxo stabili. Il molibdeno forma oxocomplessi stabili e, a quanto pare, quindi, fa parte degli enzimi che assicurano il trasferimento dei gruppi oxo. Mo (VI) predomina nel sangue; se il ligando è ossigeno, si formano isopolimolibdazioni stabili. Un contenuto eccessivo di molibdeno negli alimenti interrompe il metabolismo del Ca2+ e RO4 , causando una diminuzione della resistenza ossea - osteoporosi. È possibile che si verifichi il legame con i complessi del fosfomolibdeno. Tali complessi possono essere considerati residui acidi di acidi eteropolimolibdici. Con il calcio questi residui formano cristalli insolubili. È possibile che questi cristalli avviino la deposizione di sali di acido urico e causino la gotta. La gotta deforma le articolazioni, giustificando la sua traduzione letterale: "trappola per i piedi". Oltre ai complessi di ossigeno, il molibdeno forma complessi di alogenuro (Hal), tiocianato (NCS) e cianuro (CN). Il molibdeno è un costituente di vari enzimi. Nel corpo umano, questi includono aldeide idrossidasi, xantina deidrogenasi e xantina ossidasi. Il peso molecolare della xantina ossidasi (COX) è 250 a.u. e. m. Questo è un enzima di mammiferi contenente molibdeno. Può catalizzare l'ossidazione della xantina e di altre purine, nonché delle aldeidi. La conversione di ipoxantina e xantina in acido urico è catalizzata dalla xantina ossidasi. Si presume che durante il processo catalitico, il molibdeno formi un legame con l'azoto e l'ossigeno della xantina. Il molibdeno è il microelemento più importante delle piante, poiché le sostanze biologicamente attive con la sua partecipazione forniscono una lieve fissazione dell'azoto: lo convertono in ammoniaca o prodotti contenenti azoto. Rispetto ad altri metalli importanti dal punto di vista industriale, il molibdeno ha una bassa tossicità. Il consumo di molibdeno con il cibo è di 0,1 - 0,3 mg / die, ma non è stata stabilita l'assunzione giornaliera richiesta. La carenza di molibdeno provoca una diminuzione dell'attività della xantina ossidasi nei tessuti. Un contenuto eccessivo di molibdeno provoca l'osteoporosi. Il tungsteno è un oligoelemento. Il suo ruolo nel corpo non è ben compreso. La forma anionica del tungsteno è facilmente assorbita nel tratto gastrointestinale. Il tungsteno metallico e le sue forme cationiche non vengono assorbiti dal corpo. Non ci sono informazioni sull'omeostasi del tungsteno nei mammiferi. 40. Ruolo biologico dei composti del manganese. Il loro uso in medicina Degli elementi del gruppo VIIB, solo il manganese è un elemento biogenico e uno dei dieci "metalli della vita" necessari per il normale corso dei processi negli organismi viventi. Il corpo di un adulto contiene 12 mg. Il manganese è concentrato nelle ossa (43%), il resto è nei tessuti molli, compreso il cervello. Nel corpo, il manganese forma complessi metallici con proteine, acidi nucleici, ATP, ADP, singoli aminoacidi. Contengono metalloenzimi manganese arginasi, colinesterasi, fosfoglucomutasi, piruvato carbossilasi. Il legame dell'ammoniaca, prodotto tossico della trasformazione degli aminoacidi nell'organismo dei mammiferi, avviene attraverso l'aminoacido arginina. L'arginasi è un enzima che catalizza l'idrolisi dell'arginina nel fegato. Di conseguenza, l’arginina viene scomposta in urea e nell’amminoacido ciclico ornitina. L'urea è una sostanza non tossica e solubile in acqua. Viene trasportato dal flusso sanguigno ai reni ed escreto nelle urine. Il raggio atomico del manganese è 128 pm. Questo spiega il fatto che il manganese può sostituire il magnesio (raggio atomico 160 pm) nella sua combinazione con ATP, influenzando in modo significativo il trasferimento di energia nel corpo. Gli ioni Mg e Mn attivano anche gli enzimi: le nucleasi. Questi enzimi catalizzano l'idrolisi degli acidi nucleici del DNA e dell'RNA nel duodeno. Di conseguenza, questi biopolimeri vengono suddivisi in unità monomeriche: nucleotidi. In particolare, tale nucleasi è la desossiribonucleasi, che catalizza l'idrolisi del DNA solo in presenza di Mg2+ o Mn2+. Il manganese può anche essere parte dei composti inorganici nel corpo. Questo, ad esempio, è un pirofosfato di manganese magnesio MnMgP scarsamente solubile2O7. I cristalli di questo sale sono localizzati sulla superficie interna della membrana della vescicola. Quasi lo stesso valore del raggio atomico del manganese e del ferro spiega la capacità del manganese di sostituire il ferro nel complesso porfirinico eritrocitario. Per lo stesso motivo, il manganese può anche sostituire lo zinco negli enzimi dipendenti dallo zinco, modificandone così le proprietà catalitiche. Permanganato di potassio KMnO4 - il più famoso composto di manganese utilizzato in medicina. Utilizzare soluzioni acquose contenenti KMnO4 0,01-5%. Come agente emostatico, viene utilizzata una soluzione al 5%. Le soluzioni di permanganato di potassio hanno proprietà antisettiche, determinate dal suo alto potere ossidante. Tra gli altri composti di manganese, si segnala il solfato di manganese (II) e il cloruro di manganese (II), che vengono utilizzati nel trattamento dell'anemia. Non ci sono dati sulla presenza di tecnezio negli organismi viventi. Tuttavia, per il metodo diagnostico dei radioisotopi vengono utilizzati composti di tecnezio con bifosfonati. 41. Il ruolo biologico dei composti del ferro. Emoglobina Il ferro è un elemento biogenico presente nei tessuti di animali e piante. La massa totale di ferro nel corpo di un adulto è di circa 5 g, ovvero lo 0,007%. Il ferro metallico è poco tossico e i composti Fe (II), Fe (III) e Fe (VI) in grandi quantità sono pericolosi per la salute. Mioglobina, citocromi e catalasi forniscono la respirazione cellulare. Tutte queste proteine sono costituite dalle parti proteiche effettive e dai centri attivi ad esse associati. Il centro attivo è un composto complesso macrociclico: l'eme. Il composto porfirina agisce come un ligando macrociclico. Gli atomi di azoto donatori si trovano agli angoli del quadrato, al centro del quale si trova lo ione Fe. In generale il complesso ha una configurazione ottaedrica. Il quinto orbitale attraverso l'azoto amminoacidico (istidina) viene utilizzato per collegare l'eme alla proteina. L'emoglobina è costituita da 4 molecole proteiche (subunità) che formano un unico aggregato macromolecolare. Ogni subunità ha una struttura simile alla molecola di mioglobina. Pertanto, l'emoglobina può legare contemporaneamente quattro molecole di O2 e mioglobina - 1. Nei tessuti sono presenti anche numerosi complessi proteici contenenti ferro non eme. Questi sono, ad esempio, enzimi - ossidasi, proteine di stoccaggio (depositi) e trasportatori di ferro. Il ferro in eccesso viene trasportato nel sangue dalla proteina transferrina e si accumula sotto forma di proteina ferritina in vari tessuti e organi, soprattutto nel fegato, nella milza e nel midollo osseo. La ferritina è costituita da 24 molecole proteiche (subunità) che formano una sfera con un diametro di 12-14 nm. Ogni subunità contiene una cavità di 7 nm di diametro contenente fino a 4500 atomi di ferro. Pertanto, ogni aggregato di ferritina può immagazzinare circa 100 atomi di ferro, fornendo numerose reazioni metaboliche che coinvolgono questo elemento. Sulla base delle leggi dell'equilibrio chimico, non è difficile comprendere il funzionamento dell'emoglobina come vettore di ossigeno dai polmoni ai tessuti. L'emoglobina senza ossigeno (deossiemoglobina) è un acido debole e la sua formula chimica può essere rappresentata come HHb+. L'aggiunta di ossigeno è accompagnata dall'eliminazione di un protone e si forma l'ossiemoglobina HbO.2 . In questo caso c'è un equilibrio: Hb+ + O2 →HbO2 + H+. Quando il sangue venoso povero di ossigeno entra nei polmoni, dove la pressione parziale dell'ossigeno è alta (fino a 20 kPa), la sua solubilità aumenta secondo la legge di Henry. Ciò porta, secondo il principio di Le Chatelier, ad uno spostamento dell'equilibrio verso destra e alla formazione di ossiemoglobina. Un ulteriore spostamento dell'equilibrio verso destra è dovuto al fatto che nei polmoni il valore del pH è aumentato (fino a 7,5). Di conseguenza, nei polmoni, la deossiemoglobina è quasi completamente (fino al 97%) satura di ossigeno e passa nell'ossiemoglobina. Nei capillari che penetrano nei tessuti periferici, la pressione parziale dell'ossigeno diminuisce a 5 kPa e il valore del pH diminuisce a 7,2. Di conseguenza, l'equilibrio si sposta a sinistra. Nel sangue che scorre dalla periferia, l'emoglobina è satura di ossigeno solo del 65%. 42. Il ruolo biologico dei composti del ferro. monossido di carbonio CO. Le proprietà del complesso metallico delle proteine contenenti eme si manifestano sotto l'influenza di sostanze tossiche come CO (monossido di carbonio) e MCN (cianuro - sali dell'acido cianidrico). Le più importanti da un punto di vista fisiologico sono le proteine contenenti ferro: emoglobina, mioglobina, citocromi, perossidasi, catalasi. L'emoglobina è il componente principale dei globuli rossi, fornisce la respirazione esterna, essendo un trasportatore di ossigeno dai polmoni ai tessuti. Ferro Fe e cobalto Co sono oligoelementi essenziali degli organismi viventi. Il monossido di carbonio CO è uno dei prodotti della combustione incompleta del carburante. Quantità significative di questo gas vengono emesse durante il funzionamento di caldaie, motori a combustione interna e fumo. Quando la CO viene inalata con l'aria nei polmoni in parallelo con l'ossiemoglobina HbO2 si forma un composto complesso metallico: carbonilemoglobina HbCO. La costante di stabilità dell'HbCO è circa 200 volte maggiore di quella dell'HbO2 . Pertanto, anche piccole quantità di CO “intercettano” una quota significativa di deossiemoglobina, di conseguenza diminuisce l’apporto di ossigeno agli organi. Compaiono segni di ipossia (carenza di ossigeno). I tessuti nervosi sono i primi ad essere colpiti. Per disintossicarsi (eliminare l'effetto tossico) del monossido di carbonio, in molti casi è sufficiente interromperne l'apporto e aumentare la ventilazione dell'ossigeno - portare la vittima all'aria aperta. In questo caso, il principio di Le Chatelier funziona di nuovo: l'equilibrio si sposta verso la formazione di ossiemoglobina. Ad alte concentrazioni, il monossido di carbonio blocca le proteine della respirazione cellulare contenenti eme ed è difficile evitare un esito letale. Il meccanismo d'azione dei cianuri è simile, ma la loro tossicità è superiore a quella della CO. L'ingresso nel sangue di quantità anche molto piccole di queste sostanze porta all'arresto respiratorio e alla morte. L'elevata tossicità dei cianuri è spiegata dall'elevata forza del legame Fe-CN-, che determina la maggiore stabilità dell'emoglobina cianidrica. La respirazione di ossigeno porta alla formazione di perossido di idrogeno H2O2 . Questa sostanza ha un'elevata capacità ossidante. Quando interagisce con i composti bioorganici delle cellule, si formano i radicali: particelle molecolari molto attive con valenza insatura e viene avviata l'ossidazione del perossido. Sotto l'influenza dei radicali, i componenti più importanti della cellula: membrane e DNA vengono distrutti. Durante l'evoluzione biologica, la natura ha sviluppato una proteina speciale: l'enzima catalasi, che distrugge il perossido di idrogeno. Ciò limita l'accumulo eccessivo di questa sostanza e impedisce la distruzione cellulare. L'azione della catalasi (CatFe2+ ) può essere rappresentato come un ciclo catalitico di due reazioni successive: gatto2+ + H2O2 - Gatto Fe2+ × H2O2 , gatto2+ × H2O2 + H2O2 → Gatto Fe2+ + 2Н2O2 + O2 . Di conseguenza, 2 molecole di perossido di idrogeno vengono distrutte e la molecola del biocatalizzatore CatFe2+ viene rilasciata e può entrare nel ciclo catalitico successivo. Questo processo è molto veloce. In un secondo, 1 molecola di catalasi può effettuare fino a 20 cicli. 43. Il ruolo biologico dei composti di ferro e cobalto Con una mancanza di ferro nel corpo, può svilupparsi una malattia: anemia da carenza di ferro (anemia). C'è una carenza di ossigeno nei tessuti associata a una mancanza di ferro per la sintesi dell'emoglobina. Di conseguenza, l'apporto di ossigeno agli organi periferici diminuisce e, di conseguenza, il livello di respirazione cellulare diminuisce e il metabolismo rallenta. L'introduzione di cloruro di ferro (II) o solfato di ferro (II) come farmaci riduce la gravità della malattia. Per gli stessi scopi viene utilizzata una polvere fine di ferro metallico (ferro ridotto, fino a 1 g per dose), facilmente solubile in acido cloridrico del succo gastrico. Pertanto, l'azione di questo farmaco è simile a quella del cloruro di ferro (II). Tuttavia, i farmaci che sono complessi bioinorganici di ferro con zuccheri, nicotinamide e altre sostanze organiche sono più efficaci. Tali complessi sono ben assorbiti nel sangue, motivo della loro efficacia farmacologica. È interessante notare che dai tempi antichi fino ai giorni nostri, il cosiddetto vino di ferro, una bevanda ottenuta mediante infusione di vino d'uva su limatura di ferro, è stato utilizzato per trattare l'anemia da carenza di ferro. Ovviamente il ferro si dissolve nel vino (ambiente acido) e forma complessi con le sostanze organiche naturali, che contiene in grandi quantità. È chiaro che il meccanismo d'azione dell'antica bevanda è approssimativamente lo stesso di quello dei farmaci moderni. Come il ferro, anche il cobalto è uno degli elementi biogenici più importanti. La massa totale di cobalto nel corpo di un adulto è di circa 1,2 mg, che è inferiore al 10%. Circa 100 mg di questa massa sono sotto forma di cianocobalamina (vitamina B liposolubile12 ) e suoi analoghi. Questa sostanza, come l'eme, è un composto complesso macrociclico. Un composto tetradentato, la porfina, funge da ligando macrociclico. R è un sostituente organico complesso. Negli analoghi della cianocobalamina, al posto dell'anione CN agiscono vari sostituenti organici. Il ruolo più importante della vitamina B12 gioca nello sviluppo e nella formazione dei globuli rossi (eritropoiesi). Carenza di vitamina B12 (l'assunzione di meno di 3 mcg al giorno) porta a una malattia grave: l'anemia perniciosa (anemia). È stato stabilito che gli analoghi della cianocobalamina sono attivatori - cofattori di vari enzimi coinvolti nell'eritropoiesi. La mancanza di cofattori si manifesta nella carenza di emoglobina ed eritrociti. Le piante e gli animali non possono sintetizzare la vitamina B12. È prodotto solo da alcuni tipi di batteri. Questi batteri sono presenti nel tratto gastrointestinale umano. Sintetizzano abbastanza vitamina B12. L'anemia perniciosa è associata a un ridotto assorbimento di questa vitamina nel sangue. Pertanto, l'assunzione di pillole è inefficace. Un'iniezione di vitamina (100-200 mcg per 2 giorni) nel sangue migliora significativamente le condizioni del paziente con anemia maligna. 44. Il ruolo degli elementi d del gruppo IB. L'uso dei loro composti in medicina Il rame Cu è un microelemento essenziale per gli organismi viventi. L'argento Ag e l'oro Au sono oligoelementi. I loro composti sono usati in medicina. Il rame è un elemento biogenico presente nei tessuti di animali e piante. La massa totale di rame nel corpo umano adulto è di circa 100 mg, ovvero circa lo 0,0001%. Circa il 30% di questa quantità si trova nei muscoli. Anche il fegato e il cervello sono ricchi di rame. Il rame metallico e i suoi composti sono tossici. Le più importanti da un punto di vista fisiologico sono le proteine contenenti rame: citocromo ossidasi e superossido dismutasi. La citocromo ossidasi è uno dei componenti della catena respiratoria localizzata nelle membrane mitocondriali. Fornisce la respirazione cellulare riducendo l'ossigeno in acqua all'estremità della catena respiratoria. Il corpo richiede 2,5-5,0 mg di rame al giorno. Se c'è una carenza di rame nel corpo, può svilupparsi una malattia: anemia da carenza di rame. Il rame è necessario per l'assorbimento del ferro, in particolare nella sintesi della citocromo ossidasi, che contiene sia ferro che rame. Con la carenza di rame, il normale sviluppo dei tessuti connettivi e dei vasi sanguigni viene interrotto. L'avvelenamento è solitamente associato a un sovradosaggio accidentale di insetticidi, inalazione di polvere di metallo, ingestione di soluzioni di sale di rame. Le bevande conservate in recipienti di rame senza un rivestimento protettivo delle pareti sono di grande pericolo. Come agente esterno viene utilizzata una soluzione acquosa allo 0,25% di solfato di rame CuSO.4 con infiammazione delle mucose e congiuntivite. Piccole dosi di questo farmaco possono essere assunte con il cibo per aumentare l'eritropoiesi nell'anemia. Argento e oro Nel corpo di un adulto si trovano circa 1 mg di argento, cioè circa il 10% (1 parte per milione) e fino a 10 mg di oro, cioè circa il 10% (10 parti per milione). Le proprietà antisettiche dei sali d'argento solubili sono note fin dall'antichità. I sacerdoti sanno da molto tempo che l'acqua ("santa"), se conservata in vasi d'argento, non si deteriora a lungo, cioè non è soggetta a contaminazione microbica. Attualmente, questa proprietà dell'acqua "argento" è utilizzata dai marinai nei viaggi a lunga distanza. Forti manifestazioni tossiche in un adulto si osservano quando vengono ingeriti 7 g di AgNO.3. In medicina sono da tempo utilizzati farmaci come il nitrato d'argento cristallino AgNO03 (lapis) e le sue soluzioni acquose. Sono note da tempo preparazioni colloidali di argento metallico protargol (8% Ag) e collargol (70% Ag), che sono polveri fini con una lucentezza metallica. Ciascuna particella di tali polveri è un cristallo di argento metallico ridotto di dimensioni inferiori a 1 μm con un guscio proteico di albumina (protargol) o collagene (collargol). Il guscio proteico protegge i cristalli d'argento dall'adesione e ne assicura il passaggio nel mezzo acquoso (solubilizza). I preparati d'argento sono usati come agenti antinfiammatori, antisettici e astringenti. I preparati d'oro sono anche usati come efficaci farmaci antinfiammatori. I più conosciuti sono il krizanol con un contenuto del 30% del metallo nobile e l'oro colloidale. 45. Ruolo biologico degli elementi d del gruppo IIB. L'uso dei loro composti in medicina Zinco Zn, cadmio Cd, mercurio Hg sono oligoelementi. Il corpo di un adulto contiene 1,8 g di Zn, 50 mg di Cd, 13 mg di Hg. Il cadmio e il mercurio sono elementi impuri. Circa il 70% del mercurio è concentrato nel tessuto adiposo e muscolare. Il cadmio è localizzato per il 30% nei reni, il resto nel fegato, nei polmoni e nel pancreas. Lo zinco è un elemento essenziale per tutte le piante e gli animali. Nel corpo di un adulto, la maggior parte dello zinco nei muscoli (65%) e nelle ossa (20%). Il resto della quantità cade sul plasma sanguigno, sul fegato, sugli eritrociti. La più alta concentrazione di zinco nella ghiandola prostatica. Lo zinco non mostra valenza variabile. Apparentemente, quindi, i suoi biocomplessi prendono parte a molte reazioni biochimiche di idrolisi che avvengono senza trasferimento di elettroni. Lo ione Zn fa parte di oltre 40 metalloenzimi che catalizzano l'idrolisi di esteri e proteine. Uno dei più studiati è il complesso bioinorganico dello zinco - l'enzima anidrasi carbonica (Mg = 30), costituito da circa 000 residui di amminoacidi. Lo zinco non fa parte delle dipeptidasi, enzimi che catalizzano l'idrolisi dei dipeptidi (sostanze costituite da 2 aminoacidi). Lo zinco forma un complesso bioinorganico con l'insulina, un ormone che regola lo zucchero nel sangue. Il fabbisogno umano di zinco è pienamente soddisfatto dai prodotti alimentari: carne, latticini, uova. Con una carenza di zinco nelle piante, il metabolismo delle proteine e dei carboidrati viene interrotto e la sintesi della clorofilla e delle vitamine viene inibita. La carenza di zinco viene eliminata utilizzando fertilizzanti contenenti zinco. La tossicità dei composti del gruppo IIB aumenta dallo zinco al mercurio. I composti idrosolubili sono irritanti per la pelle e causano avvelenamento se ingeriti. Anche i metalli stessi sono tossici: quando si inala vapore di zinco (aria proveniente dalla produzione di zinco), appare la febbre del "metallo". Nel Medioevo l’avvelenamento da vapori di mercurio era chiamato “morbo del cappellaio matto”. I livelli di mercurio negli alimenti (frutti di mare, come in Giappone) portano alla malattia dei minomi. La tossicità del mercurio è associata all'agglutinazione (adesione) dei globuli rossi e all'inibizione degli enzimi. Ad esempio, il sublimato provoca un cambiamento di dimensione, fragilità osmotica e una diminuzione della deformabilità dei globuli rossi, necessaria per il loro movimento attraverso i capillari. La tossicità del cadmio è legata alla sua affinità per gli acidi nucleici. Come risultato del suo attaccamento al DNA, il suo funzionamento viene interrotto. La tossicità cronica da cadmio e mercurio può compromettere la mineralizzazione ossea. Gli elementi tossici possono sostituire il calcio. Questo porta alla formazione di apatite con struttura imperfetta a causa della distorsione dei parametri della componente cristallina del tessuto osseo. Di conseguenza, la forza ossea diminuisce. 46. Proprietà tossiche dei composti del gruppo IIB (Zn, Cd, Hg) I composti Zn, Cd, Hg possono causare una violazione del metabolismo proteico, che si manifesta nel rilascio di proteine plasmatiche attraverso i reni (nella proteinuria). L'effetto tossico dei composti del gruppo IIB sul corpo è anche causato dal fatto che questi ioni metallici interagiscono con i gruppi sulfidrilici SH di proteine, enzimi e amminoacidi. Quando gli ioni metallici interagiscono con i gruppi SH, si formano composti debolmente dissociati e, di regola, insolubili. Pertanto, il blocco dei gruppi sulfidrilici porta alla soppressione dell'attività enzimatica e del ripiegamento proteico. Gli ioni metallici bivalenti bloccano due gruppi SH contemporaneamente. In reazioni di questo tipo, gli ioni metallici agiscono come accettori e lo zolfo agisce come donatore di elettroni. L'affinità chimica più pronunciata per i gruppi SH nel mercurio. Ovviamente, ciò è dovuto al fatto che le proprietà complessanti del mercurio sono più elevate e forma legami più forti con lo zolfo. I gruppi SH fanno parte di più di 100 enzimi, la cui attività può essere soppressa a causa del blocco di questi gruppi. Pertanto, è ovvio quanto sia importante conoscere il meccanismo di blocco e i metodi di trattamento per l'avvelenamento del corpo con i metalli. È noto che le proprietà tossiche degli elementi dipendono dalla forma chimica in cui entrano nel corpo. Le forme più tossiche sono quelle che si dissolvono nei lipidi e penetrano facilmente attraverso la membrana nella cellula. La letteratura descrive un caso di avvelenamento di massa da mercurio in Giappone. I composti inorganici del mercurio sono stati convertiti in metilmercurio sotto l'azione di enzimi microbici. Il metilmercurio si accumulava nei pesci e poi entrava nel corpo umano con il cibo. Concentrandosi gradualmente, il metilmercurio provoca una distruzione irreversibile nel corpo e la morte. L'uso dei composti di zinco e mercurio in medicina si basa sui loro effetti astringenti, cauterizzanti e antisettici. Come collirio viene utilizzata una soluzione acquosa allo 0,25% di solfato di zinco ZnSO.4. In odontoiatria, il cloruro di zinco viene utilizzato per cauterizzare i papillomi, per trattare le mucose infiammate. Viene anche utilizzato l'ossido di zinco ZnO. Il cloruro di mercurio (II) (cloruro di mercurio) è molto tossico e le sue soluzioni acquose ad alte diluizioni (1: 1000) vengono utilizzate per la disinfezione. Per il trattamento della pelle e delle malattie sessualmente trasmissibili vengono utilizzati unguenti contenenti ossido di mercurio (II) HgO e solfuro di mercurio (II) HgS. Il cloruro di mercurio (I) (calomel) è poco solubile in acqua e quindi leggermente tossico. Questo sale è usato in medicina veterinaria come lassativo. Il mercurio in condizioni normali è un metallo liquido in grado di dissolvere altri metalli. In questo caso si formano leghe dure: amalgami. In odontoiatria, gli amalgami di argento e cadmio sono stati a lungo utilizzati per le otturazioni dei denti. Sono chimicamente inerti, si ammorbidiscono facilmente se riscaldati e sono quindi facili da modellare. Le sorgenti di luce ultravioletta - lampade al quarzo-mercurio per uso medico - contengono mercurio gassoso (vapore). Quando irradiati con la luce di queste lampade nei locali ospedalieri, i microrganismi contenuti nell'aria vengono distrutti. Varie malattie della pelle vengono trattate con l'aiuto dei raggi ultravioletti. Pertanto, in base alla natura del funzionamento e dell'impatto sul corpo, i metalli del gruppo IIB possono essere suddivisi nell'elemento vitale Zn e negli elementi di impurità tossiche Cd e Hg. 47. Ruolo biologico degli elementi p del gruppo IIIA. L'uso dei loro composti in medicina Il boro è un oligoelemento di impurità, la sua frazione di massa nel corpo umano è del 105%. Il boro è concentrato principalmente nei polmoni (0,34 mg), nella tiroide (0,30 mg), nella milza (0,26 mg), nel fegato, nel cervello (0,22 mg), nei reni, nel muscolo cardiaco (0,21 mg). L'effetto biologico del boro non è stato ancora sufficientemente studiato. È noto che il boro è presente nei denti e nelle ossa, apparentemente sotto forma di sali poco solubili dell'acido borico con cationi metallici. L'eccesso di boro è dannoso per il corpo umano. Ci sono prove che un eccesso di boro inibisce le amilasi, le proteinasi e riduce l'attività dell'adrenalina. Secondo il contenuto nel corpo umano (105%), l'alluminio appartiene ai microelementi delle impurità. L'alluminio è concentrato principalmente nel siero del sangue, nei polmoni, nel fegato, nelle ossa, nei reni, nelle unghie, nei capelli, entra nella struttura delle guaine nervose del cervello umano. L'assunzione giornaliera di alluminio da parte di un essere umano è di 47 mg. L'alluminio influenza lo sviluppo dei tessuti epiteliali e connettivi, la rigenerazione del tessuto osseo, influenza lo scambio di fosforo. L'alluminio ha un effetto sui processi enzimatici. Un eccesso di alluminio nel corpo inibisce la sintesi dell'emoglobina, perché a causa della sua capacità complessante piuttosto elevata, l'alluminio blocca i centri attivi degli enzimi coinvolti nell'emopoiesi. Ci sono prove che l'alluminio può catalizzare la reazione di transaminazione. Il gallio è un oligoelemento di impurità (il contenuto nel corpo umano è 10-6 all'10 ottobre-5%). Il ruolo biologico del gallio negli organismi viventi non è quasi chiaro. Il tallio è un elemento altamente tossico. Lo ione T1 tende, come Ag+, a formare composti forti con leganti contenenti zolfo. Di conseguenza, è molto tossico, poiché inibisce l'attività degli enzimi contenenti gruppi tio - SH. Anche quantità molto piccole di composti T1+, se ingerite, causano la caduta dei capelli. A causa della vicinanza dei raggi K+ e T1+ hanno proprietà simili e sono in grado di sostituirsi a vicenda negli enzimi. Gli ioni T1 e K sono sinergizzanti. Questo spiega il fatto che gli enzimi piruvato chinasi e diolo deidratasi sono attivati non solo dagli ioni K, ma anche dagli ioni T1 (lo ione T1 sostituisce lo ione K nel centro catalitico degli enzimi). Il sinergismo di tallio e potassio si manifesta anche nel fatto che, come gli ioni K, gli ioni T1 si accumulano negli eritrociti. Come antidoto per l'avvelenamento da ioni T1, viene utilizzato un ligando contenente zolfo, l'amminoacido cistina. In conclusione, va notato che il ruolo biologico degli elementi p del gruppo IIIA non è stato sufficientemente studiato. È ormai noto che boro e gallio interagiscono nelle piante con i polifenoli, inibitori del loro sviluppo, riducendo la tossicità di questi ultimi. È stato inoltre stabilito l'indubbio ruolo dell'alluminio nella costruzione dei tessuti epiteliali e connettivi e, inoltre, la sua partecipazione ai processi enzimatici, sia come attivatore che come inibitore. Lo ione T1 ha la capacità di inibire molti enzimi contenenti zolfo. L'attività biologica degli elementi del gruppo IIIA è principalmente correlata alla loro capacità di formare composti complessi con leganti contenenti ossigeno e fosfati insolubili. 48. Ruolo biologico degli elementi p del gruppo IVA. L'uso dei loro composti in medicina Secondo il contenuto nel corpo umano (21,15%), il carbonio appartiene ai macronutrienti. Fa parte di tutti i tessuti e le cellule sotto forma di proteine, grassi, carboidrati, vitamine, ormoni. Da un punto di vista biologico, il carbonio è l'organogeno numero 1. Secondo il contenuto nel corpo umano (103% ־), il silicio appartiene ai microelementi delle impurità. La maggior parte del silicio nel fegato, nelle ghiandole surrenali, nei capelli, nel cristallino. Poiché il biossido di silicio naturale è scarsamente solubile in acqua, entra nel corpo umano non tanto attraverso il tubo digerente quanto per via aerea attraverso i polmoni sotto forma di SiO polveroso2. Con una violazione del metabolismo del silicio, è associato il verificarsi di ipertensione, reumatismi, ulcere, anemia. Nella pratica medica viene utilizzato il carburo di silicio (IV) SiC - carborundum per la macinazione di otturazioni e protesi di plastica. Biossido di silicio SiO2 parte dei cementi ai silicati. Va notato che la polvere costituita da particelle di carbone, biossido di silicio e alluminio, se esposta sistematicamente ai polmoni, provoca una malattia: la pneumoconiosi. Se esposto alla polvere di carbone, si tratta di antracosi, una malattia professionale dei minatori. Se si inala polvere contenente S1O2 , si verifica la silicosi e, se esposto alla polvere di alluminio, l'alluminosi. Secondo il contenuto del corpo umano (10-6 all'10 ottobre-5%) il germanio è un microelemento. Il ruolo biologico non è stato del tutto chiarito. I composti di germanio migliorano i processi di emopoiesi nel midollo osseo. È anche noto che i composti del germanio hanno una bassa tossicità. Secondo il contenuto del corpo umano (104 %) lo stagno si riferisce agli oligoelementi. Lo stagno entra nel corpo umano con cibi acidi conservati in barattoli di latta ricoperti da uno strato di stagno. In un ambiente acido, lo stagno si dissolve ed entra nel sangue sotto forma di sale, esibendo un effetto tossico. Tuttavia, in esperimenti sui ratti, è stato riscontrato che lo stagno in piccole quantità ha un effetto stimolante sulla crescita dei ratti. Questo dà motivo di presumere la sua necessità per gli esseri umani. Indubbiamente, la delucidazione del ruolo biologico di questo microelemento richiede ulteriori studi. Nella pratica medica vengono utilizzati vari materiali, in particolare materiali di riempimento contenenti stagno. Quindi, lo stagno fa parte dell'amalgama d'argento (28%) per la produzione di ripieni. Il piombo e i suoi composti, soprattutto quelli organici, sono altamente tossici. I composti di piombo influenzano la sintesi proteica, il bilancio energetico della cellula e il suo apparato genetico. Molti fattori favoriscono il meccanismo di denaturazione. È stato accertato che il piombo è uno degli elementi la cui presenza negli alimenti influisce sullo sviluppo della carie. Con il cibo, l'acqua e l'aria atmosferica, una persona assorbe fino a 100 mcg di piombo ogni giorno. Il piombo si deposita principalmente nello scheletro (fino al 90%) sotto forma di fosfato scarsamente solubile. La frazione di massa del piombo nel corpo umano è del 106%. Un'assunzione giornaliera di 0,2-2 mg di piombo è considerata sicura per l'uomo. Nella pratica medica, l'acetato di piombo (lozioni) e l'ossido di piombo (II) PbO (parte del semplice cerotto di piombo) hanno trovato applicazione come antisettici astringenti esterni. 49. Ruolo biologico degli elementi p del gruppo VA. L'uso dei loro composti in medicina (azoto, fosforo) Il contenuto di azoto nel corpo umano (3,1%) appartiene ai macroelementi. Se prendiamo in considerazione solo la massa della sostanza secca del corpo (senza acqua), il contenuto di azoto nelle cellule è dell'8-10%. Questo elemento è un componente di aminoacidi, proteine, vitamine e ormoni. L'azoto forma legami polari con gli atomi di idrogeno e di carbonio nelle biomolecole. In molti complessi bioinorganici (metalloenzimi), gli atomi di azoto legano le parti inorganiche e organiche della molecola attraverso un meccanismo donatore-accettore. Insieme all'ossigeno e al carbonio, l'azoto forma composti vitali: gli amminoacidi, che contengono contemporaneamente un gruppo amminico con proprietà basiche e un gruppo carbossilico (-COOH) con proprietà acide. Il gruppo amminico svolge anche una funzione molto importante nelle molecole di acido nucleico. Il significato fisiologico dei bioligandi contenenti azoto: le porfirine, ad esempio l'emoglobina, è enorme. Il ciclo dell'azoto avviene nella biosfera. Il ciclo dell'azoto è vitale per l'agricoltura. È necessario notare un'altra proprietà biologicamente importante dell'azoto: la sua solubilità in acqua è quasi la stessa di quella dell'ossigeno. La presenza di un eccesso di azoto nel sangue può essere la causa dello sviluppo della malattia da decompressione. Con il rapido aumento dei subacquei, si verifica un forte calo della pressione, la solubilità dell'azoto nel sangue diminuisce di conseguenza (legge di Henry) e le bolle di azoto elementare che lasciano il sangue ostruiscono i piccoli vasi, il che può portare alla paralisi e alla morte. In base al suo contenuto nel corpo umano (0,95%), il fosforo è classificato come macronutriente. Il fosforo è un elemento organogeno e svolge un ruolo estremamente importante nel metabolismo. Sotto forma di fosfato, il fosforo è un componente essenziale dell'ATP intracellulare. Fa parte delle proteine (0,5-0,6%), degli acidi nucleici, dei nucleotidi e di altri composti biologicamente attivi. Il fosforo è la base dello scheletro degli animali e dell'uomo (ortofosfato di calcio, idrossiapatite), dei denti (idrossiapatite, fluorapatite). Molte reazioni biosintetiche vengono eseguite a causa del trasferimento di gruppi fosfato da un accettore ad alta energia a uno a bassa energia. Il sistema tampone fosfato è uno dei principali sistemi tampone nel sangue. Gli organismi viventi non possono fare a meno del fosforo. L'importanza del fosforo sta nel fatto che gli zuccheri e gli acidi grassi non possono essere utilizzati dalle cellule come fonti di energia senza una preventiva fosforilazione. Lo scambio di fosforo nel corpo è strettamente correlato allo scambio di calcio. Ciò è confermato da una diminuzione della quantità di fosforo inorganico con un aumento del contenuto di calcio nel sangue (antagonismo). Il fabbisogno umano giornaliero di fosforo è di 1,3 g.Il fosforo è così diffuso nei prodotti alimentari che i casi di sua evidente carenza (carenza di fosfato) sono praticamente sconosciuti. Tuttavia, non tutto il fosforo contenuto nei prodotti alimentari può essere assorbito, poiché il suo assorbimento dipende da molti fattori: il pH, il rapporto tra il contenuto di calcio e fosforo negli alimenti, la presenza di acidi grassi negli alimenti, ma soprattutto dal contenuto di vitamina D. Un certo numero di composti del fosforo sono usati come medicinali. Va notato che i composti organofosforici contenenti il legame CP sono forti veleni nervosi e fanno parte di agenti di guerra chimica. 50. Ruolo biologico degli elementi p del gruppo VA (arsenico, antimonio, bismuto). Il loro uso in medicina Secondo il contenuto nel corpo umano, l'arsenico appartiene agli oligoelementi. Si concentra nel fegato, reni, milza, polmoni, ossa, capelli. La maggior parte dell'arsenico si trova nel tessuto cerebrale e nei muscoli. L'arsenico si accumula nelle ossa e nei capelli e non viene completamente rimosso da essi per diversi anni. Questa caratteristica viene utilizzata nell'esame forense per chiarire la questione se vi sia stato avvelenamento con composti di arsenico. La determinazione dell'arsenico nel materiale biologico viene effettuata in un semplice dispositivo secondo la reazione di Marsh: all'oggetto biologico vengono aggiunti zinco e acido cloridrico. L'idrogeno rilasciato durante la reazione riduce qualsiasi composto di arsenico ad arsina. Se l'idrogeno liberato contiene una miscela di arsina, AsH si decompone quando la miscela di gas viene riscaldata3 : 2Ash3 = 2A° + 3H2. e uno strato nero lucido di arsenico si forma sulle pareti del tubo di rilascio del gas: uno "specchio di arsenico". La reazione Marsh è molto sensibile e consente di rilevare 7-107 g arsenico. In dosi relativamente elevate, i composti dell'arsenico sono molto tossici. Come già accennato, l'effetto tossico dei composti dell'arsenico è dovuto al blocco dei gruppi sulfidrilici di enzimi e di altre sostanze biologicamente attive. In base al loro contenuto nel corpo umano (10%), l'antimonio e il bismuto sono considerati microelementi. Secondo la classificazione di V.V. Kovalsky, l'antimonio e il bismuto sono classificati come membri del gruppo di microelementi che si trovano costantemente negli organismi viventi, ma il cui ruolo fisiologico e biochimico non è praticamente chiaro. Il ruolo fisiologico dell'antimonio è ovviamente simile a quello dell'arsenico. Gli ioni di arsenico As e l'antimonio Sb e, in misura minore, il bismuto Bi sono sinergizzanti. Pertanto, è noto che nelle province biogeochimiche con un eccesso di arsenico negli organismi, aumenta il contenuto non solo di arsenico, ma anche di antimonio. Allo stesso tempo, entrambi gli elementi si accumulano nella ghiandola tiroidea degli abitanti, ne inibiscono la funzione e provocano il gozzo endemico. Il sinergismo di arsenico e antimonio è associato alla loro capacità di formare composti con ligandi contenenti zolfo. Il bismuto è più incline a legarsi con ligandi contenenti gruppi amminici. Quindi, l'ingresso di composti solubili di bismuto nel corpo porta all'inibizione degli enzimi amino e carbossipolipeptidasi. L'ingestione di composti di antimonio idrosolubili, come la stibina SbH3, ha un effetto tossico simile ai composti di arsenico. Anche i composti del bismuto sono tossici se iniettati. Ad esempio, per i cani, la dose letale è di 6 mg/kg di peso corporeo. Tuttavia, quando la maggior parte dei composti di antimonio e bismuto entrano nel tratto digestivo, praticamente non hanno un effetto tossico. La debole tossicità di questi composti è dovuta al fatto che i sali di Sb (III), Bi (III) nel tubo digerente subiscono idrolisi con formazione di prodotti scarsamente solubili che non vengono assorbiti dalle pareti del tratto gastrointestinale. Questa è la base per l'uso di farmaci di antimonio e bismuto, ad esempio il nitrato di bismuto di base. 51. Ruolo biologico degli elementi p del gruppo VIA. L'uso dei loro composti in medicina Secondo il contenuto nel corpo umano (62%), l'ossigeno appartiene ai macronutrienti. È indispensabile ed è uno degli elementi più importanti che stanno alla base dei sistemi viventi, cioè è un organogeno. L'ossigeno fa parte di un numero enorme di molecole, dalle più semplici ai biopolimeri. Il ruolo dell'ossigeno nei processi vitali è grande, poiché l'ossidazione dei nutrienti (carboidrati, proteine, grassi) con l'ossigeno funge da fonte di energia necessaria per il funzionamento di organi e tessuti degli organismi viventi. La maggior parte delle reazioni redox nel corpo procede con la partecipazione dell'ossigeno e delle sue forme attive. Le funzioni fagocitiche (protettive) del corpo sono anche associate alla presenza di ossigeno e una diminuzione del contenuto di ossigeno nel corpo ne riduce le proprietà protettive. Nei fagociti (cellule in grado di catturare e digerire corpi estranei), l'ossigeno 02 è ridotto a superossido. Nella pratica medica, l'ossigeno viene utilizzato per l'inalazione in condizioni dolorose accompagnate da carenza di ossigeno (ipossia), malattie delle vie respiratorie, sistema cardiovascolare, avvelenamento da monossido di carbonio (II) CO, acido cianidrico HCN, nonché malattie con funzionalità respiratorie compromesse . Ampiamente usato nella pratica clinica è l'ossigenazione iperbarica - l'uso di ossigeno ad alta pressione. La modifica allotropica dell'ossigeno - ozono O3 come agente ossidante molto forte viene utilizzata per la disinfezione dei locali, la disinfezione dell'aria e la purificazione dell'acqua potabile. In termini di contenuto nel corpo umano (0,16%), lo zolfo è classificato come macronutriente. Come l'ossigeno, è vitale. Il fabbisogno giornaliero di zolfo di un adulto è di circa 4-5 g Lo zolfo fa parte di molte biomolecole: proteine, aminoacidi (cistina, cisteina, metionina, ecc.), Ormoni (insulina), vitamine (vitamina B1). Molto zolfo è contenuto nel carotene nei capelli, nelle ossa e nel tessuto nervoso. Negli organismi viventi, lo zolfo, che fa parte degli amminoacidi, è ossidato. I prodotti finali di questo processo sono prevalentemente solfati. Inoltre si formano tiosolfati, zolfo cementizio e acidi politionici. Secondo il contenuto del corpo (10-5 all'10 ottobre-7%) il selenio è un microelemento. Alcuni ricercatori lo considerano un elemento vitale. Il selenio proviene dal cibo - 55-110 mg all'anno. Il selenio è concentrato principalmente nel fegato e nei reni. La concentrazione di selenio nel sangue è 0,001-0,004 mmol / l. La connessione del selenio con lo zolfo negli organismi viventi è indubbia. Ad alte dosi, il selenio si accumula principalmente nelle unghie e nei capelli, che sono a base di aminoacidi contenenti zolfo. È anche nota la capacità del selenio di proteggere il corpo dall'avvelenamento con mercurio Hg e cadmio Cd. Il selenio favorisce il legame di questi metalli tossici ad altri centri attivi, a quelli che non risentono del loro effetto tossico. Un dato interessante è il rapporto tra un alto contenuto di selenio nella dieta e una bassa mortalità per cancro. Il selenio è tossico a dosi elevate. La scomposizione dei composti del selenio negli animali porta al rilascio di dimetil selenio altamente tossico, che ha un odore di aglio. 52. Ruolo biologico di p-elementi del gruppo VIIA. L'uso dei loro composti in medicina (fluoro e cloro) In termini di contenuto nel corpo umano, il cloro (0,15%) appartiene ai macroelementi, mentre il resto degli elementi di questo gruppo sono microelementi (contenuto - 105 %). Gli alogeni sotto forma di vari composti fanno parte dei tessuti dell'uomo e degli animali. Cloro e iodio sono elementi insostituibili, mentre il resto sono costituenti permanenti dei tessuti. La massa di fluoro nel corpo umano è di circa 7 mg (~105 %). I composti del fluoro sono concentrati nel tessuto osseo, nelle unghie, nei denti. La composizione dei denti comprende circa lo 0,01% di fluoro e la maggior parte cade sullo smalto, che è associato alla presenza di fluorapatite scarsamente solubile in esso. La mancanza di fluoro nel corpo porta alla carie dentale. L'interesse per l'azione biologica del fluoro è associato principalmente al problema delle malattie dentali, poiché il fluoro protegge i denti dalla carie. La base minerale dei tessuti dentali (dentina) è idrossiapatite, clorapatite e fluorapatite. Molto spesso, non la superficie esterna del dente, ricoperta da uno strato di smalto, è soggetta a distruzione, ma le parti interne della dentina, esposte quando lo smalto è danneggiato. Ci sono suggerimenti che mentre lo smalto è leggermente danneggiato, l'introduzione di fluoruro di sodio favorisce la formazione di fluorapatite, facilitando la remineralizzazione del danno iniziato. Il fluoruro di sodio NaF è usato nella pratica medica come agente esterno topico. L'uso di NaF si basa sulla formazione di fluorapatite. Allo stesso tempo si verifica anche l'alcalinizzazione dell'ambiente del cavo orale, che contribuisce alla neutralizzazione degli acidi prodotti dai batteri. Non solo una carenza, ma anche un eccesso di fluoro è dannoso. Quando il contenuto di fluoro nell'acqua potabile è superiore alla norma massima consentita (1,2 mg/l), lo smalto dei denti diventa fragile, si distrugge facilmente e compaiono altri sintomi di avvelenamento cronico da fluoro: aumento della fragilità ossea, deformità ossee e esaurimento generale del corpo . La malattia che si verifica in questo caso si chiama fluorosi (fluorosi). Il corpo umano contiene circa 100 g (2790 mmol) di cloro. I cloridi svolgono un ruolo biologico importante. Attivano alcuni enzimi, creano un ambiente favorevole per l'azione degli enzimi protolitici del succo gastrico, forniscono flussi ionici attraverso le membrane cellulari e partecipano al mantenimento dell'equilibrio osmotico. Il cloridione ha un raggio ottimale per la penetrazione attraverso la membrana cellulare. Questo spiega la sua partecipazione congiunta con gli ioni Na e K nella creazione di una certa pressione osmotica e nella regolazione del metabolismo del sale acqua. Il fabbisogno giornaliero di cloruro di sodio è di 5-10 g Come già discusso, NaCl è necessario per la produzione di acido cloridrico nello stomaco. Oltre all'importante ruolo dell'acido cloridrico nel processo di digestione, distrugge vari batteri patogeni (colera, tifo). Se i batteri entrano nello stomaco con una grande quantità di acqua, a causa della diluizione dell'HCl, non ha un effetto antibatterico e i batteri sopravvivono. Questo porta alla malattia nel corpo. Pertanto, durante le epidemie, l'acqua grezza è particolarmente pericolosa. Con una quantità insufficiente di acido cloridrico nello stomaco, il pH aumenta e la normale digestione è disturbata, il che influisce gravemente sulla salute umana. Con una ridotta acidità del succo gastrico, nella pratica medica viene utilizzata una soluzione diluita di acido cloridrico. Con l'infiammazione dello stomaco (gastrite), l'ulcera peptica, la secrezione di succo gastrico aumenta, la sua acidità aumenta. 53. Ruolo biologico di p-elementi del gruppo VIIA. L'uso dei loro composti in medicina (bromo, iodio) La massa di bromo nel corpo umano è di circa 7 mg. È localizzato principalmente nelle ghiandole endocrine, principalmente nella ghiandola pituitaria. Il ruolo biologico dei composti del bromo nel normale funzionamento dell'organismo non è stato ancora sufficientemente chiarito. I composti del bromo inibiscono la funzione della ghiandola tiroidea e aumentano l'attività della corteccia surrenale. Quando i bromuri vengono introdotti nel corpo, il sistema nervoso centrale è il più sensibile. I bromidi si accumulano uniformemente in varie parti del cervello e agiscono in modo calmante con una maggiore eccitabilità. Contribuiscono al ripristino dell'equilibrio disturbato tra i processi di eccitazione e di inibizione. I bromidi sono facilmente assorbiti nel tratto gastrointestinale. La tossicità dei bromidi è bassa. A causa della lenta escrezione dal corpo (entro 30-60 giorni), possono accumularsi (cumularsi), il che porta allo sviluppo di avvelenamento cronico, chiamato bromismo. Se compaiono segni di avvelenamento cronico da bromo, i preparati a base di bromuro devono essere immediatamente sospesi. Inoltre, viene somministrata una grande quantità di cloruro di sodio (fino a 25 g al giorno) per aumentare la velocità di rilascio dei bromidi (principio di Le Chatelier) e viene prescritta una bevanda abbondante. A causa delle diverse sensibilità individuali, il dosaggio dei preparati di bromo varia da 0,05 a 2,0 g. Lo iodio è uno dei nutrienti essenziali e i suoi composti svolgono un ruolo importante nei processi metabolici. Lo iodio influenza la sintesi di alcune proteine, grassi e ormoni. Il corpo umano contiene circa 25 mg di iodio. Della quantità totale di iodio nel corpo, più della metà si trova nella ghiandola tiroidea. Quasi tutto lo iodio contenuto in questa ghiandola è allo stato legato (sotto forma di ormoni) e solo circa l'1% è sotto forma di iodio. La ghiandola tiroidea è in grado di concentrare I-25 volte rispetto al suo contenuto nel plasma. La ghiandola tiroidea secerne gli ormoni tiroxina e triiodotironina. Una ghiandola tiroidea ipoattiva (ipotiroidismo) può essere associata a una diminuzione della sua capacità di accumulare ioni ioduro, nonché a una mancanza di iodio nella dieta (gozzo endemico). Con il gozzo endemico vengono prescritti preparati di iodio: (ioduro di potassio KI o ioduro di sodio NaI) in dosi corrispondenti al fabbisogno umano giornaliero di iodio (0,001 g di ioduro di potassio). Nelle aree in cui c'è una carenza di iodio, NaI o K viene aggiunto al sale da cucina per prevenire il gozzo endemico! (1-2,5 g per 100 kg). Con l'aumento dell'attività della ghiandola tiroidea (ipertiroidismo), a causa dell'eccessiva sintesi degli ormoni tiroidei, si osserva un tasso anormalmente aumentato dei processi metabolici. Con l'inefficacia di questi farmaci per il trattamento dell'ipertiroidismo, viene utilizzata una preparazione di iodio radioattivo 131 I, la cui radiazione distrugge i follicoli della tiroide e quindi riduce l'eccessiva sintesi di ormoni. Tutti gli elementi del gruppo VIIA sono fisiologicamente attivi e il cloro e lo iodio sono indispensabili per l'attività vitale dell'organismo. Il fluoro è considerato un elemento necessario per il normale funzionamento degli organismi viventi. Nel corpo, gli alogeni sono intercambiabili, con casi sia di sinergia che di antagonismo. 54. Aerosol Gli aerosol sono sistemi dispersi con un mezzo di dispersione gassosa. A seconda dello stato di aggregazione della fase dispersa, si distinguono le nebbie: aerosol con fase dispersa liquida; fumi, polveri - aerosol con fase solida dispersa; smog - aerosol con una fase dispersa mista. Le dimensioni delle particelle della fase dispersa degli aerosol, secondo la classificazione dei sistemi dispersi, vanno da 107 a 109 m Come altri sistemi dispersi, gli aerosol si ottengono con due metodi: condensazione e dispersione. metodo di condensazione La fase dispersa è ottenuta dalla fase vapore mediante il processo fisico di condensazione delle molecole in particelle di dimensione colloidale. Metodi di dispersione Le particelle di dimensioni colloidali si ottengono macinando aggregati più grandi. Gli aerosol hanno la capacità di diffondere la luce. Le particelle della fase dispersa degli aerosol non hanno un doppio strato elettrico, tuttavia, molto spesso le particelle della fase dispersa trasportano una carica elettrica. La carica si forma a causa dell'attrito o dell'adsorbimento di ioni di gas. Va notato che molto spesso le particelle di aerosol (piccole e grandi) portano una carica di segno opposto. La separazione delle particelle per dimensione in grandi volumi di aerosol per altezza può portare alla comparsa di un campo elettrico ad alta intensità. Pertanto, tra le nuvole si verifica una scarica elettrica: un fulmine. Gli aerosol sono sistemi cineticamente e aggregativamente instabili, poiché non esiste un doppio strato elettrico al confine di fase. Pertanto, gli aerosol coagulano a una velocità maggiore rispetto ai liosol. In medicina, gli aerosol vengono utilizzati nella terapia inalatoria, per proteggere la pelle danneggiata, la disinfezione. A volte la formazione di aerosol è estremamente indesiderabile. Aerosol pericolosi per la salute umana si formano nelle fonderie, nella ceramica e durante l'estrazione e la lavorazione di vari minerali (minerale, carbone, amianto, ecc.). Gli aerosol contenenti particelle di carbone causano malattie polmonari - antracosi, ossido di silicio (IV) - silicosi, amianto - asbestosi. Le malattie allergiche sono causate da aerosol formati da polline di piante, polvere generata durante la lavorazione di cotone, lino, canapa, ecc. Sospensioni di batteri, muffe e virus - aerosol microbiologici o batterici - sono una delle vie di trasmissione di malattie infettive: polmonari tubercolosi, influenza, malattie respiratorie acute. Gli aerosol generati durante la combustione del carburante, la cui fase dispersa è costituita da fuliggine, resine, ceneri e idrocarburi cancerogeni, hanno un effetto dannoso sul corpo umano. Lo smog è particolarmente pericoloso per la salute. Pertanto, la lotta contro le polveri e l’inquinamento atmosferico sta diventando sempre più importante. La purificazione dell'aria dagli aerosol si ottiene introducendo tecnologie senza sprechi: catturando le particelle della fase dispersa utilizzando filtri, cicloni (collettori di polveri centrifughi) e un campo elettrico ad alta tensione. 55. Emulsioni Le emulsioni sono sistemi microeterogenei in cui la fase dispersa e il mezzo di dispersione sono liquidi immiscibili. Le dimensioni delle particelle della fase dispersa - goccioline liquide - variano da 104 a 106 m. A seconda della concentrazione della fase dispersa, si distinguono le emulsioni: diluite, concentrate e altamente concentrate. A seconda della natura della fase dispersa e del mezzo di dispersione, ci sono: 1) emulsioni di un liquido non polare (DF) in un liquido polare (DS) - emulsioni dirette, dette emulsioni del primo tipo o emulsioni del tipo "olio / acqua" (O / W); 2) emulsioni di un liquido polare (DF) in uno non polare (DS) - emulsioni inverse, dette emulsioni del secondo tipo o emulsioni del tipo "acqua / olio" (W / O). Qui DF e DS sono rispettivamente la fase dispersa e il mezzo di dispersione, "acqua" è qualsiasi liquido polare, "olio" è non polare. Il tipo di emulsione può essere impostato: 1) misura della conducibilità elettrica; 2) miscelazione con un eccesso di liquido polare o non polare; 3) colorazione con coloranti idrosolubili o oleosolubili; 4) bagnando e stendendo una goccia di emulsione su una superficie idrofobica o idrofila. Le emulsioni, come altri sistemi dispersi, possono esserlo ottenuto con metodi di condensazione e dispersione. Le emulsioni come dispersioni grossolane sono sistemi cineticamente e aggregativamente instabili. Quando le goccioline della fase dispersa si scontrano, si fondono (coalescenza). Come risultato della coalescenza, l'emulsione si separa in due fasi liquide continue. Per aumentare la stabilità delle emulsioni, vengono utilizzati stabilizzanti - emulsionanti. Si tratta di tensioattivi che, a seguito dell'adsorbimento all'interfaccia, riducono la tensione interfacciale e formano una pellicola di adsorbimento meccanicamente resistente. Se l'emulsionante è un tensioattivo ionico, conferisce una carica elettrica dello stesso segno alle goccioline della fase dispersa e le goccioline si respingono. Il tipo di emulsione formata dipende dalle proprietà dell'emulsionante. Il mezzo di dispersione è sempre il liquido che meglio scioglie o bagna l'emulsionante. Come emulsionanti vengono utilizzati sali di acidi grassi superiori, esteri di acidi grassi superiori e alcoli polivalenti, ammine a catena lunga. Le emulsioni si trovano ampiamente in natura. Le emulsioni sono latte, panna, panna acida, burro, tuorlo d'uovo, succo di piante lattiginose, olio grezzo. In medicina trovano largo impiego le emulsioni contenenti sostanze medicinali: il primo tipo (O/W) per uso interno, il secondo tipo (W/O) per uso esterno. È noto che i grassi vegetali e animali vengono assorbiti meglio dall'organismo in forma emulsionata (latte). In questo caso, i derivati degli acidi colico e desossicolico agiscono come emulsionanti. A volte è necessario distruggere l'emulsione risultante. La rottura dell'emulsione è chiamata demulsificazione. La demulsificazione viene effettuata aumentando e diminuendo la temperatura, l'esposizione a un campo elettrico, la centrifugazione e l'aggiunta di elettroliti e sostanze speciali - demulsionanti. I demulsionanti sono tensioattivi con attività superficiale maggiore rispetto agli emulsionanti, ma non hanno la capacità di formare uno strato di adsorbimento meccanicamente forte. 56. Tensioattivi colloidali I tensioattivi colloidali sono sostanze che, con lo stesso solvente, a seconda delle condizioni, formano una vera e propria soluzione colloidale. Come già accennato, le molecole dei tensioattivi sono anfifiliche. Sono costituiti da gruppi non polari e polari. I radicali non polari, ad esempio le catene di idrocarburi, non hanno affinità per il solvente polare - acqua; per i gruppi polari è piuttosto elevata. Esiste un'interazione idrofobica (van der Waals) tra gruppi non polari. Con una lunghezza della catena di circa 1022 atomi di carbonio a causa delle interazioni idrofobiche dei radicali idrocarburici e della forte interazione dei gruppi polari con l'acqua, si associano molecole di tensioattivo e si formano le micelle. La concentrazione minima di un tensioattivo colloidale, a partire dalla quale si formano le micelle nella sua soluzione, è chiamata concentrazione micellare critica (CMC). La forma delle micelle risultanti dipende dalla concentrazione della soluzione. A basse concentrazioni di tensioattivo colloidale si formano micelle sferiche. Un aumento della concentrazione di una soluzione di tensioattivo colloidale porta prima ad un aumento del loro numero e quindi a un cambiamento di forma. A concentrazioni più elevate, invece delle micelle sferiche, si formano micelle cilindriche e lamellari. Il valore CMC dipende da vari fattori: la natura del tensioattivo colloidale, la temperatura e la presenza di impurità di sostanze estranee, in particolare elettroliti. La CMC può essere determinata dalle proprietà della soluzione, a seconda del numero e delle dimensioni delle particelle cineticamente attive, in particolare dai cambiamenti nella pressione osmotica, nella tensione superficiale, nella conduttività elettrica e nelle caratteristiche ottiche. Poiché durante la transizione "soluzione vera - soluzione colloidale" la dimensione delle particelle cineticamente attive (ioni, molecole, micelle) e il loro numero cambiano, sul grafico "proprietà - concentrazione" appare un punto di flesso corrispondente alla CMC. Una delle proprietà più importanti delle soluzioni di tensioattivi colloidali, per cui sono ampiamente utilizzate in vari settori dell'economia nazionale e in medicina, è la solubilizzazione. Il meccanismo di solubilizzazione consiste nella dissoluzione di sostanze non polari nel nucleo idrofobo delle micelle. Il fenomeno della solubilizzazione è ampiamente utilizzato in vari settori dell'economia nazionale: nell'industria alimentare, nell'industria farmaceutica (per ottenere forme liquide di sostanze medicinali). Nel sistema acqua-fosfolipidi, l'agitazione e l'agitazione formano micelle sferiche - liposomi. Le molecole di fosfolipidi formano una membrana a doppio strato nei liposomi, in cui i gruppi polari sono rivolti verso l'acqua e i gruppi non polari sono uno di fronte all'altro. I liposomi possono essere considerati un modello di membrane biologiche. Con il loro aiuto è possibile studiare la permeabilità delle membrane e l'influenza di vari fattori su di essa per vari composti. I liposomi sono ampiamente utilizzati per la somministrazione mirata di farmaci a determinati organi o aree interessate. I liposomi possono trasportare farmaci nelle cellule. Le membrane liposomiali sono utilizzate negli studi immunologici per studiare l'interazione tra anticorpi e antigeni. Autori: Drozdova M.V., Drozdov
▪ Psicologia Generale. Note di lettura ▪ Diritto del lavoro della Federazione Russa. Culla ▪ I soldi. Credito. Banche. Note di lettura
Pelle artificiale per l'emulazione del tocco
15.04.2024 Lettiera per gatti Petgugu Global
15.04.2024 L'attrattiva degli uomini premurosi
14.04.2024
▪ sezione del sito Manuale dell'Elettricista. Selezione dell'articolo ▪ articolo Studio, studio e studio. Espressione popolare ▪ articolo Bocchino e sigaretta. Messa a fuoco segreta
Homepage | Biblioteca | Articoli | Mappa del sito | Recensioni del sito www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 Vedi altri articoli sezione
Vedi altri articoli sezione 