
|
|
Appunti delle lezioni, cheat sheet
Anestesiologia e rianimazione. Appunti delle lezioni: in breve, il più importante
Elenco / Appunti delle lezioni, cheat sheet Sommario
Lezione numero 1. Il concetto di rianimazione La rianimazione è una branca della medicina clinica che studia i problemi di rivitalizzazione del corpo, sviluppando principi per la prevenzione delle condizioni terminali, metodi di rianimazione e terapia intensiva. I metodi pratici per rivitalizzare il corpo sono accomunati dal concetto di "rianimazione". La rianimazione (dal latino "revival" o "animazione") è un sistema di misure volte a ripristinare le funzioni vitali del corpo gravemente alterate o perse e rimuoverlo da uno stato terminale e dalla morte clinica. Misure efficaci di rianimazione sono il massaggio cardiaco indiretto e la ventilazione artificiale dei polmoni. Se sono inefficaci entro 30 minuti, viene accertata la morte biologica. La terapia intensiva è un insieme di misure utilizzate per il trattamento di condizioni gravi e pericolose per la vita e prevede l'uso di un'ampia gamma di misure terapeutiche, secondo le indicazioni, comprese le infusioni endovenose, la ventilazione artificiale prolungata dei polmoni, la stimolazione, i metodi di dialisi, ecc. Uno stato critico è l'impossibilità di mantenere l'integrità delle funzioni corporee a seguito di una disfunzione acuta di un organo o sistema, che richiede la sostituzione di farmaci o hardware-strumentali. Lo stato terminale è uno stato di confine tra la vita e la morte, un'estinzione reversibile delle funzioni corporee, comprese le fasi di preagonia, agonia e morte clinica. La morte clinica è una condizione terminale in cui non c'è circolazione sanguigna e respirazione, l'attività della corteccia cerebrale si interrompe, ma i processi metabolici sono preservati. Con la morte clinica, rimane la possibilità di una rianimazione efficace. La durata della morte clinica va da 5 a 6 minuti. La morte biologica è una cessazione irreversibile dei processi fisiologici negli organi e nei tessuti, in cui la rianimazione è impossibile. È stabilito da una combinazione di una serie di segni: assenza di movimenti spontanei, contrazioni del cuore e del polso nelle grandi arterie, respirazione, reazioni a stimoli dolorosi, riflesso corneale, massima dilatazione della pupilla e assenza della loro reazione alla luce. Segni affidabili dell'inizio della morte sono una diminuzione della temperatura corporea a 20 ° C, la comparsa di macchie da cadavere e rigor mortis muscolare. Lezione numero 2. Manipolazioni di base in terapia intensiva Puntura percutanea e cateterizzazione della vena principale (succlavia). Indicazioni: grandi volumi di terapia infusionale-trasfusionale, nutrizione parenterale, terapia di disintossicazione, terapia antibiotica endovenosa, sondaggio e contrasto del cuore, misurazione della CVP, impianto di un pacemaker, impossibilità di cateterizzazione delle vene periferiche. Controindicazioni: violazione del sistema di coagulazione del sangue, processo infiammatorio e purulento nel sito di puntura e cateterizzazione, trauma nella clavicola, sindrome della vena cava superiore, sindrome di Paget-Schretter. Strumentazione e accessori per puntura e cateterizzazione: ago da puntura, un set di cateteri in plastica, un set di conduttori, una siringa da 10 ml per iniezioni intramuscolari, forbici, un porta aghi, un ago chirurgico e una legatura di seta, un cerotto adesivo. Tecnica. Il cateterismo viene effettuato nel rispetto delle regole di asepsi e antisepsi, della lavorazione delle mani dell'operatore, del campo operatorio e dell'applicazione di materiale sterile. La posizione del paziente è orizzontale sulla schiena con le braccia portate al corpo e il bavero della testa nella direzione opposta. Viene utilizzata l'anestesia locale: soluzione di novocaina allo 0,5-1%. La puntura viene eseguita meglio a destra, poiché quando si perfora la vena succlavia sinistra, c'è il pericolo di danneggiare il dotto linfatico toracico. Punto di puntura - sul bordo del terzo interno e medio della clavicola 2 cm sotto di essa. L'ago viene fatto passare lentamente con un angolo di 45° rispetto alla clavicola e di 30-40° rispetto alla superficie del torace tra la clavicola e la 15a costola in direzione del bordo superiore dell'articolazione sternoclavicolare. Quando si passa l'ago, lo stantuffo della siringa viene periodicamente stretto per determinare se entra nella vena e la novocaina viene iniettata lungo l'ago. Quando si perfora una vena, a volte c'è una sensazione di fallimento. Dopo essere entrati nella vena, la siringa viene scollegata dall'ago e la cannula viene chiusa con un dito. Quindi un conduttore viene inserito attraverso l'ago per una lunghezza di 20-6 cm e l'ago viene rimosso. Un catetere del diametro appropriato viene fatto passare attraverso il conduttore e, insieme al conduttore, viene inserito nella vena di 8-XNUMX cm, dopodiché il conduttore viene accuratamente rimosso. Per verificare la posizione corretta del catetere, viene attaccata una siringa e vi vengono aspirati 2-3 ml di sangue, dopodiché viene posizionato un tappo o viene avviata la terapia per infusione. Il catetere viene fissato alla pelle con una legatura di seta. Per fare questo, viene praticata una manica di cerotto adesivo sul catetere a 3-5 mm dalla pelle, su cui è legata la seta, quindi passata attraverso le orecchie del catetere e legata di nuovo. Dopo aver fissato il catetere, il sito di puntura viene chiuso con un adesivo asettico. Complicanze: puntura dell'arteria succlavia, embolia gassosa, puntura della cavità pleurica, danno al plesso brachiale, danno al dotto linfatico toracico, danno alla trachea, al gozzo e alla tiroide, suppurazione nel sito della puntura. 1. Tracheostomia Indicazioni: ostruzione della laringe e della trachea superiore per ostruzione da tumore o corpo estraneo, paralisi e spasmo delle corde vocali, grave gonfiore della laringe, distress respiratorio acuto, aspirazione del vomito, prevenzione dell'asfissia in gravi lesioni toraciche. Strumenti: 2 bisturi, 2 pinzette anatomiche e chirurgiche, diverse pinze emostatiche, un elevatore, una sonda scanalata, 2 uncini affilati smussati e 1 a dente singolo, dilatatore Trousseau o Deschamps, aghi chirurgici con porta aghi. attrezzatura Il paziente giace sulla schiena, un rullo sotto le spalle, la testa è gettata all'indietro. Se il paziente è in stato di asfissia, il rullo viene posizionato solo all'ultimo momento, prima di aprire la trachea. L'anestesia per infiltrazione locale viene eseguita con una soluzione allo 0,5-1% di novocaina con l'aggiunta di adrenalina. Nell'asfissia acuta è possibile operare senza anestesia. Punti di identificazione: l'angolo della cartilagine tiroidea e il tubercolo dell'arco della cartilagine cricoidea. Un'incisione della pelle, del tessuto sottocutaneo e della fascia superficiale viene praticata dal bordo inferiore della cartilagine tiroidea all'incisura giugulare rigorosamente lungo la linea mediana del collo. La vena mediana del collo viene retratta o legata, trovando una linea bianca, lungo la quale i muscoli vengono spinti in modo smussato e l'istmo della tiroide è esposto. I bordi dell'incisione vengono allontanati con un dilatatore Trousseau, si applicano legature sul bordo della ferita e si inserisce con cura la cannula tracheostomica, assicurandosi che la sua estremità entri nel lume della trachea. La ferita chirurgica viene suturata. Il tubo viene fissato al collo del paziente con una stecca di garza, precedentemente legata alla protezione del tubo. Inserire la camera d'aria nella camera d'aria. 2. Conicotomia Il paziente viene posto sulla schiena con un rullo trasversale a livello delle scapole. La testa del paziente è inclinata all'indietro. Dopo aver trattato la pelle sulla superficie anteriore del collo con una soluzione antisettica, la laringe viene fissata con le dita sulle superfici laterali della cartilagine tiroidea e lo spazio tra la tiroide e la cartilagine cricoidea, dove si trova il legamento a forma di cono, è provato. In anestesia locale per infiltrazione con bisturi appuntito, viene praticata un'incisione cutanea trasversale lunga circa 2 cm, il legamento conico viene palpato e sezionato o perforato. L'eventuale cannula tracheostomica di diametro adeguato viene inserita nel foro ricavato e fissata con una fascia di garza attorno al collo. In assenza di cannula, può essere sostituita da un pezzo di tubo di gomma o plastica di diametro e lunghezza adeguati. Per evitare che questo tubo scivoli nella trachea, la sua estremità esterna viene forata trasversalmente a una distanza di 2 cm dal bordo e fissata con una striscia di garza. Il conicotomo è una cannula per tracheostomia in metallo di piccolo diametro con un mandrino perforante al suo interno. Dopo la dissezione della pelle sopra il legamento a forma di cono, viene perforato con un conicotomo, il mandrino viene rimosso e la cannula viene posizionata in una posizione che garantisca il libero flusso d'aria nella trachea e fissata. In casi estremi, con ostruzione dell'ingresso della laringe e una forte violazione delle vie aeree, può essere ripristinato iniettando 1-2 aghi spessi con un diametro interno di 2-2,5 mm nella trachea nella linea mediana al di sotto del livello di la cartilagine tiroidea. Gli aghi vengono inseriti ad angolo acuto rispetto all'asse tracheale, a volte senza anestesia locale, ad una profondità di 1-1,5-2 cm. . 3. Puntura della cavità pleurica Indicazioni: forte mancanza di respiro a causa della compressione dei polmoni da parte di un massiccio versamento con pleurite o idrotorace, nonché aria con pneumotorace valvolare. attrezzatura La puntura viene eseguita in posizione seduta, in condizioni asettiche. Per l'anestesia del sito di puntura viene utilizzata una soluzione allo 0,5% di novocaina. Per la puntura viene utilizzato un ago spesso collegato a un tubo di gomma. La puntura viene eseguita lungo il bordo superiore della costola, poiché i vasi intercostali si trovano lungo il bordo inferiore. La penetrazione dell'ago nella cavità pleurica è percepita come un "fallimento nel vuoto". L'aspirazione di liquido lungo l'ago conferma che l'estremità dell'ago si trova nella cavità pleurica. Ogni volta che una siringa riempita viene separata dal tubo di gomma, quest'ultimo deve essere bloccato con un morsetto emostatico per evitare che l'aria atmosferica venga aspirata nella cavità pleurica. Alla fine dell'aspirazione, viene applicata una benda asettica sul sito della puntura. Complicazioni: lesioni all'arteria intercostale, vasi del diaframma del polmone, puntura dello stomaco o dell'intestino. Intubazione tracheale. Indicazioni: restringimento della laringe, respirazione patologica, insufficienza respiratoria acuta, coma II e III grado, alto rischio di aspirazione durante interventi chirurgici sugli organi del torace e della cavità addominale, testa e collo, nelle malattie della faringe, della laringe e della trachea (infiammazione acuta, cancro, tubercolosi e così via). Un laringoscopio viene utilizzato per l'intubazione. È composto da un manico e una lama. Le lame curve più utilizzate, in quanto più fisiologiche. Le lame dritte sono utilizzate con un collo lungo. La preparazione per l'intubazione comprende il controllo dell'attrezzatura e il corretto posizionamento del paziente. Il tubo endotracheale deve essere controllato. Il bracciale viene testato gonfiandolo con una siringa da 10 ml. Controllare il contatto della lama con l'impugnatura del laringoscopio e la lampadina. È necessario assicurarsi che l'aspirazione sia pronta in caso di espettorato improvviso, sanguinamento o vomito. Il successo dell'intubazione dipende dalla posizione corretta del paziente. La testa del paziente dovrebbe essere a livello del processo xifoideo dell'intubatore. Un moderato sollevamento della testa con estensione simultanea dell'articolazione atlanto-occipitale crea una posizione migliore per l'intubazione. La preparazione per l'intubazione include anche la pre-ossigenazione obbligatoria. Il laringoscopio viene tenuto nella mano non dominante (per la maggior parte delle persone, questa è la sinistra) e la bocca del paziente viene spalancata con l'altra mano. La lama viene inserita lungo il lato destro dell'orofaringe, evitando danni ai denti. La lingua è spostata a sinistra e la lama è sollevata fino all'arco della faringe. La punta di una lama curva viene inserita nella vallecula (una fossa situata sulla superficie anteriore dell'epiglottide), mentre la punta di una lama dritta dovrebbe sollevare direttamente l'epiglottide. L'impugnatura del laringoscopio viene spinta in alto e in avanti perpendicolarmente alla mandibola fino a quando non si vedono le corde vocali. La dipendenza dai denti dovrebbe essere evitata. Il tubo endotracheale viene prelevato con la mano destra e fatto passare attraverso la glottide aperta sotto controllo visivo. Il bracciale deve essere posizionato nella trachea superiore, ma sotto la laringe. Il laringoscopio viene rimosso dalla bocca, sempre per evitare danni ai denti. Immediatamente dopo l'intubazione, l'auscultazione viene eseguita sui polmoni su entrambi i lati (poiché è possibile far passare un tubo in un bronco) e nell'epigastrio (per escludere l'intubazione esofagea). Se il tubo è nella trachea, viene fissato in posizione con nastri e il bracciale viene gonfiato. La cuffia deve essere posizionata al di sopra del livello della cartilagine cricoidea, poiché una lunga permanenza nella laringe può portare a raucedine nel periodo postoperatorio. Complicanze: intubazione dell'esofago, bronco, localizzazione della cuffia nella laringe, danno ai denti, lussazione della mascella inferiore, laringospasmo, disturbi dei riflessi (ipertensione, tachicardia, aumento della pressione intracranica), lesioni delle vie respiratorie, infiammazione, ecc. 4. Puntura e cateterizzazione dello spazio epidurale Indicazioni: sindrome del dolore grave, interventi chirurgici, analgesia postoperatoria. Il livello di impostazione del blocco epidurale dipende da quale organo deve essere anestetizzato. La tabella n. 1 mostra esempi di "organi bersaglio" per la puntura epidurale. Tabella 1 Livelli della colonna vertebrale e "organi bersaglio"
Strumentazione: aghi per anestesia, un ago speciale per la perforazione dello spazio epidurale, una siringa per campioni, un catetere, un tappo, sfere filtranti, tovaglioli, nastro adesivo e guanti sterili. La posizione del paziente è seduto o sdraiato su un fianco. In questo caso, le ginocchia e il mento dovrebbero essere avvicinati il più possibile al petto. Pertanto, viene creata la massima flessione della colonna vertebrale, alla quale aumenta l'angolo tra i processi spinosi delle vertebre adiacenti e viene facilitato l'approccio al legamento giallo. In condizioni asettiche e in anestesia locale con una soluzione allo 0,5% di novocaina, viene eseguita una puntura dello spazio epidurale. L'ago viene iniettato rigorosamente perpendicolarmente, ma con l'osteocondrosi è possibile un angolo di inclinazione o durante la puntura nella regione medio-toracica. Quando l'ago entra nello spessore dei legamenti, il mandrino viene rimosso da esso e viene attaccata una siringa con liquido. L'ulteriore avanzamento dell'ago viene effettuato lentamente e senza intoppi premendo sullo stantuffo della siringa. A causa della notevole resistenza dei legamenti, il liquido non può lasciare la siringa. La siringa è scollegata e il catetere è inserito a 5-7 cm, non dovrebbe esserci resistenza. L'ago viene rimosso e il conduttore viene fissato alla schiena con del nastro adesivo, portandolo sulla superficie anteriore del torace. La spina con il filtro è fissata al conduttore. Viene iniettato un anestetico. Successivamente, viene determinato il livello di anestesia cutanea. Complicanze: disturbi respiratori ed emodinamici, intossicazione, danno alla dura madre, complicanze neurologiche, peridurite. 5. Puntura lombare Indicazioni: presenza di sindrome meningea, elevata pressione intracranica, diagnosi differenziale tra ictus ischemico ed emorragico, trauma cranico, tumori del midollo spinale. Controindicazioni: la presenza di un processo infiammatorio o purulento nel sito di puntura, diatesi emorragica, tumore della fossa cranica posteriore, lussazione del tronco, stato terminale del paziente, con confini sfocati del nervo ottico. Il punto di puntura si trova tra il 3° e il 4° processo spinoso delle vertebre lombari. La manipolazione viene eseguita in condizioni asettiche, in anestesia locale. L'ago va perpendicolare all'ombelico. La posa del paziente è la stessa della puntura epidurale. Con il passaggio di tre legamenti (interspinoso esterno ed interno, legamenti gialli), c'è una sensazione di caduta, il mandrino viene rimosso dall'ago e appare il liquido cerebrospinale. Dopo aver preso il liquido cerebrospinale per l'esame, viene inserito un mandrin e l'ago viene rimosso, viene applicato un adesivo asettico. A differenza della puntura epidurale, si verifica un danno alla dura madre. Il liquido cerebrospinale è limpido, incolore, pressione 100-200 mm di acqua. Art., contenuto proteico 0,33 g/l, HC - 1003-1008, pH = 7,35-7,40, contenuto zuccherino pari alla metà della glicemia (normalmente 2-3 mmol/l), cloruri - 110-120 mmol/l, il numero di cellule fino a 5 linfociti. Complicanze: epidurite, dislocazione del cervello nel forame magno, disturbi neurologici. Lezione n. 3. Disturbi acuti della coscienza La coscienza è la più alta forma di riflessione della realtà, che è un insieme di processi mentali che consentono a una persona di navigare nel mondo che lo circonda, il tempo, la propria personalità, che assicura il suo comportamento. La compromissione della coscienza è il nome generico per i disturbi dell'attività integrale del cervello, espressi in una violazione della capacità di percepire, comprendere e rispondere adeguatamente all'ambiente, navigarlo, ricordare gli eventi attuali, stabilire un contatto vocale ed eseguire espedienti arbitrari atti comportamentali. Esistono varie opzioni per l'oppressione della coscienza (stupore, stupore, coma di varie profondità), nonché per la confusione acuta (stato delirante o encefalopatia metabolica). Il grado di alterazione della coscienza varia da lieve confusione al coma e non ci sono chiare transizioni tra questi stati. In pratica, il grado di alterazione della coscienza è determinato dalla reazione del paziente agli stimoli. Lo stupore è una forma di coscienza alterata, caratterizzata da letargia, rallentamento e difficoltà nel corso dei processi mentali, rapido esaurimento dell'attenzione, aumento della soglia per la percezione degli stimoli esterni, ma pur mantenendo un contatto verbale limitato. Lo stupore si basa su una violazione dell'attenzione, ovvero la capacità di selezionare le informazioni necessarie e coordinare le risposte in modo tale che la sequenza logica di pensieri e azioni non venga violata. Le cause più comuni di stupore sono disordini metabolici e tossici, ma a volte si osserva anche nelle lesioni focali della corteccia, in particolare nel lobo parietale destro. In tali pazienti, è possibile ottenere una risposta monosillabica o l'attuazione delle istruzioni più semplici solo dopo un appello persistente ad esso o una stimolazione aggiuntiva. Con un'ulteriore oppressione della coscienza, la possibilità di contatto vocale viene persa e si sviluppa il sopor. Il sopor è uno stato di profonda depressione della coscienza con la perdita della possibilità di contatto con il paziente, ma il mantenimento di reazioni protettive coordinate e l'apertura degli occhi del paziente in risposta al dolore, al suono o ad altri stimoli. Il paziente non può essere completamente svegliato anche con l'aiuto di stimoli dolorosi, giace con gli occhi chiusi. La reazione alle istruzioni verbali è debole o completamente assente, è impossibile ottenere una parola o un suono di risposta dal paziente. Con un'ulteriore oppressione della coscienza, si sviluppa il coma. Il coma è uno stato inconscio caratterizzato da insensibilità agli stimoli esterni. Questo è uno stato di depressione pericolosa per la vita delle funzioni del sistema nervoso centrale e disturbi della regolazione delle funzioni vitali. Il coma può essere causato da diversi disturbi metabolici e danni strutturali. Fisiopatologia del coma Molto spesso, il coma è dovuto a: 1) processi intracranici con danno al tessuto cerebrale (ematoma, ascesso, tumore, epilessia); 2) lesioni infettive del sistema nervoso centrale (meningite, encefalite); 3) danno tossico al cervello (avvelenamento da alcol, funghi, droghe); 4) insufficienza del flusso sanguigno cerebrale (conseguenze di asistolia, attacchi di Morgagni-Adams-Stokes); 5) cause metaboliche (alterato equilibrio idro-elettrolitico, metabolismo glucidico, equilibrio acido-base, insufficienza renale ed epatica); 6) disturbo dell'equilibrio termico (colpo di calore, ipotermia). classificazione com Secondo l'eziologia, si distingue il seguente coma. 1. Primarie o intracraniche: neoplasie cerebrali traumatiche, vascolari, infettive, epilettiche, metaboliche e ipossiche. 2. Secondario o extracranico: grave lesione cerebrale. In base alla gravità del coma sono classificati nel modo seguente. 1. Coma moderato, quando il paziente ha una reazione a stimoli dolorosi. In risposta a loro, possono comparire movimenti di flessione ed estensore. Ma le reazioni motorie protettive non sono coordinate. Il dolore del paziente non apre gli occhi. I riflessi pupillari e corneali sono generalmente preservati, i riflessi addominali sono depressi e i riflessi tendinei sono variabili. Aumento dei riflessi dell'automatismo orale e dei riflessi patologici del piede. 2. Coma profondo. È caratterizzato dall'assenza di qualsiasi reazione a qualsiasi stimolo esterno, vari cambiamenti nel tono muscolare, diminuzione o assenza di riflessi senza midriasi bilaterale, disturbi della respirazione spontanea e dell'attività cardiovascolare. 3. Il coma terminale è determinato da midriasi fissa bilaterale, atonia muscolare diffusa, gravi violazioni delle funzioni vitali, disturbi del ritmo e della frequenza respiratoria, apnea, tachicardia grave; la pressione sanguigna è critica o non determinata. Visita di un paziente in coma Il piano di esame del paziente è il seguente. 1. Valutazione dello stato funzionale dell'apparato respiratorio e cardiovascolare. 2. Esami clinici generali, tenendo conto dei dati di laboratorio, che consentono di valutare la patologia extracranica. 3. Esame neurologico. Studi di laboratorio: analisi del sangue clinica generale (segni di un'infezione batterica o virale); ematochimici: glucosio, fattori della coagulazione (tempo di coagulazione, protrombina, fibrinogeno, APTT, antitrombina III, test di paracoagulazione, conta piastrinica), urea, creatinina, bilirubina, ALT, AST, osmolarità, elettroliti (K, Na, Mg, Ca ); screening tossicologico di sangue, urina, contenuto gastrico. Studi strumentali: radiografia del cranio e del rachide cervicale. La consultazione di un neuropatologo (neurochirurgo) determina l'ulteriore direzione della ricerca diagnostica: risonanza magnetica o computerizzata; EEG; dopplerografia ad ultrasuoni. La puntura lombare con analisi del liquido cerebrospinale è obbligatoria dopo: 1) consultazione di un oftalmologo ed esclusione dei segni di aumento della pressione intracranica - edema ed elevazione dei dischi ottici; 2) esclusione dei segni di ernia cerebrale. Si distinguono le seguenti localizzazioni dell'ernia cerebrale. Ernia diencefalica, che si verifica quando la localizzazione sopratentoriale mediale è danneggiata e consiste nello spostamento del diencefalo attraverso l'incavo del tenone cerebellare. Questo processo chiama: 1) respirazione di Cheyne-Stokes; 2) costrizione delle pupille pur mantenendo la loro reazione alla luce; 3) paralisi dello sguardo in alto; 4) cambiamenti nello stato mentale. L'ernia delle parti mediali del lobo temporale, che si manifesta quando è interessata la localizzazione sovratentoriale laterale, consiste nello spostamento delle parti mediali del lobo temporale attraverso l'incavo del tenone cerebellare. La pressione risultante sulle strutture del mesencefalo si manifesta con: 1) coscienza alterata; 2) una pupilla allargata e non reattiva sul lato dell'ernia, che è associata alla compressione del III nervo cranico; 3) emiparesi sul lato opposto. I movimenti dei bulbi oculari non sono sempre disturbati. Ernia delle tonsille del cervelletto, che è causata dalla pressione che spinge la parte inferiore del cervelletto attraverso il forame magno, che porta alla compressione del midollo allungato. Causa: 1) coscienza alterata; 2) violazioni del ritmo della respirazione o dell'apnea. trattamento Il trattamento deve essere il più aggressivo possibile e mirato principalmente a garantire un'adeguata ossigenazione e stabilizzazione dell'emodinamica centrale. Se viene mantenuta la respirazione spontanea, si raccomanda l'insufflazione di ossigeno umidificato attraverso una maschera o un catetere nasale. In assenza di respirazione spontanea o in presenza di respirazione patologica si esegue l'intubazione tracheale ed il paziente viene trasferito in ventilazione polmonare artificiale. Con l'agitazione psicomotoria e la reazione alla ventilazione meccanica, è necessario l'uso di sedativi (benzodiazepine, butirrofenoni). La stabilizzazione dell'emodinamica centrale è la normalizzazione della pressione sanguigna. In uno stato ipertensivo, la pressione sanguigna deve essere ridotta, ma non più del 10% dell'originale all'ora. Un buon effetto è l'uso di nitroprussiato di sodio o solfato di magnesio. Con l'ipotensione vengono utilizzati dopamina, dopamina, dobutrex e farmaci ormonali. In assenza di dati anamnestici e di una diagnosi poco chiara, viene eseguita la terapia ex juvantibus (una risposta positiva all'esposizione al farmaco, da un lato, dà la chiave della diagnosi, dall'altro, aiuta a guadagnare tempo per evitare cambiamenti irreversibili ): 1) tiamina - 100 mg per via endovenosa, successivamente - 100 mg per via intramuscolare (soprattutto se c'è una storia di alcolismo, quando si determinano alte concentrazioni di etanolo nel sangue); 2) glucosio: una soluzione al 40% di 60 ml per via endovenosa (con un livello sconosciuto di glucosio nel plasma o a un livello inferiore a 3 mmol / l); 3) naloxone - 0,4-1,2 mg per via endovenosa, frazionata, ripetutamente, specialmente in presenza di "segni di oppiacei" (tracce di iniezioni endovenose, pupille strette, disturbi respiratori centrali); 4) anexat (flumazenil) - 0,2 mg per 30 secondi, nel minuto successivo, iniettare altri 0,3 mg, ogni minuto successivo - 0,5 mg fino a una dose totale di 3 mg. In assenza di un effetto, si può presumere che è improbabile che il coma sia causato da farmaci benzodiazepinici; 5) in caso di avvelenamento o sovradosaggio con un farmaco o una sostanza nota, deve essere somministrato un antidoto appropriato (se esiste la possibilità di terapia antidoto). Controllo delle convulsioni. L'ipossia cerebrale in arrivo può causare lo stato epilettico. Gli episodi convulsivi possono anche derivare dalla tossicità dei farmaci anticolinesterasici. Per il trattamento, il farmaco di scelta sono le benzodiazepine: midazolam (Dormikum) 5 mg per via endovenosa in frazioni fino a una dose totale di 30 mg g, seduxen (Relanium) in frazioni fino a 10 mg, per via endovenosa. Con lo sviluppo dello stato epilettico, in seguito alle benzodiazepine, è necessario somministrare fenitoina in una dose totale di 1-1,5 g ad una velocità di 50 mg/min. Se c'è resistenza a questi farmaci, è necessario somministrare fenobarbital (tiopentale) in una dose totale fino a 1000 mg mediante infusione endovenosa lenta (è necessario il controllo della respirazione e della pressione sanguigna). Per le crisi epilettiche ricorrenti è necessaria l'anestesia generale. Nei pazienti con segni EEG o tomografia computerizzata di un focolaio epilettico (emorragia, neoplasia, grande infarto ischemico, ascesso, ecc.) e crisi epilettiche episodiche, è necessaria una terapia di mantenimento con fenitoina - 300 mg una volta al giorno per os. Mantenimento della normotermia. È necessario il controllo della temperatura rettale: la sua diminuzione sotto i 34 °C si sviluppa con ipotermia, overdose di sonniferi e sedativi, ipotiroidismo, malattia di Wernicke. In questi casi è necessario riscaldare gradualmente il paziente fino alla temperatura di 36°C. I pazienti con ipotermia e mancanza di funzioni vitali sono soggetti a RCP, poiché la bassa temperatura riduce la richiesta di ossigeno nel cuore e nel cervello e contribuisce a un migliore esito delle misure di rianimazione (ad eccezione dei casi accompagnati da iperkaliemia). La presenza di febbre nei pazienti in coma richiede una ricerca attiva e il trattamento delle complicanze infettive. La presenza di segni di meningismo può indicare la presenza sia di meningite batterica che di sanguinamento subaracnoideo (anche se devono trascorrere circa 12 ore dall'inizio del sanguinamento all'irritazione meningea chimica). Un'altra causa di febbre può essere un ascesso intracranico o un ematoma subdurale. Se si sospetta una meningite batterica, è necessario eseguire una puntura lombare (analisi del liquido cerebrospinale) e una tomografia computerizzata per determinare i segni di un aumento della pressione intracranica. Prevenire l'aspirazione del contenuto gastrico. La necessità di lavanda gastrica in caso di avvelenamento e overdose di farmaci e, quindi, l'installazione di un tubo gastrico aumenta il rischio di rigurgito del contenuto gastrico (a causa del rilassamento dello sfintere gastroesofageo). Pertanto, prima di inserire un tubo gastrico, è necessario eseguire l'intubazione tracheale con una cuffia sigillante, che rappresenta il miglior mezzo per proteggere le vie aeree. Trattamento urologico. Per controllare la diuresi, è necessario installare un catetere di Foley, garantire condizioni asettiche e condurre una terapia antimicrobica per prevenire la sepsi urogenitale. Ridotta pressione intracranica. Un aumento della pressione intracranica è un'emergenza clinica che richiede l'attuazione di misure adeguate volte a ridurla, evitando danni secondari al cervello dovuti alla compressione dei suoi tessuti o alla diminuzione del flusso sanguigno cerebrale. L'esecuzione delle misure diagnostiche di cui sopra consente di stabilire le cause dell'aumento dell'ICP e, di conseguenza, le misure chiave mirano alla sua eliminazione (trattamento chirurgico e conservativo). Iperventilazione per mantenere i livelli di pCO2 25-30 mmHg Arte. (livelli inferiori a 25 mm Hg possono causare una significativa diminuzione del flusso sanguigno cerebrale, portando a ischemia cerebrale). Limitazione dell'assunzione di liquidi. È necessario escludere soluzioni contenenti acqua libera (glucosio al 5%). La soluzione isotonica di NaCl, necessaria per mantenere l'osmolarità del sangue, deve essere somministrata a metà della dose. Introduzione di sostanze osmoticamente attive. Il mannitolo viene somministrato a una dose di 1-2 g/kg per 10-20 minuti, quindi a una dose di mantenimento di 0,05-0,3 g/kg ogni 6 ore.Inoltre, la furosemide viene somministrata per ridurre in modo più efficace l'ICP. È necessario un rigoroso controllo della terapia per prevenire complicazioni: diminuzione del volume intravascolare, ipotensione, ipernatriemia, ipocalcemia, ipokaliemia, nonché sindrome da risposta e rottura delle vene corticali nell'ematoma subdurale. Una misura importante per prevenire le complicanze è mantenere la pressione arteriosa sistolica a 100-110 mm Hg. Arte. I farmaci portano anche a una diminuzione dell'ICP. L'uso di miorilassanti aiuta a ridurre l'ICP durante la ventilazione meccanica (blocco dell'aumento della pressione venosa intratoracica durante la ventilazione meccanica), ma sono consigliati solo per un tempo molto breve. L'uso di corticosteroidi è efficace nei casi di aumento della pressione intracranica dovuta a neoplasia o ischemia focale (ictus) del cervello. L'efficacia dei corticosteroidi nel trattamento dell'aumento della pressione intracranica dovuta a traumi e ischemia cerebrale generale non è stata dimostrata. È importante ricordare che i glucocorticoidi possono causare un aumento dei livelli di glucosio nel sangue e, di conseguenza, aumentare l'ischemia cerebrale. Tipi di com Il coma ipoglicemico si verifica con un sovradosaggio di insulina nel trattamento del diabete mellito o con una limitazione dell'assunzione di carboidrati. Lo sviluppo del coma è preceduto da bulimia, irritabilità, paura. A volte si notano diplopia, allucinazioni, convulsioni toniche e cloniche. L'eccitazione è sostituita dall'adynamia e viceversa. Il paziente perde rapidamente conoscenza ed è coperto di sudore. La pelle è umida e pallida, il respiro è superficiale, ritmico. A volte l'ipoglicemia spontanea si osserva negli atleti e dopo un intenso sforzo fisico. Se il coma ipoglicemico dura più di 3 ore, è possibile lo sviluppo di lesioni organiche grossolane del sistema nervoso centrale. È importante abbassare il livello di zucchero nel sangue al di sotto di 3 mmol. Non c'è zucchero o acetone nelle urine. Trattamento. Immettere immediatamente il 20-40% di glucosio alla dose di 20-30 ml per via endovenosa come bolo. Successivamente, viene eseguito il controllo dello zucchero nel sangue e nelle urine. Coma diabetico, o iperglicemico, quando il livello di glucosio nel sangue è notevolmente aumentato. Il coma è preceduto da sonnolenza, sete, anoressia, nausea, vomito, mal di testa. In laboratorio si determinano iperglicemia, acidosi metabolica, zucchero e acetone sono presenti nelle urine (non sempre). Il viso è pallido e iperemico, le mucose sono secche, anche la pelle è secca e il suo turgore è ridotto. I bulbi oculari sono infossati, l'odore di acetone dalla bocca è possibile. La respirazione è rara patologica. L'emodinamica è disturbata: tachicardia, ipotensione arteriosa, toni cardiaci attutiti. Trattamento. Eliminazione dell'ipovolemia con l'aiuto della somministrazione endovenosa di cloruro di sodio in un volume di 3-5 litri al giorno. La terapia insulinica consiste nell'introduzione di insulina a breve durata d'azione 6-10 UI all'ora con una pompa per infusione. Con una diminuzione della glicemia a 11-13 mmol / l, la dose di insulina viene ridotta a 4-8 unità all'ora e un'infusione di glucosio al 5% inizia ad evitare uno stato ipoglicemico. Il coma tireotossico è raro, ma va considerato se, con tachicardia grave, non sono presenti segni tipici di insufficienza miocardica emodinamica e se è presente insufficienza cardiaca energetico-dinamica. La presenza di struma, abbagliamento oculare e tremore di solito attira anche l'attenzione su questa possibilità. Il quadro clinico dovrebbe essere integrato dalla raccolta di dati anamnestici, poiché non è possibile eseguire studi che confermino la diagnosi (metabolismo basale, iodio radioattivo). L'intossicazione da alcol si manifesta con l'odore di alcol dalla bocca, uno stato delirante, ansia, vomito e una faccia gonfia. La respirazione è lenta, il polso è accelerato, le pupille sono dilatate. Nei pazienti con alcolismo, il delirio si sviluppa 2-3 giorni dopo la sospensione dell'alcol. Lo sviluppo del delirio è prevenuto dall'uso di benzodiazepine quando compaiono segni premonitori (febbre, tremore, tachicardia, ipertensione). Con lo sviluppo del delirio, i farmaci di scelta sono: nei giovani, diazepam (somministrazione endovenosa), e nei pazienti anziani e pazienti con funzionalità epatica compromessa, lorazepam, ma se necessario è preferibile un effetto rapido al diazepam (5 mg ogni 5 minuti fino al raggiungimento dell'effetto). Sono descritti casi in cui è necessario somministrare 2640 mg di diazepam per il trattamento di un grave stato di delirio. Inoltre, vengono utilizzati bloccanti e clonidina. Anche in queste condizioni è utile l'uso di antipsicotici (aloperidolo, droperidolo). Con il coma apoplessico (si sviluppa con vari processi intracerebrali), il sintomo principale è l'emiplegia o la paralisi dei singoli gruppi muscolari. La paralisi compare quando gli occhi e la testa sono rivolti nella direzione opposta a quella paralizzata: "il paziente guarda la lesione nel cervello". La bocca è inclinata verso il lato sano: "fumare la pipa dal lato malato". Sul lato emiplegico, l'arto sollevato cade rapidamente e pesantemente sul letto, mentre l'arto sano ritorna lentamente nella sua posizione originale. Il coma con il morbo di Addison (coma surrenale, che spesso si sviluppa con tubercolosi surrenale, traumi, malattie infettive) è raro. Il sintomo principale è la pressione sanguigna patologicamente bassa, spesso non misurabile. Insieme al collasso, questo sintomo è causato da cambiamenti nel metabolismo dei carboidrati (ipoglicemia), squilibrio elettrolitico e metabolismo dell'acqua. All'improvviso c'è un pallore acuto, sudore freddo. L'eccitazione viene rapidamente sostituita dall'adinamia, quindi il paziente perde conoscenza. Appare l'acrocianosi, la pelle diventa marmorizzata. Sulla pelle della schiena e delle estremità, la pigmentazione si trova sotto forma di macchie scure e un'eruzione petecchiale rosso brillante. I suoni del cuore sono attutiti. Disidratazione e oliguria si manifestano rapidamente. Nel sangue, acidosi metabolica, ipoglicemia e aumento dell'azoto residuo. Il trattamento consiste nella rapida introduzione di glucocorticosteroidi alla dose di 1 mg / kg. La dose può essere aumentata di 2-3 volte. Una dose simile viene somministrata per via intramuscolare. Per combattere la disidratazione, viene somministrata una soluzione isotonica di cloruro di sodio e quindi glucosio. Lezione numero 4. Rianimazione cardiopolmonare La rianimazione cardiopolmonare (RCP) è un complesso di misure chirurgiche e terapeutiche eseguite in assenza di lesioni potenzialmente letali e volte a ripristinare e supportare la funzione del sistema cardiorespiratorio. Indicazioni per la rianimazione cardiopolmonare: eseguita in pazienti senza polso efficace sulle arterie carotidi o polso debole e filiforme, in stato di incoscienza e (o) in assenza di movimenti respiratori efficaci. I casi più comuni di arresto cardiaco primario e insufficienza respiratoria primaria. Controindicazioni: traumi incompatibili con la vita, stadi terminali di malattie incurabili e morte biologica. Principi di base Gli sforzi primari nella RCP sono volti a: 1) compressione toracica; 2) soffiare aria nei polmoni e ventilazione; 3) preparazione e somministrazione di farmaci; 4) installazione e manutenzione dell'accesso endovenoso; 5) attività specialistiche (defibrillazione, installazione di pacemaker, intubazione tracheale). Pertanto, per completare l'intero ambito delle attività, sono necessarie 4 persone e un team leader. Una persona dovrebbe essere responsabile della RCP. Questa persona dovrebbe integrare tutte le informazioni disponibili e dare priorità all'impatto. Deve monitorare il monitor ECG, l'uso di farmaci e garantire che le azioni degli altri membri del team siano corrette. Dovrebbe essere rimosso dall'esecuzione di procedure che sminuiscono il ruolo di leadership. Per più di 40 anni, l'alfabeto di rianimazione Safar è stato utilizzato per la RCP. In questo complesso si sostiene la sequenza delle azioni del rianimatore che, secondo il loro nome inglese, sono indicate dalle lettere corrispondenti. A - Vie aeree - garantendo la pervietà delle vie aeree. B - Respirazione - ventilazione polmonare artificiale (ALV) in modo accessibile, ad esempio durante la respirazione "bocca a bocca". C - Circolazione - garanzia dell'emocircolazione - massaggio cardiaco indiretto. D - Droghe - l'introduzione di farmaci. E - Elettrocardiografia - Registrazione ECG. F - Fibrilazione - condurre, se necessario, la defibrillazione elettrica (cardioversione). G - Gauging - valutazione dei risultati primari. H - Ipotermia - raffreddamento della testa. I - Terapia intensiva - terapia intensiva per sindromi post-rianimazione. A - Vie aeree - Gestione delle vie aeree Il paziente viene posizionato orizzontalmente sulla schiena. La testa è gettata all'indietro il più possibile, per questo il medico mette una mano sotto il collo, l'altra è posta sulla fronte del paziente; un respiro di prova viene prelevato da bocca a bocca. Se un paziente con un tono muscolare ridotto giace sulla schiena, la sua lingua potrebbe affondare, come se si chiudesse la gola. Allo stesso tempo, l'epiglottide discende, bloccando ulteriormente le vie aeree. Appare: respiro sonoro, quindi violazioni del ritmo respiratorio fino al suo completo arresto. Tali fenomeni si sviluppano particolarmente rapidamente nei pazienti incoscienti. Per prevenire ed eliminare la retrazione della lingua, è necessario portare in avanti la mascella inferiore e contemporaneamente eseguire l'iperestensione dell'articolazione occipito-cervicale. Per fare ciò, con la pressione dei pollici sul mento, la mascella inferiore del paziente viene spostata verso il basso, quindi con le dita posizionate agli angoli della mascella, la spingono in avanti, integrando questa tecnica con una sovraestensione della testa all'indietro ( tripla tecnica Safari). Con la corretta e tempestiva conduzione di queste manipolazioni, la pervietà delle vie aeree a livello della faringe viene rapidamente ripristinata. Corpi estranei (coaguli di sangue, muco, dentiere, ecc.) possono essere la causa dell'ostruzione delle vie aeree. Vengono rapidamente rimossi con qualsiasi materiale improvvisato (tovagliolo, fazzoletto). La testa del paziente deve essere girata di lato a causa del pericolo di aspirazione. Il ripristino della pervietà delle prime vie respiratorie è facilitato dall'uso di vari condotti d'aria. Il più appropriato è l'uso di un condotto a forma di S. Per la sua introduzione, la bocca del paziente viene aperta con le dita II e I incrociate e il tubo viene fatto avanzare fino alla radice della lingua in modo che la sua apertura "scivoli" lungo il palato. È necessario prestare attenzione per garantire che il condotto dell'aria non si muova durante il trasporto. Se tutte le procedure descritte non sono efficaci, si può ipotizzare la presenza di otturazione delle vie aeree nelle sezioni sottostanti. In questi casi è necessaria la laringoscopia diretta e l'aspirazione attiva della secrezione patologica, seguita da intubazione tracheale per 10-15 secondi. Si consiglia di eseguire conicotomia e tracheostomia. B - Respirazione - ventilazione polmonare artificiale (ALV) in modo accessibile Il metodo più semplice ed efficace di respirazione artificiale durante la rianimazione è il metodo "bocca a bocca", quando l'aria espirata dal rianimatore viene soffiata nei polmoni della vittima sotto pressione. Dopo aver gettato indietro la testa della vittima, con una mano gli pizzicano le narici, gli mettono l'altra mano sotto il collo, fai un respiro profondo, premendo strettamente le sue labbra sulle labbra della vittima (nei bambini, sulle labbra e sul naso allo stesso tempo) e soffiare aria nei polmoni della vittima, osservando l'innalzamento del torace durante il tempo di inalazione. Non appena il torace si alza, l'iniezione d'aria viene interrotta, spostano il viso di lato, fanno di nuovo un respiro profondo e il paziente in questo momento ha un'espirazione passiva. Dopo 2-3 insufflazioni dei polmoni, viene determinata la presenza di un impulso sull'arteria carotide, se non viene rilevato, si procede al ripristino artificiale della circolazione sanguigna. La ventilazione manuale viene utilizzata utilizzando una sacca di tipo Ambu autoespandibile. Quando si utilizza un ventilatore, la frequenza respiratoria è di 12-15 al minuto, il volume inspiratorio è di 0,5-1,0 litri. In un ospedale viene eseguita l'intubazione tracheale e il paziente viene trasferito a un ventilatore. Circolazione C - garantendo l'emocircolazione - massaggio cardiaco indiretto Il massaggio cardiaco chiuso è il modo più semplice ed efficace di supporto circolatorio artificiale di emergenza. Il massaggio cardiaco chiuso deve essere avviato immediatamente, non appena viene posta la diagnosi di arresto circolatorio acuto, senza chiarirne cause e meccanismi. In caso di contrazioni cardiache inefficaci, non si deve attendere un arresto cardiaco completo o un ripristino indipendente di un'adeguata attività cardiaca. Regole di base per il massaggio cardiaco chiuso. 1. Il paziente deve essere in posizione orizzontale su una base solida (pavimento o lettino basso) per evitare la possibilità di spostamento del suo corpo sotto il rafforzamento delle mani massaggianti. 2. La zona di applicazione della forza delle mani del rianimatore si trova sul terzo inferiore dello sterno, rigorosamente lungo la linea mediana; il rianimatore può trovarsi su entrambi i lati del paziente. 3. Per il massaggio, un palmo viene posizionato sopra l'altro e viene applicata una pressione sullo sterno nell'area situata 3-4 dita trasversali sopra il punto di attacco allo sterno del processo xifoideo; le mani del massaggiatore, raddrizzate all'altezza delle articolazioni del gomito, sono posizionate in modo che solo il polso produca pressione. 4. La compressione del torace della vittima viene eseguita a causa della gravità del busto del medico. Lo spostamento dello sterno verso la colonna vertebrale (cioè la profondità della deflessione del torace) dovrebbe essere di 4-6 cm. 5. La durata di una compressione toracica è di 0,5 s, l'intervallo tra le singole compressioni è di 0,5-1 s. Tasso di massaggio - 60 movimenti di massaggio al minuto. A intervalli, le mani non vengono rimosse dallo sterno, le dita rimangono sollevate, le braccia sono completamente estese alle articolazioni del gomito. Quando la rianimazione viene eseguita da una persona, dopo due rapide iniezioni di aria nei polmoni del paziente, vengono eseguite 15 compressioni toraciche, ovvero il rapporto "ventilazione: massaggio" è 2: 15. Se 2 persone sono coinvolte nella rianimazione, allora questo rapporto è 1: 5, cioè ci sono 5 compressioni toraciche per respiro. Un prerequisito per il massaggio cardiaco è il monitoraggio costante della sua efficacia. I criteri per l'efficacia del massaggio dovrebbero essere considerati come segue. 1. Cambiamento del colore della pelle: diventa meno pallida, grigia, cianotica. 2. Costrizione delle pupille, se dilatate, con apparenza di reazione alla luce. 3. La comparsa di un impulso cardiaco sulle arterie carotidee e femorali e talvolta sull'arteria radiale. 4. Determinazione della pressione sanguigna a livello di 60-70 mm Hg. Arte. se misurato alla spalla. 5. A volte la comparsa di movimenti respiratori indipendenti. Se ci sono segni di ripristino della circolazione sanguigna, ma in assenza di una tendenza a preservare l'attività cardiaca indipendente, il massaggio cardiaco viene eseguito fino al raggiungimento dell'effetto desiderato (ripristino del flusso sanguigno efficace) o fino a quando i segni di vita scompaiono definitivamente con lo sviluppo di sintomi di morte cerebrale. In assenza di segni di ripristino di un flusso sanguigno anche ridotto, nonostante il massaggio cardiaco per 25-30 minuti, il paziente deve essere riconosciuto in punto di morte e le misure di rianimazione possono essere sospese. D - farmaci - somministrazione di farmaci In caso di interruzione acuta della circolazione sanguigna, l'introduzione di agenti che stimolano l'attività cardiaca dovrebbe iniziare il prima possibile, se necessario, ripetuta durante la rianimazione. Dopo l'inizio del massaggio cardiaco, 0,5-1 ml di adrenalina devono essere somministrati il prima possibile (per via endovenosa o intratracheale). Le sue introduzioni ripetute sono possibili dopo 2-5 minuti (fino a 5-6 ml in totale). Con l'asistolia, l'adrenalina tonifica il miocardio e aiuta a "avviare" il cuore, con la fibrillazione ventricolare contribuisce al passaggio dalla fibrillazione a onde piccole a quelle a onde grandi, che facilita notevolmente la defibrillazione. L'adrenalina facilita il flusso sanguigno coronarico e aumenta la contrattilità del muscolo cardiaco. Invece dell'adrenalina, può essere utilizzata l'isodrina, che è 3 volte più efficace dell'adrenalina in termini di efficacia dell'effetto sul miocardio. La dose iniziale è di 1-2 ml per via endovenosa e i successivi 1-2 ml in 250 ml di una soluzione di glucosio al 5%. In condizioni di alterata circolazione sanguigna, l'acidosi metabolica aumenta progressivamente, pertanto, subito dopo l'infusione di adrenalina, viene somministrata per via endovenosa una soluzione al 4-5% di bicarbonato di sodio alla velocità di 3 ml/kg di peso corporeo del paziente. Nel processo di morte, il tono del sistema nervoso parasimpatico aumenta in modo significativo, il cervello è esaurito, quindi vengono utilizzati gli M-colinolitici. Con asistolia e bradicardia, l'atropina viene somministrata per via endovenosa in una soluzione allo 0,1% - 0,5-1 ml, fino a una dose massima di 3-4 ml. Per aumentare il tono miocardico e ridurre l'effetto dell'iperkaliemia, si raccomanda la somministrazione endovenosa di 5 ml di una soluzione al 10% di cloruro di calcio. Adrenalina, atropina e cloruro di calcio possono essere somministrati insieme nella stessa siringa. Con tachicardia grave e soprattutto con lo sviluppo di fibrillazione, è indicato l'uso di lidocaina alla dose di 60-80 mg, ma poiché è a breve durata d'azione, viene infusa ad una velocità di 2 mg / min. È inoltre indicato l'uso di glucocorticoidi, che, aumentando la sensibilità delle strutture miocardiche adrenoreattive alle catecolamine e normalizzando la permeabilità delle membrane cellulari, contribuiscono al ripristino di un'adeguata attività cardiaca. E - Elettrocardiografia - Registrazione ECG Con l'aiuto di uno studio ECG, viene determinata la natura della violazione dell'attività cardiaca. Molto spesso può essere asistolia - completa cessazione delle contrazioni cardiache, fibrillazione - contrazione caotica non coordinata delle fibre miocardiche con una frequenza di 400-500 battiti / min, in cui la gittata cardiaca praticamente si interrompe. Inizialmente si nota una fibrillazione a onde grandi, che, entro 1-2 minuti, passa in fibrillazione a onde piccole, seguita da asistolia. La presenza di qualsiasi ritmo sull'ECG è migliore della completa assenza di attività elettrica del miocardio. Pertanto, il compito chiave della RCP è stimolare l'attività elettrica del miocardio e successivamente modificarla in un ritmo efficace (presenza di un impulso). La presenza di asistolia funge da marker di grave disturbo della perfusione miocardica e funge da scarso segno prognostico per il ripristino del ritmo cardiaco. Tuttavia, è importante distinguere tra fibrillazione ventricolare a microonde di bassa ampiezza e asistolia, che è meglio eseguire nelle derivazioni ECG standard 2-3. L'adrenalina (1 mg per via endovenosa) e l'atropina (1 mg aumentato a 2-4 mg) sono i più efficaci nel ripristinare l'attività elettrica. Nei casi refrattari, la correzione dei livelli di potassio e calcio è efficace. Fibrillazione ventricolare (VF) Nei pazienti senza polso, deve essere eseguita una terapia impulsiva elettrica alla cieca immediata (prima che la causa dell'arresto circolatorio venga riconosciuta dall'ECG), poiché la FV è la causa più comune di morte improvvisa e il successo della defibrillazione è in gran parte determinato dal momento in cui viene eseguita . Va notato che la defibrillazione "alla cieca" non danneggerà i pazienti con asistolia e bradicardia e di solito è efficace nei pazienti con tachicardia e FV. È importante ricordare che la regola della cardioversione "alla cieca" non è accettabile nei bambini, poiché hanno molte più probabilità rispetto alla FV di avere un arresto respiratorio come causa di malattia terminale. Il successo della defibrillazione dipende dall'ampiezza della FV, che a sua volta è inversamente correlata alla durata dell'episodio di FV. Se due tentativi iniziali di cardioversione risultano inefficaci, in questo caso è necessario somministrare epinefrina per aumentare l'ampiezza delle onde di fibrillazione e aumentare il tono vascolare (nei casi di ripristino del ritmo cardiaco, consente di aumentare la perfusione del cuore e del cervello). D'altra parte, è necessario utilizzare dosi ottimali di adrenalina per non aumentare la richiesta di ossigeno del miocardio. F - Fibrillazione - eseguire la defibrillazione elettrica se necessario (cardioversione) La fibrillazione cardiaca può essere eliminata mediante l'uso della defibrillazione elettrica. È necessario applicare saldamente gli elettrodi al torace (in posizione anterolaterale, un elettrodo si trova nella regione dell'apice del cuore, il secondo nella regione succlavia a destra dello sterno), che aumenta la forza del scarica e, di conseguenza, l'efficacia della defibrillazione. In un certo numero di pazienti, la posizione anteroposteriore (apice del cuore - spazio interscapolare) degli elettrodi è più efficace. Non applicare elettrodi sulle sovrapposizioni del monitor ECG. Va notato che la defibrillazione elettrica è efficace solo quando sull'ECG vengono registrate oscillazioni a onde grandi con un'ampiezza compresa tra 0,5 e 1 mV o più. Questo tipo di fibrillazione miocardica indica la sicurezza delle sue risorse energetiche e la possibilità di ripristinare un'adeguata attività cardiaca. Se le oscillazioni sono basse, aritmiche e polimorfiche, che si osservano nell'ipossia miocardica grave, la possibilità di ripristinare l'attività cardiaca dopo la defibrillazione è minima. In questo caso, con l'aiuto del massaggio cardiaco, della ventilazione meccanica, della somministrazione endovenosa di adrenalina, atropina, cloruro di calcio, è necessario ottenere il trasferimento della fibrillazione alle onde grandi e solo dopo deve essere eseguita la defibrillazione. Il primo tentativo di defibrillazione viene effettuato con una scarica di 200 J, con i successivi tentativi la carica sale a 360 J. Gli elettrodi devono essere inumiditi e premuti saldamente contro la superficie del torace. Gli errori più comuni durante la defibrillazione, che causano l'inefficacia di quest'ultima, includono quanto segue. 1. Lunghe pause nel massaggio cardiaco o completa assenza di rianimazione durante la preparazione del defibrillatore per la dimissione. 2. Pressatura allentata o inumidimento insufficiente degli elettrodi. 3. Applicazione di una scarica sullo sfondo della fibrillazione a onde basse senza adottare misure che aumentino le risorse energetiche del miocardio. 4. Applicare una scarica di tensione bassa o eccessivamente alta. Va notato che la defibrillazione elettrica del cuore è un metodo efficace per correggere tali aritmie cardiache come tachicardia ventricolare parossistica, flutter atriale, tachicardia nodale e sopraventricolare, fibrillazione atriale. L'indicazione per la defibrillazione elettrica, nella fase preospedaliera, è il più delle volte la tachicardia ventricolare parossistica. Una caratteristica della defibrillazione in queste condizioni è la presenza di coscienza nel paziente e la necessità di eliminare la reazione al dolore quando si applica una scarica elettrica. G - misura - valutazione dei risultati primari La valutazione primaria dei risultati viene effettuata non solo per accertare lo stato dell'apparato circolatorio e respiratorio, ma anche per delineare le tattiche di ulteriori misure terapeutiche. Al completamento del processo di rianimazione, in cui è apparso il ripristino dell'attività cardiaca, il rianimatore deve eseguire una serie di azioni finali: 1) valutare lo stato delle vie respiratorie (simmetria della respirazione, con il proseguimento della respirazione forzata, l'adeguatezza della ventilazione); 2) controllare la pulsazione nelle arterie centrali e periferiche; 3) valutare il colore della pelle; 4) determinare il livello di pressione sanguigna; 5) misurare il volume del sangue circolante (misurare il CVP, valutare lo stato delle vene del collo); 6) verificare la corretta posizione dei cateteri nelle vene centrali; 7) in caso di eliminazione della fibrillazione cardiaca, che è stata causa di morte improvvisa, assicurarsi che l'infusione di qualsiasi agente antifibrillare sia continuata; 8) correggere la terapia se è stata effettuata al paziente prima dell'episodio di morte improvvisa. H - Ipotermia - raffreddamento della testa Con l'ipotermia, il tempo critico di arresto circolatorio può aumentare in modo significativo. Per prevenire lo sviluppo dell'encefalopatia post-ipossica, è necessario adottare misure per ridurre l'intensità dei processi metabolici nel cervello, nonché farmaci anti-ipossici e antiossidanti. Attività principali 1. Ipotermia craniocerebrale: avvolgere la testa e il collo con impacchi di ghiaccio, neve, acqua fredda. 2. Somministrazione parenterale di antiipoxanti (sodio ossibutirrato, mafusol, piccole dosi di sedativi), oltre a migliorare le proprietà reologiche del sangue (reopoliglucina, hemodez, eparina, trental). 3. L'introduzione di calcioantagonisti (nimoton, lidoflazin, ecc.). 4. Introduzione di antiossidanti (mafusol, unitiol, vitamina C, catalasi, ecc.). I - Terapia intensiva - condurre la terapia intensiva delle sindromi post-rianimazione Sebbene una risposta rapida e positiva alla RCP migliori le possibilità di una prognosi favorevole nei pazienti, è possibile il successivo sviluppo di sepsi, insufficienza polmonare acuta e polmonite, che naturalmente peggiorano la prognosi. La sopravvivenza a lungo termine dei pazienti con precedenti malattie degli organi vitali dopo la RCP non è tipica, poiché durante questo periodo le loro lesioni si approfondiscono e i centri nervosi che forniscono il controllo autonomo e il mantenimento dei riflessi protettivi sono danneggiati. Inoltre, quando viene utilizzata la compressione toracica intensiva, si notano rotture del fegato, dell'aorta, del pneumotorace, delle fratture delle costole e dello sterno. La polmonite da aspirazione, le convulsioni (dovute a ischemia cerebrale) e l'intossicazione da lidocaina sono complicazioni comuni. Un certo numero di pazienti sviluppa sanguinamento da ulcere da stress dello stomaco e del duodeno. Dopo la RCP, si verifica un aumento significativo del livello degli enzimi epatici (e/o del muscolo scheletrico), sebbene lo sviluppo di necrosi epatica e l'insufficienza della sua funzione siano rari. Nei regimi di defibrillazione ad alta energia, c'è un aumento significativo del livello di creatinfosfochinasi, ma un aumento della frazione MB è presente solo con scariche ripetute ad alta energia. 1. Correzione del CBS e dell'equilibrio idroelettrolitico. Spesso dopo la RCP si sviluppano alcalosi metabolica, ipokaliemia, ipocloremia e altri disturbi elettrolitici. C'è uno spostamento del pH in un ambiente acido o alcalino. La chiave per la correzione del pH è un'adeguata ventilazione. L'uso del bicarbonato deve essere effettuato sotto il controllo della composizione gassosa del sangue. Di norma, non è necessario introdurre NSO3 con il rapido ripristino della circolazione sanguigna e della respirazione. Con un cuore funzionante, un livello di pH di ~ 7,15 è adeguato per il funzionamento del sistema cardiovascolare. La dose comunemente raccomandata di bicarbonato (1 mg/kg) può causare effetti collaterali tra cui: 1) alcalosi aritmogena; 2) aumento della produzione di CO2; 3) iperosmolarità; 4) ipokaliemia; 5) acidosi intracellulare paradossale del sistema nervoso centrale; 6) spostamento a sinistra della curva di dissociazione dell'emoglobina, limitando l'apporto tissutale di O2. Pertanto, la nomina di questo farmaco dovrebbe essere rigorosamente secondo le indicazioni. Per eliminare l'ipokaliemia, viene eseguita un'infusione endovenosa di cloruro di potassio alla dose di 2 mmol/kg al giorno. 2. Normalizzazione del sistema di difesa antiossidante. La terapia intensiva comprende un complesso di farmaci antiossidanti con azione multidirezionale: mafusol, unitiol, vitamina C, multibiont, tocoferolo, probucol, ecc. 3. L'uso di antiossidanti aiuta a ridurre l'intensità dei processi metabolici e, di conseguenza, a ridurre il fabbisogno di ossigeno ed energia, nonché il massimo utilizzo della ridotta quantità di ossigeno disponibile durante l'ipossia. Ciò si ottiene attraverso l'uso di farmaci di protezione neurovegetativa e antiipoxants (seduxen, droperidolo, bloccanti gangliari, mexamina, ossibutirrato di sodio, citocromo, gutimina, ecc.). 4. Un aumento delle risorse energetiche è fornito dalla somministrazione endovenosa di soluzioni concentrate di glucosio con insulina e i principali coenzimi coinvolti nell'utilizzo dell'energia (vitamina B6, cocarbossilasi, ATP, riboxina, ecc.). 5. La stimolazione della sintesi di proteine e acidi nucleici - substrati assolutamente necessari per il normale funzionamento delle cellule, la sintesi di enzimi, immunoglobuline e altri, viene effettuata mediante l'uso di ormoni anabolici (retabolil, nerabolil, insulina, retinolo ), acido folico, nonché l'introduzione di soluzioni di amminoacidi. 6. L'attivazione del metabolismo aerobico si ottiene introducendo una quantità sufficiente di substrati di ossidazione (glucosio), nonché utilizzando l'ossigenazione iperbolica (HBO): questo metodo garantisce la fornitura della quantità richiesta di ossigeno anche in condizioni di forti violazioni della sua erogazione . 7. Miglioramento dei processi redox (acido succinico, riboxin, tocoferolo, ecc.). 8. La terapia disintossicante attiva contribuisce alla normalizzazione dei processi metabolici. Per questo vengono utilizzati vari metodi di terapia infusionale (gelatinolo, albumina, plasma), diuresi forzata, ecc.. Nei casi più gravi vengono utilizzati metodi di disintossicazione extracorporea (emoassorbimento, emodialisi, plasmaferesi). 9. Eliminazione delle violazioni dei processi di microcircolazione. Per questo viene eseguita la terapia con eparina. Non esiste una linea guida unica per tutte le situazioni cliniche. Durante la RCP in corso, i segni neurologici non possono fungere da marker di esito e, di conseguenza, non possono essere guidati da essi quando la RCP viene interrotta. La rianimazione è raramente efficace se sono necessari più di 20 minuti per ripristinare un ritmo cardiaco coordinato. Numerosi studi hanno dimostrato che la mancanza di risposta entro 30 minuti alla RCP completa, con rare eccezioni, porta alla morte. I migliori risultati si hanno nei casi di cardioversione efficace immediata. La rianimazione prolungata con un buon esito neurologico è possibile con ipotermia e profonda depressione farmacologica del sistema nervoso centrale (ad esempio barbiturici). Metodi per determinare la non vitalità del cervello: 1) angiografia dei vasi cerebrali (mancanza di flusso sanguigno); 2) EEG (in linea retta per almeno 24 ore); 3) tomografia computerizzata. Criteri di cessazione della RCP: 1) se entro 30 minuti tutte le misure di rianimazione correttamente eseguite non portano alcun effetto - non compare la respirazione spontanea, non viene ripristinata la circolazione sanguigna, le pupille rimangono dilatate e non reagiscono alla luce; 2) se entro 30 minuti si verificano ripetuti arresti cardiaci non suscettibili di terapia e contemporaneamente non ci sono altri segni di successo della rianimazione; 3) se durante il processo di rianimazione si è riscontrato che questo paziente non è stato mostrato affatto; 4) se entro 45-60 minuti, nonostante il parziale ripristino della respirazione, la vittima non ha polso e non ci sono segni di ripristino della funzione cerebrale. Lezione n. 5. Condizioni di emergenza in pneumologia L'insufficienza respiratoria acuta è una condizione patologica dell'organismo in cui la funzione dell'apparato respiratorio esterno è insufficiente per fornire all'organismo ossigeno e un'adeguata rimozione dell'anidride carbonica. Il volume corrente normale (TO) è 500 ml (ventilazione alveolare - 350 ml, spazio morto 150 ml). Volume minuto di ventilazione (MOV) - 6-8 l. Consumo di ossigeno - 300 ml/min. Nell'aria espirata, l'ossigeno è del 16%, nell'inalazione - 21%. L'ossigeno nella miscela inalata deve essere almeno del 20%. Cause di insufficienza respiratoria acuta: una violazione della regolazione centrale della respirazione o una mancata corrispondenza tra ventilazione e flusso sanguigno a livello dei respironi - le unità strutturali e funzionali finali dei polmoni. Sovradosaggio di sostanze stupefacenti (inalazione), analgesici narcotici, edema cerebrale acuto, accidente cerebrovascolare, tumori cerebrali, lume ridotto delle vie aeree o ostruzione completa, retrazione della lingua, una grande quantità di espettorato, soprattutto in pazienti con malattie polmonari suppurative (ascesso, bronchiectasie), emorragia polmonare, vomito e aspirazione, laringospasmo e broncospasmo. Quando la lingua si ritrae, dovrebbe essere posizionato un condotto dell'aria o è più affidabile intubare e ventilare artificialmente. Con l'accumulo di espettorato, è necessario costringere il paziente a espettorarlo. Se il paziente è incosciente, le vie respiratorie vengono sanificate. Nei pazienti gravi viene eseguita l'anestesia e la sanificazione attiva. Vengono eseguiti il cateterismo della trachea, dell'albero bronchiale e la rimozione del contenuto. 1. Laringospasmo Il laringospasmo è la chiusura delle corde vocali vere e false. In entrambi i casi vengono necessariamente utilizzati agenti di controllo (eufillin). Se ciò non aiuta, è necessario introdurre miorilassanti a breve durata d'azione, intubare e trasferire il paziente in ventilazione meccanica. I miorilassanti causano insufficienza respiratoria nel periodo postoperatorio se non viene eseguita una decurarizzazione sufficiente. Di solito è prodotto da farmaci anticolinesterasici (prozerin). Al momento dell'estubazione, è necessario assicurarsi che la forza e il tono muscolare siano stati ripristinati (chiedere di alzare una mano, stringere una mano, alzare la testa). Con fratture multiple delle costole, parte del torace affonda durante l'inalazione, si sviluppa la cosiddetta respirazione paradossale, quindi è necessario ripristinare la struttura del torace. Per questo paziente è necessario intubare, dopo aver introdotto i miorilassanti, con ulteriore trasferimento alla ventilazione meccanica (fino al ripristino dell'integrità del torace). Quanto segue porta ad una diminuzione del parenchima polmonare funzionante: atelettasia, collasso polmonare, polmonite, conseguenze di un intervento chirurgico, pneumo-, emo-, piotorace. Differenze tra atelettasia e collasso: l'atelettasia è un'ostruzione in uno stato raddrizzato. Questa condizione è caratterizzata dalla presenza di un polmone non ventilato attraverso il quale passa metà del sangue circolante, quest'ultimo non ossigenato. Di conseguenza, si sviluppa insufficienza respiratoria acuta. Quando il polmone collassa, viene compresso da aria o fluido nella cavità pleurica. Allo stesso tempo, la circolazione sanguigna nel polmone compresso diminuisce drasticamente e aumenta la circolazione sanguigna in un polmone sano. Pertanto, il collasso non è una complicazione così pericolosa in termini di sviluppo di insufficienza respiratoria acuta come l'atelettasia. Prima dell'intervento chirurgico, deve essere valutata la funzione del polmone intatto (spirografia separata). Secondo lo stadio di sviluppo, l'insufficienza respiratoria acuta è suddivisa in: 1) disfunzione; 2) insufficienza; 3) fallimento della funzione protesica. Secondo il tasso di sviluppo, l'insufficienza respiratoria acuta è suddivisa in: 1) fulmineo (si sviluppa entro un minuto); 2) acuto (si sviluppa entro poche ore); 3) subacuto (si sviluppa entro pochi giorni); 4) cronico (dura per anni). I principali elementi della terapia intensiva per l'insufficienza respiratoria acuta: ossigenoterapia, posizione di drenaggio del paziente, fibrobroncoscopia, tracheostomia, intubazione e ventilazione meccanica, broncodilatazione, terapia ormonale, HBO. 2. Embolia polmonare L'embolia polmonare (EP) è un blocco del tronco principale o medio, piccoli tronchi vascolari dell'arteria polmonare, che porta ad un aumento della pressione nella circolazione polmonare, insufficienza ventricolare destra. Fattori predisponenti Malattie del sistema cardiovascolare - aterosclerosi, cardiopatie reumatiche, malformazioni reumatiche, endocardite settica. Malattie delle vene degli arti inferiori, patologia degli organi e dei vasi della piccola pelvi. L'EP postoperatoria in particolare richiede molta attenzione. Molto spesso, l'embolia si sviluppa durante le operazioni su: vasi degli arti inferiori, vescica, organi genitali femminili, ghiandola prostatica, ossa pelviche e articolazione dell'anca. Sono essenziali cambiamenti nel sistema emostatico, fibrinolisi spontanea, retrazione e organizzazione dei trombi venosi. A maggior rischio sono anche i pazienti con malattie oncologiche, obesità, insufficienza circolatoria, costretti per vari motivi a rimanere a letto per lungo tempo. Classificazione clinica di PE Forma: pesante, media e leggera. A valle: fulminante, acuto, ricorrente. Secondo il livello di danno all'arteria polmonare: tronco o rami principali, rami lobari (segmentali), rami piccoli. Clinica e diagnostica Il decorso clinico dell'EP è abbastanza variabile. I sintomi più comuni sono l'insorgenza improvvisa di dispnea (RR varia da 30 a più di 50 al minuto), respiro rapido, pallore, più spesso cianosi, gonfiore delle vene giugulari, tachicardia, ipotensione arteriosa (fino a shock), retrosternale dolore, tosse ed emottisi. L'auscultazione determina spesso il rafforzamento dell'II tono sull'arteria polmonare. Segni radiografici: aumento delle dimensioni dell'arteria polmonare prossimale, esaurimento del pattern periferico e aumento della cupola del diaframma. L'ECG può rivelare un sovraccarico dei reparti giusti (cuore polmonare): 1) la comparsa di onde Q con un aumento simultaneo dell'ampiezza dei denti R e S (sindrome QS); 2) rotazione del cuore attorno all'asse longitudinale con il ventricolo destro in avanti (spostamento della zona di transizione verso il torace sinistro conduce); 3) sopraslivellamento del tratto ST con onda T negativa nelle derivazioni III, aVF, V1-V3; 4) la comparsa o l'aumento del grado di blocco della gamba destra del fascio di His; 5) dente P "polmonare" a punta alta con una deviazione del suo asse elettrico a destra; 6) tachicardia sinusale o forma tachisistolica di fibrillazione atriale. L'ecocardiografia consente di rilevare il cuore polmonare acuto, determinare la gravità dell'ipertensione nella circolazione polmonare, valutare lo stato strutturale e funzionale del ventricolo destro, rilevare il tromboembolismo nelle cavità cardiache e nelle principali arterie polmonari, visualizzare un forame ovale aperto, che può interessare la gravità dei disturbi emodinamici ed essere causa di embolia paradossale. Tuttavia, un risultato ecocardiografico negativo non esclude in alcun modo la diagnosi di embolia polmonare. Il metodo diagnostico più informativo è l'angiografia dell'arteria polmonare. A scopo preventivo, gli anticoagulanti vengono utilizzati nel periodo postoperatorio. La dose di eparina è di 10 UI al giorno (000 UI 2 volte). In presenza di controindicazioni, gli anticoagulanti non sono prescritti. Le controindicazioni includono: grave danno cerebrale; oncopatologia con potenziale sanguinamento; trombocitopenia; tubercolosi polmonare; gravi malattie croniche del parenchima del fegato e dei reni con insufficienza funzionale. trattamento Terapia anticoagulante. Gli anticoagulanti possono prevenire la trombosi secondaria nel letto vascolare polmonare e la progressione della trombosi venosa. Si consiglia di utilizzare ampiamente le eparine a basso peso molecolare (dalteparina, eioxaparina, fraxiparina), che, rispetto all'eparina non frazionata convenzionale, raramente causano complicanze emorragiche, hanno un effetto minore sulla funzione piastrinica, hanno una maggiore durata d'azione e un'elevata biodisponibilità. terapia trombolitica. Nell'EP massiva, la terapia trombolitica è indicata e giustificata nei casi in cui il volume della lesione è relativamente piccolo, ma l'ipertensione polmonare è pronunciata. Molto spesso, la streptochinasi viene utilizzata a una dose di 100 unità all'ora, ma bisogna essere consapevoli delle gravi reazioni allergiche. La durata della trombolisi è generalmente di 000-1 giorni. L'urochinasi e l'alteplase sono prive di proprietà antigeniche, ma hanno un'elevata resistenza. Chirurgia. L'embolectomia è indicata per i pazienti con tromboembolia del tronco polmonare o di entrambi i suoi rami principali con un grado estremamente grave di alterata perfusione polmonare, accompagnata da pronunciati disturbi emodinamici. Tutte le manipolazioni per rimuovere gli emboli dopo il bloccaggio incrociato della vena cava non devono durare più di 3 minuti, poiché questo intervallo è fondamentale per i pazienti sottoposti a intervento chirurgico in condizioni di grave ipossia iniziale. È ottimale eseguire l'embolectomia in bypass cardiopolmonare utilizzando l'accesso transsternale. 3. Asma bronchiale L'asma bronchiale è una malattia basata sull'infiammazione cronica delle vie aeree con una componente autoimmune, accompagnata da un cambiamento nella sensibilità e reattività dei bronchi, manifestata da un attacco o dallo stato di soffocamento, con sintomi costanti di disagio respiratorio, sullo sfondo di una predisposizione ereditaria alle malattie allergiche. Classificazione La classificazione dell'asma bronchiale è la seguente. 1. Fasi di sviluppo dell'asma: 1) difetti biologici in persone praticamente sane; 2) lo stato di preastma; 3) asma clinicamente pronunciato. 2. Varianti cliniche e patogenetiche: 1) atopico; 2) infettivo-dipendente; 3) autoimmune; 4) disordinato; 5) neuropsichico; 6) aspirato; 7) reattività bronchiale alterata primaria. 3. La gravità del decorso della malattia: 1) polmone; 2) moderato; 3) pesante. 4. Fasi di flusso: 1) esacerbazione; 2) remissione instabile; 3) remissione stabile (più di 2 anni). 5. Complicazioni: 1) polmonare - atelettasia, pneumotorace, insufficienza polmonare acuta; 2) extrapolmonare - cuore polmonare, insufficienza cardiaca. 6. Per eziologia: 1) atopico (esogeno, allergico, immunologico); 2) non atopico (endogeno, non immunologico). I criteri clinici per il grado di BA sono riportati nella tabella 2. Tabella 2 Criteri clinici per la valutazione della gravità dell'asma
stato asmatico Lo stato asmatico è un attacco continuo di asma bronchiale, caratterizzato da insufficienza respiratoria ostruttiva acuta durante il giorno. Le principali caratteristiche distintive dello stato asmatico sono la mancanza di effetto della terapia broncodilatatoria convenzionale e una tosse debilitante improduttiva. La classificazione dello stato asmatico è mostrata nella Tabella 3. Tabella 3 Classificazione dello stato asmatico (Sorokina T.A., 1987)
AS è caratterizzato da una grave mancanza di respiro di natura espiratoria con la partecipazione dei muscoli ausiliari del torace e della parete addominale anteriore nell'atto della respirazione, accompagnata da un cambiamento nel colore della pelle: pallore, iperemia, cianosi. La pelle può essere secca e calda o fredda e umida. La tachipnea è caratteristica, la frequenza respiratoria è generalmente superiore a 30 per 1 min. Ascolto auscultatorio del suono musicale associato al passaggio dell'aria attraverso i bronchioli ristretti. Con la progressione del processo, si verifica il noto fenomeno delle "zone silenziose" dei polmoni, che indica un'ostruzione bronco di questa regione dei polmoni. Caratterizzato da tachicardia, aumento della pressione sanguigna e gittata cardiaca (MOS). Diminuzione della pressione sanguigna sistolica durante l'inspirazione. Si sviluppano disidratazione e ipovolemia. La perdita di liquidi avviene principalmente attraverso le vie respiratorie e la pelle. Il volume del sangue circolante (CBV) è solitamente ridotto in media del 10% e molto raramente aumentato. Aumenta significativamente la viscosità del sangue e l'ematocrito fino a 0,50-0,60, il che crea una vera minaccia di tromboembolismo polmonare e richiede la nomina di eparina. La concentrazione di proteine è aumentata, la disidratazione generale si manifesta con sete, secchezza della lingua, aumento dell'osmolalità plasmatica e oliguria. La pressione venosa centrale (CVP) è ridotta a 2-5 cm di acqua. Arte. L'ipovolemia predispone al collasso, che è particolarmente importante quando si trasferiscono i pazienti alla ventilazione meccanica. Inizialmente c'è eccitazione, poi disturbi mentali e "panico respiratorio", che è associato a una sensazione di mancanza d'aria. In futuro si instaurano irritabilità, confusione, letargia (fino allo stupore e al coma). Si sviluppa acidosi respiratoria. Trattamento di emergenza dello stato asmatico Ossigenoterapia. L'ossigeno inumidito viene inalato2 attraverso cateteri nasali o attraverso una maschera alla velocità di 1-2 l / min. L'adrenalina stimola i recettori adrenergici a1, b1 e b2, dilata i bronchi e riduce la resistenza delle vie aeree. Viene somministrato per via sottocutanea: con un peso corporeo inferiore a 60 kg - 0,3 ml, con un peso da 60 a 80 kg - 0,4 ml, con un peso superiore a 80 kg - 0,5 ml. L'eufillina inibisce la fosfodiesterasi, che contribuisce all'accumulo di cAMP e alla rimozione del broncospasmo. Quando si prescrive l'aminofillina, è necessario tenere conto delle controindicazioni, che includono fumo e infanzia, insufficienza cardiaca e sindrome coronarica acuta, malattie croniche dei polmoni, del fegato e dei reni. Con AS, la dose di carico di aminofillina è di 3-6 mg/kg, viene somministrata per via endovenosa in 20 minuti. Quindi, viene eseguita un'infusione a goccia di mantenimento del farmaco alla velocità di 0,6 mg/kg per 1 ora per un paziente senza patologia concomitante, 0,8 mg/kg per 1 ora per un fumatore, 0,2 mg/kg per 1 ora per congestizia insufficienza cardiaca, polmonite, malattie del fegato e dei reni, 0,4 mg/kg per 1 ora per gravi malattie polmonari croniche. L'effetto della terapia con corticosteroidi è associato alla soppressione dell'infiammazione delle vie aeree e ad una maggiore sensibilità ai farmaci b-adrenergici. Più grave è l'AS, maggiore è l'indicazione per una terapia corticosteroidea immediata. Inizialmente deve essere somministrata una dose elevata di corticosteroidi. La dose minima è 30 mg di prednisolone o 100 mg di idrocortisone o 4 mg di desametasone (celeston). Se la terapia è inefficace, la dose viene aumentata. Almeno ogni 6 ore vengono somministrate dosi equivalenti appropriate di questi farmaci. Alla maggior parte dei pazienti viene mostrata una terapia inalatoria con agonisti b-adrenergici; (fenoterolo, alupent, salbutamolo). Le eccezioni sono casi di overdose di simpaticomimetici. Se la terapia in corso non dà effetto, è indicata la somministrazione endovenosa di agonisti b-adrenergici, come l'isoproterenolo, diluito in una soluzione di glucosio al 5%. Le controindicazioni sono malattie cardiache (cardiosclerosi coronarica, infarto del miocardio), tachicardia grave e sintomi di tachifilassi, vecchiaia. La velocità di somministrazione dell'isoproterenolo è di 0,1 μg/kg per 1 minuto fino all'inizio della tachicardia (FC 130 per 1 minuto o più). La terapia infusionale è la componente più importante del trattamento dell'AS, volta a reintegrare la carenza di liquidi ed eliminare l'ipovolemia, il volume totale della terapia infusionale è di 3-5 litri al giorno. L'idratazione viene effettuata introducendo soluzioni contenenti una quantità sufficiente di acqua libera (soluzioni di glucosio), nonché soluzioni elettrolitiche ipo e isotoniche contenenti sodio e cloro. Indicatori di un'adeguata idratazione sono la cessazione della sete, la lingua bagnata, il ripristino della normale diuresi, una migliore evacuazione dell'espettorato e una diminuzione dell'ematocrito a 0,30-0,40. L'anestesia con alotano può essere utilizzata nel trattamento di un grave attacco d'asma che non è suscettibile di terapia convenzionale. Ventilazione artificiale dei polmoni. Le indicazioni per il trasferimento di pazienti con SA alla ventilazione meccanica dovrebbero essere molto rigide, poiché in questo stato provoca spesso complicazioni ed è caratterizzato da un'elevata mortalità. Allo stesso tempo, la ventilazione meccanica, se effettuata secondo rigorose indicazioni, è l'unico metodo in grado di prevenire l'ulteriore progressione dell'ipossia e dell'ipercapnia. Indicazioni per IVL: 1) progressione costante di AS, nonostante la terapia intensiva; 2) aumento della pCO2 e l'ipossiemia, confermata da una serie di test; 3) progressione dei sintomi del SNC e coma; 4) aumentare la fatica e l'esaurimento. I mucolitici e gli espettoranti sono divisi in due gruppi. 1. Gli enzimi proteolitici (tripsina, chimotripsina) agiscono rompendo i legami peptidici delle glicoproteine, riducendo la viscosità e l'elasticità dell'espettorato. Sono efficaci nell'espettorato mucoso e purulento, hanno un effetto antinfiammatorio, ma possono causare emottisi e reazioni allergiche. 2. I derivati della cisteina stimolano l'attività secretoria nell'epitelio ciliato dell'albero tracheobronchiale (mukosolvan, mukomist), sono usati come aerosol di una soluzione al 20% di 2-3 ml 2-3 volte al giorno. Lezione n. 6. Condizioni di emergenza in cardiologia 1. Infarto del miocardio L'infarto miocardico è una discrepanza tra la richiesta di ossigeno del miocardio e la sua erogazione, con conseguente necrosi limitata del muscolo cardiaco. La causa più comune è un trombo, meno spesso un embolo, meno spesso uno spasmo delle arterie coronarie. La trombosi è più spesso osservata sullo sfondo del danno aterosclerotico alle arterie coronarie. In presenza di placche ateromatose si verifica un vortice del flusso sanguigno. Le lesioni aterosclerotiche si sviluppano a causa del metabolismo lipidico alterato, aumenta la coagulazione del sangue, che è associata a una diminuzione dell'attività dei mastociti che producono eparina. L'aumento della coagulazione del sangue e della turbolenza contribuiscono alla formazione di coaguli di sangue. La disintegrazione delle placche ateromatose, le emorragie in esse contenute possono portare alla formazione di coaguli di sangue. Fattori predisponenti sono il sesso maschile, l'età superiore ai 50 anni, l'obesità, l'ereditarietà, lo stress psico-emotivo, il duro lavoro. Clinica e diagnostica Classicamente, l'infarto del miocardio inizia con un dolore crescente dietro lo sterno, che in natura brucia e preme. Caratterizzato da un'estesa irradiazione di dolore alle braccia (di solito a sinistra), schiena, addome, testa, sotto la scapola sinistra, nella mascella inferiore sinistra, ecc. I pazienti sono irrequieti, ansiosi, a volte notano una sensazione di paura Morte. Ci sono segni di insufficienza cardiaca e vascolare: estremità fredde, sudore umido, ecc. La sindrome del dolore è prolungata e non viene alleviata dalla nitroglicerina per 30 minuti o più. Ci sono vari disturbi del ritmo cardiaco, un calo della pressione sanguigna o il suo aumento. I pazienti notano soggettivamente la sensazione di mancanza d'aria. I segni di cui sopra sono tipici del periodo I - doloroso o ischemico, la cui durata varia da alcune ore a 2 giorni. Obiettivamente, un aumento della pressione sanguigna (quindi una diminuzione); aumento della frequenza cardiaca o disturbi del ritmo; all'auscultazione si sente un tono IV anormale; i suoni del cuore sono smorzati; accento sul tono dell'aorta II; non ci sono praticamente cambiamenti biochimici nel sangue, segni caratteristici sull'ECG. Il secondo periodo è acuto (febbrile, infiammatorio), caratterizzato dal verificarsi di necrosi del muscolo cardiaco nel sito di ischemia. Il dolore di solito scompare. La durata del periodo acuto è fino a 2 settimane. Lo stato di salute del paziente migliora gradualmente, ma persistono debolezza generale, malessere e tachicardia. I suoni del cuore sono attutiti. Un aumento della temperatura corporea dovuto al processo infiammatorio nel miocardio, solitamente piccolo, fino a 38 ° C, di solito compare il 3o giorno della malattia. Entro la fine della prima settimana, la temperatura torna normalmente alla normalità. Quando esaminano il sangue, trovano: leucocitosi, moderata, neutrofila (10-15 mila) con passaggio a bastoncelli: gli eosinofili sono assenti o eosinopenia; graduale accelerazione della VES; Appare la proteina C-reattiva; aumento dell'attività delle transaminasi; aumento dell'attività della lattato deidrogenasi, della creatinfosfochinasi e di altri marker di infarto. I cardiospecifici sono la frazione CPK-MB e la troponina cardiaca. Il terzo periodo (periodo subacuto o cicatriziale) dura 4-6 settimane. Caratteristica è la normalizzazione dei parametri del sangue (enzimi), la temperatura corporea si normalizza, tutti gli altri segni di un processo acuto scompaiono: l'ECG cambia, una cicatrice del tessuto connettivo si sviluppa nel sito di necrosi. Il quarto periodo (periodo di riabilitazione, recupero) dura da 6 mesi a 1 anno. Non ci sono segni clinici. Durante questo periodo, si verifica l'ipertrofia compensatoria delle fibre muscolari miocardiche intatte e si sviluppano altri meccanismi compensatori. C'è un graduale ripristino della funzione miocardica. Ma l'onda Q patologica persiste sull'ECG. Ma non dobbiamo dimenticare la presenza di forme atipiche di infarto del miocardio, che si trovano spesso nella pratica clinica. Questi includono quanto segue. 1. La forma addominale procede secondo il tipo di patologia del tratto gastrointestinale con dolore nella regione epigastrica, sotto il processo xifoideo, nell'addome, accompagnato da nausea, vomito. Più spesso questa forma (addominale) di infarto miocardico si verifica con infarto della parete posteriore del ventricolo sinistro. In generale, l'opzione è rara. Derivazioni ECG II, III e VL. 2. La forma asmatica è caratterizzata da segni di asma cardiaco e provoca edema polmonare come esito. Il dolore può essere assente. La forma asmatica si verifica più spesso nelle persone anziane con cardiosclerosi o in infarto ricorrente, o in infarti molto grandi. C'è mancanza di respiro, soffocamento, tosse. Auscultatorio nei polmoni - rantoli umidi e gorgoglianti. 3. Forma cerebrale, o cerebrale. Allo stesso tempo, in primo piano, i sintomi dell'incidente cerebrovascolare del tipo di ictus con perdita di coscienza sono più comuni nelle persone anziane con sclerosi vascolare cerebrale. Ci sono vertigini, nausea, vomito, sintomi neurologici focali. 4. La forma silenziosa o indolore è un reperto accidentale durante la visita medica. Delle manifestazioni cliniche: improvvisamente è diventato "malato", c'era una forte debolezza, sudore appiccicoso, quindi tutto, tranne la debolezza, scompare. Questa situazione è tipica di un infarto in età avanzata e con ripetuti infarti del miocardio. Si sviluppa una diminuzione immotivata della tolleranza all'esercizio. 5. Forma aritmica: il sintomo principale è parossistico - tachicardia, il dolore può essere assente. Inizia con un segno di tachicardia ventricolare o sopraventricolare, blocco AV II-III grado, blocco acuto delle gambe del fascio atrioventricolare. All'esordio si verificano spesso attacchi Morgagni-Adams-Stokes. Nella maggior parte dei casi, le aritmie cardiache sono complicate da ipotensione, shock aritmogeno e insufficienza cardiaca acuta. I segni di infarto miocardico sull'ECG sono i seguenti: 1) con infarto miocardico penetrante o transmurale (cioè la zona di necrosi si estende dal pericardio all'endocardio): spostamento del segmento ST sopra l'isolina, la forma è convessa verso l'alto - come una "schiena di gatto"; fusione dell'onda T con i segmenti ST nei giorni 1-3; l'onda Q profonda e ampia è il segno principale; diminuzione delle dimensioni dell'onda R, a volte forma QS; cambiamenti discordanti caratteristici - spostamenti opposti di ST e T (ad esempio, nella 1a e 2a derivazione standard rispetto alla 3a derivazione standard); in media, dal 3o giorno, si osserva una caratteristica dinamica inversa dei cambiamenti dell'ECG: il segmento ST si avvicina all'isolina, appare una T profonda uniforme. Anche l'onda Q subisce una dinamica inversa, ma la Q alterata e la T profonda possono persistere per tutta la vita ; 2) con infarto miocardico intramurale o non transmurale: non c'è onda Q profonda, lo spostamento del segmento ST può essere non solo verso l'alto, ma anche verso il basso. I criteri principali per la diagnosi di infarto miocardico: 1) segni clinici; 2) segni elettrocardiografici; 3) segni biochimici. Complicanze: aritmie cardiache, disturbi della conduzione atrioventricolare, insufficienza ventricolare sinistra acuta: edema polmonare, asma cardiaco, shock cardiogeno, disturbi gastrointestinali (paresi dello stomaco e dell'intestino, sanguinamento gastrico), pericardite, tromboendocardite parietale, rotture del miocardio, aneurisma cardiaco acuto e cronico , sindrome di Dressler, complicanze tromboemboliche, angina pectoris postinfartuale. trattamento Il trattamento ha lo scopo di prevenire le complicanze, limitare la zona dell'infarto, alleviare il dolore e correggere l'ipossia. Eliminazione di una sindrome dolorosa: cominci con ricevimento di nitrati. Con grave ipotensione, viene eseguita la neuroleptanalgesia: fentanil 1-2 ml per via endovenosa su glucosio, droperidolo 0,25% 2 ml per 40 ml di soluzione di glucosio al 5%. Con un effetto incompleto, la morfina 1% 1,0 viene reintrodotta dopo un'ora per via sottocutanea o endovenosa per via torrente; omnopon 2% - 1,0 per via sottocutanea o endovenosa; promedol 1% - 1,0 per via sottocutanea. Per migliorare l'effetto analgesico, alleviare l'ansia, l'ansia, l'eccitazione, applicare: analgin 50% - 2,0 per via intramuscolare o endovenosa; difenidramina 1% - 1,0 per via intramuscolare (effetto sedativo) + clorpromazina 2,5% - 1,0 per via intramuscolare, endovenosa (potenziamento del farmaco). Per limitare la zona di necrosi vengono utilizzati anticoagulanti (eparina 5mila unità - 1 ml bolo seguito da somministrazione endovenosa di una pompa per infusione 1mila unità all'ora), trombolitici (fibrinolisina 6mila unità per via endovenosa; streptasi 250mila in soluzione fisiologica per via endovenosa ) e agenti antipiastrinici (aspirina, cardiomagnyl, trombo-ACS, Plavix). Prevenzione e trattamento delle aritmie. 1. Miscela polarizzante, che favorisce la penetrazione del potassio nelle cellule. 2. La lidocaina è il farmaco di scelta, più efficace per le aritmie ventricolari 80-100 mg in bolo. 3. Cordarone o amiodarone 450 mg per via endovenosa in soluzione fisiologica. Dato che la funzione di pompaggio del cuore soffre, la nomina di b-bloccanti (egilok 12,5-25 mg) è indicata per migliorare la contrattilità miocardica. In presenza di edema agli arti inferiori o rantoli umidi nei polmoni, vengono utilizzati diuretici (Lasix alla dose di 40-80 mg). Grande enfasi cade sulla pressione sanguigna, che deve essere aumentata con l'ipotensione (dopamina) o ridotta (flebo endovenoso isoket, farmaci antipertensivi - enalapril). Per eliminare l'ipossia, l'ossigenoterapia viene eseguita utilizzando ossigeno umidificato attraverso una maschera o cateteri nasali. 2. Shock cardiogeno Lo shock cardiogeno è un disturbo circolatorio critico con ipotensione arteriosa e segni di deterioramento acuto della circolazione sanguigna negli organi e nei tessuti. Clinica e diagnostica Il principale segno diagnostico è una significativa diminuzione della pressione arteriosa sistolica, che è inferiore a 90 mm Hg. Arte. La differenza tra pressione sistolica e diastolica (pressione del polso) è di 20 mm Hg. Arte. o diventando ancora più piccolo. Inoltre, si sta sviluppando una clinica di un forte deterioramento della perfusione di organi e tessuti: 1) alterazione della coscienza da lieve letargia a psicosi o coma, possono comparire sintomi neurologici focali; 2) diuresi inferiore a 20 ml/h. Sintomi di deterioramento della circolazione periferica: pelle pallida cianotica, marmorizzata, mattone, umida; vene periferiche collassate, una forte diminuzione della temperatura della pelle delle mani e dei piedi; diminuzione del flusso sanguigno. Il valore del CVP può essere diverso. Gli indicatori normali di CVP sono 5-8 cm di acqua. Arte.; indicatore sotto i 5 cm di acqua. Arte. indica ipovolemia e bassa pressione sanguigna e oltre 8 cm di acqua. Arte. indica insufficienza ventricolare destra. La diagnosi di shock cardiogeno di solito non è difficile. È più difficile determinarne il tipo e i principali meccanismi fisiopatologici. Prima di tutto, è necessario distinguere il vero shock cardiogeno (contrattile) dallo shock aritmico, riflesso (doloroso), medico dovuto all'insufficienza ventricolare destra o alla rottura del miocardio lentamente in corso. Quando si esegue la terapia intensiva per un paziente con shock, è importante escludere cause di bassa pressione sanguigna, come ipovolemia, tamponamento cardiaco, pneumotorace tensivo, complicanze tromboemboliche e non perdere le emorragie interne, ad esempio con erosioni da stress o ulcere di il tratto gastrointestinale. trattamento È indicata l'ossigenoterapia con ossigeno umidificato attraverso una maschera o cateteri nasali. Gli anticoagulanti vengono somministrati in bolo alla dose di 10 UI, seguita dalla somministrazione endovenosa di una pompa per infusione a 000 UI all'ora. È necessario somministrare analgesici: morfina 1000% 1 ml per via sottocutanea o endovenosa in bolo; analgin 1,0% 50 ml per via intramuscolare, endovenosa. Tonici vascolari: Cordiamin 1-4 ml per via endovenosa; mezaton 1% 1,0 g per via sottocutanea, endovenosa, in soluzione fisiologica; noradrenalina 0,2% 1,0 per via endovenosa. Il vero shock cardiogeno viene trattato come segue. Per aumentare l'attività contrattile del miocardio si usa: strofantina 0,05% 0,5-0,75 g per via endovenosa lentamente per soluzione isotonica 20,0, korglukon 0,01 g per via endovenosa, anche in una soluzione isotonica o in una miscela polarizzante, glucagone 2-4 mg per via endovenosa gocciolare su una soluzione polarizzante. Normalizzazione della pressione sanguigna: noradrenalina 0,2% 2-4 ml per 1 litro di soluzione di glucosio al 5% o soluzione isotonica. La pressione arteriosa è mantenuta a 100 mm Hg. Art., mezaton 1% 1,0 g per via endovenosa; cordiammina 2-4 ml, dopamina 200 mg in 400 ml di reopoliglucina o glucosio al 5%. Con un effetto instabile dei suddetti farmaci, vengono utilizzati idrocortisone 200 mg, prednisolone 90-120 mg. Normalizzazione delle proprietà reologiche del sangue (poiché si formano necessariamente trombi microvascolari, la microcircolazione è disturbata). Eliminazione dell'ipovolemia, poiché la parte liquida del sangue sta sudando: reopoliglyukin, polyglukin - in un volume fino a 100 ml a una velocità di 50,0 ml al minuto. Correzione dell'equilibrio acido-base (lotta contro l'acidosi): bicarbonato di sodio dal 5% a 200,0 ml. Reintroduzione di antidolorifici. Ripristino dei disturbi del ritmo e della conduzione. Ma è sempre necessario controllare il CVP, che consente al rianimatore di determinare la terapia infusionale accettabile. I pazienti con shock cardiogeno non devono essere caricati con acqua. Maggiore è la CVP, minore è la terapia infusionale. 3. Crisi ipertensiva Una crisi ipertensiva è un improvviso aumento della pressione sanguigna a un livello che di solito non è caratteristico di questo paziente, che porta a disturbi circolatori regionali acuti e danni agli organi bersaglio (cuore, cervello, reni, intestino). I fattori esterni che provocano una crisi possono essere: 1) stress psico-emotivo; 2) influenze meteorologiche; 3) consumo eccessivo di sale da cucina. In primavera e in autunno le crisi si verificano più spesso che in inverno e in estate. Le crisi possono verificarsi anche sullo sfondo di un'esacerbazione di una serie di malattie croniche. MS Kushakovsky (1982) identifica le seguenti varianti di crisi ipertensive: neurovegetativa, salina, convulsiva (encefalopatia). clinica I sintomi clinici della crisi si manifestano con acufene, mosche lampeggianti davanti agli occhi, emicrania esplosiva nella regione occipitale, aggravata da piegamenti, sforzi, tosse, nausea, vomito e disturbi del ritmo cardiaco. Durante una crisi, si verificano pericolose violazioni della circolazione coronarica cerebrale, meno spesso renale e addominale, che porta a ictus, infarto del miocardio e altre gravi complicazioni. L'ECG rivela l'ipertrofia ventricolare sinistra. La radiografia del torace mostra un cuore ingrossato, deformità aortica sotto forma del numero "3", usura delle costole a causa dell'aumento del flusso sanguigno collaterale attraverso le arterie intercostali. L'aortografia conferma la diagnosi. La forma neurovegetativa della crisi è caratterizzata da un esordio improvviso, eccitazione, iperemia e umidità della pelle, tachicardia, minzione abbondante e frequente, aumento predominante della pressione sistolica con aumento dell'ampiezza del polso. Tali crisi sono altrimenti chiamate crisi surrenali o di tipo I. Le crisi di tipo I di solito hanno un decorso relativamente benigno, sebbene possano portare ad aritmie parossistiche o angina pectoris e, nei casi più gravi, a infarto del miocardio. Con la forma salina della crisi, la condizione peggiora gradualmente, si notano sonnolenza, debolezza, letargia, disorientamento, pallore e gonfiore del viso e gonfiore. La pressione sistolica e diastolica aumenta in modo uniforme o con una predominanza di quest'ultima e una diminuzione della pressione del polso. Tali crisi sono chiamate crisi di tipo II. Le crisi di tipo II, di regola, sono gravi e possono essere complicate da infarto del miocardio, ictus, insufficienza ventricolare sinistra acuta. È necessario evidenziare le crisi ipertensive che si sviluppano a seguito di una brusca cessazione della terapia antiipertensiva permanente, in particolare l'assunzione di b-bloccanti, nifedipina, simpaticolitici e soprattutto clonidina. trattamento Il trattamento di una crisi ipertensiva consiste in un urgente abbassamento della pressione sanguigna a un livello normale, necessario per prevenire o limitare i danni agli organi bersaglio nell'ipertensione, per prevenire complicazioni fino alla morte nei casi più gravi o disabilità permanente nello sviluppo dell'ictus , infarto miocardico. Nella forma neurovegetativa della crisi vengono solitamente utilizzati il getto endovenoso, la somministrazione lenta di 0,1 mg di clonidina o le infusioni endovenose ripetute di 50 mg di labetalolo. L'effetto ipotensivo della clonidina può essere potenziato dalla somministrazione sublinguale di 10 mg di nifedipina. In casi estremamente gravi, il nitroprussiato di sodio viene iniettato per via endovenosa e, in sua assenza, gocciolamento endovenoso o molto lentamente in modo frazionato - fino a 50 mg di pentamina. I principali pericoli e complicazioni della terapia antipertensiva: 1) ipotensione arteriosa; 2) violazione della circolazione cerebrale (ictus emorragico o ischemico, encefalopatia); 3) edema polmonare; 4) angina pectoris, infarto del miocardio; 5) tachicardia. Le crisi ipertensive pericolose per la vita sono motivo di terapia intensiva immediata. Tipi di crisi ipertensive. 1. Forma convulsiva di crisi ipertensiva (encefalopatia ipertensiva grave acuta). 2. Crisi con feocromocitoma. 3. Ipertensione arteriosa acuta in malattie e condizioni potenzialmente letali (sindrome coronarica acuta, infarto miocardico acuto, aneurisma aortico dissecante, emorragia interna). 4. Crisi ipertensiva complicata da edema polmonare o ictus emorragico. Una forma convulsa di una crisi ipertensiva (encefalopatia ipertensiva grave acuta) si sviluppa in una forma maligna di ipertensione o ipertensione arteriosa secondaria, ad esempio nella tossicosi tardiva delle donne in gravidanza o nella glomerulonefrite acuta. Le crisi iniziano con un forte dolore pulsante, mal di testa ad arco, agitazione psicomotoria, vomito ripetuto che non porta sollievo, disturbi visivi; si verifica rapidamente la perdita di coscienza e compaiono convulsioni clonico-toniche. Nei pazienti con ipertensione arteriosa recente (con glomerulonefrite acuta, tossicosi delle donne in gravidanza), può svilupparsi una crisi ipertensiva convulsiva con un aumento relativamente piccolo della pressione sanguigna. Nella forma convulsiva della crisi, le cure di emergenza mirano all'eliminazione della sindrome convulsiva e all'abbassamento urgente della pressione sanguigna. La sindrome convulsiva viene eliminata dalla somministrazione endovenosa di diazepam. Inoltre, 10 ml di una soluzione al 25% di solfato di magnesio possono essere somministrati per via endovenosa mediante gocciolamento o flusso lento o per via intramuscolare. Il nitroprussiato di sodio, il labetalolo, il diazossido sono usati per abbassare urgentemente la pressione sanguigna. Per combattere l'edema cerebrale, è indicata la somministrazione endovenosa di lasix. Nell'eclampsia, soprattutto se somministrato per via endovenosa, è ancora ampiamente utilizzato il solfato di magnesio, che viene somministrato alla dose di 4 g per 100 ml di una soluzione di glucosio al 5%. Quindi, se necessario, viene eseguita un'iniezione a goccia del farmaco o, invece della successiva iniezione a goccia di solfato di magnesio, è possibile iniettare in profondità per via intramuscolare 20 ml di una soluzione al 25% di solfato di magnesio. Il solfato di magnesio per via endovenosa dovrebbe essere evitato se la donna incinta è in trattamento con calcioantagonisti (un forte calo della pressione sanguigna è pericoloso). Forse con eclampsia e somministrazione endovenosa di clorpromazina (100-250 mg), diazossido (300 mg). Seduxen (diazepam) viene somministrato per via endovenosa lentamente (20-30 mg), quindi gocciola (300 mg in 500 ml di soluzione di glucosio al 5%). Una crisi del feocromocitoma si manifesta con un aumento improvviso, molto rapido e acuto della pressione sanguigna, principalmente sistolica, e un aumento della pressione del polso, accompagnato da pelle pallida, sudore freddo, palpitazioni, dolore al cuore e alla regione epigastrica, nausea, vomito , mal di testa pulsante, vertigini. Durante una crisi, sono possibili un aumento della temperatura corporea, disturbi visivi e dell'udito. Caratterizzato da una diminuzione della pressione sanguigna dopo il passaggio in posizione verticale. Le cure di emergenza in caso di crisi con feocromocitoma iniziano con il sollevamento della testata del letto ad un angolo di 45 °, che provoca una diminuzione della pressione sanguigna. Per la terapia antipertensiva di emergenza, il farmaco di scelta è la fentolamina, che viene somministrata per via endovenosa in un flusso di 5 ml ogni 5 minuti. Allo stesso scopo, viene utilizzata l'iniezione endovenosa di labetalolo 50 ml ogni 5 minuti o l'infusione a goccia di 30 ml di nitroprussiato di sodio in 300 ml di soluzione di glucosio al 5%. Come farmaco aggiuntivo, può essere utile il droperidolo (5-10 ml EV). Per sopprimere la tachicardia, il propranololo viene prescritto alla dose di 20-40 mg. Nell'infarto miocardico acuto (particolarmente spesso notato nella sua localizzazione anteriore), quando durante una crisi aumenta il carico sul miocardio, aumenta la richiesta di ossigeno del miocardio, prima di tutto, è necessario fermare un forte attacco di dolore con l'aiuto dei moderni antidolorifici ( compresi gli analgesici narcotici) e somministrare sedativi che possono abbassare significativamente la pressione sanguigna. Se persiste un'ipertensione significativa e allo stesso tempo aumenta il tono del sistema nervoso simpatico, vengono somministrati b-bloccanti (propranololo, metoprololo, esmololo) per via endovenosa, che, insieme all'effetto ipotensivo, possono limitare l'area peri -ischemia miocardica da infarto. Ricorrere spesso alla somministrazione endovenosa di nitroglicerina per causare una diminuzione del pre e postcarico. Ciò consente di controllare il livello di pressione sanguigna. Va comunque evitata la nomina del nitroprussiato di sodio, che in questi casi può aumentare l'ischemia miocardica, apparentemente per il fenomeno del "furto coronarico" (riduzione del flusso sanguigno collaterale coronarico alla zona ischemica). Se l'ipertensione persiste dopo la fase acuta dell'infarto miocardico, viene avviato il trattamento con i principali agenti antipertensivi, tenendo conto di indicazioni e controindicazioni. Tuttavia, negli ultimi anni, in relazione ai dati sulla prevenzione secondaria, sono più spesso preferiti i b-bloccanti e gli ACE-inibitori, che, in assenza di controindicazioni, si cerca di prescrivere sin dalle prime mestruazioni. Con lo sviluppo dell'insufficienza cardiaca acuta, la crisi ipertensiva viene interrotta dalla somministrazione endovenosa di nitroglicerina (controindicata nella stenosi mitralica grave); prescrivere vasodilatatori (sebbene spesso si sviluppi tolleranza nei loro confronti), IFKA. Con l'ipertensione persistente nei casi di grave insufficienza cardiaca, si ricorre a una combinazione di diuretici e anche piccole dosi di un diuretico tiazidico insieme a un diuretico risparmiatore di potassio (triamterene o amiloride) possono non solo normalizzare la pressione sanguigna, ma anche prevenirne l'insorgenza di aritmie causate da carenza di potassio e magnesio in tali pazienti. (Metelitsa VI, 1996). Nell'ictus emorragico o nell'emorragia subaracnoidea, la pressione sanguigna deve essere ridotta con particolare attenzione, con l'aiuto di farmaci il cui effetto ipotensivo può essere facilmente controllato (nitroprussiato di sodio) e a un livello superiore al normale (funzionante). Qualsiasi diminuzione della pressione sanguigna, accompagnata da un deterioramento dello stato neurologico, è da considerarsi eccessiva. In caso di edema polmonare, nitroglicerina o nitroprussiato di sodio o pentamina, nonché lasix, vengono prescritti per via endovenosa per abbassare urgentemente la pressione sanguigna. Con la dissezione di aneurisma aortico o rottura, i seguenti farmaci vengono utilizzati per via endovenosa per regolare la pressione sanguigna e prepararsi al trattamento chirurgico: nitroprussiato di sodio, diuretici dell'ansa (furosemide), nifedipina, propranololo (insieme al nitroprussiato di sodio), metildopa, reserpina (come agente aggiuntivo ). Nelle crisi causate da un aumento della gittata cardiaca si osservano spesso tachicardia e un aumento predominante della pressione sistolica e del polso, un buon effetto in questi casi è la somministrazione endovenosa di anaprilina e poi, se necessario, di furosemide. 4. Aritmie pericolose per la vita Aritmia Un'aritmia è un ritmo cardiaco diverso dal seno. Un ritmo cardiaco normale ha le seguenti caratteristiche: 1) frequenza cardiaca da 60 a 120 al minuto; 2) il pacemaker è il nodo del seno, la cui evidenza è un'onda P positiva che precede il complesso QRS nella derivazione standard II e negativa nell'AVR; 3) Gli intervalli RR differiscono di non più di 0,01 s; 4) gli indicatori effettivi, che riflettono la dimensione degli intervalli e dei denti nella norma. Tutti i cambiamenti sull'ECG vengono eseguiti nella II derivazione standard. Classificazione delle aritmie 1. Violazione della formazione degli impulsi: 1) nel nodo del seno: a) tachicardia sinusale; b) bradicardia sinusale; c) aritmia sinusale; d) sindrome del seno malato (SSS); 2) aritmie ectopiche: a) extrasistolia; b) tachicardia parossistica; c) fibrillazione atriale e flutter; d) sfarfallio e sfarfallio dei ventricoli. 2. Violazione della conduzione degli impulsi: 1) percorsi aggiuntivi (pacchetti Kent); 2) blocco cardiaco: a) atriale (intra-atriale); b) atrioventricolare; c) intraventricolare. Meccanismi delle aritmie Una diminuzione del potenziale di riposo, la soglia di eccitabilità si verifica solo sulla base di una carenza di potassio cellulare, il rapporto "plasma - cellula" (normalmente 80 meq di potassio sono nella cellula e 5 meq nel plasma). Asimmetria del focus elettrofisiologico-metabolico del miocardio a causa di ischemia, infiammazione, riperfusione durante la trombolisi. Debolezza elettrofisiologica del pacemaker superiore. Vie di conduzione accessorie congenite. Tachicardia parossistica sopraventricolare La tachicardia parossistica sopraventricolare è un improvviso attacco di battito cardiaco con una frequenza di 150-250 battiti al minuto. Ci sono 3 forme: 1) atriale; 2) nodale; 3) ventricolare. L'eziologia della tachicardia parossistica sopraventricolare è più spesso associata ad un aumento dell'attività del sistema nervoso simpatico. Si manifesta clinicamente con un improvviso attacco del battito cardiaco, i vasi del collo pulsano, l'attività cardiaca passa a un ritmo diverso. La durata dell'attacco va da alcuni minuti a diversi giorni. Il numero di battiti cardiaci nella forma ventricolare è solitamente compreso tra 150 e 180 battiti al minuto, con le forme sopraventricolari - 180-240 battiti al minuto. Durante un attacco, un ritmo a pendolo è caratteristico dell'auscultazione, non c'è differenza tra I e II tono. Aumenta la richiesta di ossigeno del miocardio e può provocare un attacco di insufficienza coronarica acuta. Segni ECG 1. I complessi QRS non vengono modificati. 2. Nella forma sopraventricolare, l'onda P si fonde con T. Il trattamento inizia con la somministrazione endovenosa di cordarone alla dose di 300 mg o novocainamide fino a 1 g, quindi adenosina 1 ml - 1% (10 mg) in bolo. I calcioantagonisti verapamil (Isoptin) sono usati per via endovenosa come bolo alla dose di 2,5-5 mg in 2-4 minuti. Ma è usato per complessi QRS stretti e per quelli larghi può fibrillare. È possibile assumere b-bloccanti (propranololo 20-40 mg per via sublinguale). Parossismo di fibrillazione atriale Il parossismo della fibrillazione atriale è caratterizzato dall'assenza di complessi atriali e, invece di un'isolina, vengono rilevate onde a dente di sega di flutter atriale, che sono più distinte nelle derivazioni II, III e VF con una frequenza di 250-400 battiti al minuto. Oppure non ci sono complessi atriali, vengono rilevate onde di sfarfallio, oscillazioni di onde grandi o piccole dell'isolina, la frequenza delle onde atriali è di 350-600 battiti al minuto. Clinica. Il polso è aritmico con onde di riempimento diverso, la presenza di un deficit del polso (la differenza tra frequenza cardiaca e polso); intervalli differenti e volume differente dei toni cardiaci durante l'auscultazione. Trattamento. In caso di parossismo, inizia con l'introduzione di digossina 0,25 mg (1 ml di 0,025%) per 20 ml di soluzione salina in bolo endovenoso. Per ottenere l'effetto desiderato di saturazione con glicosidi, si raccomanda una dose di 1,5 mg di digossina al giorno o 3 giorni. Con il parossismo semplice, il farmaco di scelta è la novocainamide, somministrata per via endovenosa lentamente a una dose fino a 2000 ml in 30 minuti (10 ml di una soluzione al 10%) con monitoraggio costante di pressione sanguigna, frequenza cardiaca, ECG. Il flutter atriale viene trattato con la terapia ad impulsi elettrici. Tachicardia ventricolare parossistica La tachicardia ventricolare parossistica è caratterizzata dal rilevamento di 3 o più complessi QRS consecutivi ampi (più di 0,12 s) con una frequenza di 100-250 battiti al minuto con uno spostamento discordante del segmento ST e dell'onda T nella direzione opposta al onda principale del complesso QRS. La piroetta, o tachicardia ventricolare fusiforme bidirezionale, si verifica quando l'intervallo QT si allunga, in questo caso si registra un ritmo irregolare con una frequenza cardiaca di 150-250 battiti per 1 minuto con complessi QRS ampi polimorfi deformati. Trattamento. In condizioni di ipodinamia della circolazione sanguigna, è necessaria la terapia elettropulsante, dopodiché viene eseguita la terapia di mantenimento con una flebo di lidocaina. In condizioni di emodinamica stabile, il farmaco di scelta è la lidocaina, bolo endovenoso 1-2 mg/kg (80-100 mg) per 3-5 minuti, seguito da infusione a goccia durante la giornata a 4 mg/min. Extrasistolia ventricolare L'extrasistole ventricolare è il verificarsi di un complesso QRS estremamente ampio e deformato, uno spostamento ST e T discordante, una pausa compensativa completa (l'intervallo tra l'onda P pre e post extrasistolica è pari al doppio del normale intervallo RR). Il farmaco di scelta è la lidocaina, che viene somministrata secondo lo schema di cui sopra. Forse l'uso di cordarone alla dose di 300-450 mg per via endovenosa. Violazione della conduzione AV con sviluppo di sincope (sindrome di Morgagni-Adams-Stokes) Quando la conduzione è disturbata, si verificano vari tipi di blocchi cardiaci, c'è un rallentamento o una completa cessazione della conduzione dell'impulso attraverso il sistema di conduzione del cuore. Il blocco senoauricolare è caratterizzato da disfunzione dei linfociti T e ridotta conduzione degli impulsi dal nodo seno-atriale agli atri. Ci sono 3 gradi. I grado - rallentando l'impulso. Sull'ECG - prolungamento dell'intervallo PQ per più di 0,20 s. Prolasso del complesso QRS. L'intervallo RR è stabile. II grado - perdita di parte degli impulsi, conduzione incompleta. Mobitz tipo I - man mano che gli impulsi vengono eseguiti, l'intervallo PQ si allunga gradualmente fino alla completa perdita dell'onda del polso. QRS non viene modificato. Nel sito del prolasso QRS, la distanza maggiore è RR. Prognosticamente, questo tipo è relativamente favorevole. Mobitz tipo II con un intervallo PQ costante e un complesso QRS invariato. Allo stesso tempo, non tutti gli impulsi raggiungono i ventricoli - in alcuni casi viene eseguito ogni secondo impulso, in altri - ogni terzo, ecc., cioè c'è un prolasso periodico del complesso QRS 3: 2, 4: 3 , 5: 6, ecc. d. III grado - blocco completo della conduzione. Allo stesso tempo, la conduzione degli impulsi ai ventricoli viene completamente interrotta e nei ventricoli nasce un focus eterotopico del ritmo idioventricolare e più basso è l'automatismo, più difficile è la clinica. Si osserva una dissociazione completa: il ritmo atriale è vicino al normale e i ventricoli hanno una frequenza propria - 40 battiti al minuto o meno. Quest'ultimo dipende dal livello di danno: se il nodo AV soffre, 40-50 per 1 minuto, se la gamba del fascio di His - 20 battiti per 1 minuto o meno. Il livello di danno è indicato anche dal grado di deformazione del complesso QRS. I suoni del cuore sono indeboliti, periodicamente c'è un "cannone" I tono, quando la sistole degli atri e dei ventricoli quasi coincide nel tempo. Può essere III tono aggiuntivo. Alla base del cuore possono comparire soffi di eiezione sistolica. Spesso si riscontra una pulsazione delle vene associata alla contrazione atriale, particolarmente distinta dal tono cannone di Strazhesko. Clinica. Fallimento del cuore, se cade un impulso. Vertigini se cadono diversi impulsi. Sindrome di Morgagni-Adams-Stokes (perdita di coscienza), se cadono 6-8 complessi. Trattamento. Per ripristinare un ritmo adeguato, l'atropina viene somministrata alla dose da 0,5-1 mg a 3 mg. Ogni 3 minuti, 1 mg per una dose totale di 0,4 mg/kg. Calcio antagonisti - isoptina 0,04 mg/kg. Con la frequente perdita di coscienza, il paziente viene trasferito alla terapia elettropulsante permanente. Ma più spesso il ritmo deve essere eseguito "on demand". Lezione numero 7. Insufficienza renale acuta L'insufficienza renale acuta (ARF) è una complicazione di una serie di malattie renali ed extrarenali caratterizzate da un forte deterioramento o cessazione della funzione renale e manifestata dal seguente complesso sintomatologico: oligoanuria, azotemia, iperidratazione, alterata CBS e bilancio idrico ed elettrolitico. Le forme di OOP includono: 1) prerenale (emodinamico); 2) renale (parenchimale); 3) postrenale (ostruttivo); 4) areale. eziologia Ragioni per lo sviluppo dell'insufficienza renale acuta prerenale. 1. Diminuzione della gittata cardiaca (shock cardiogeno, aritmia parossistica, tamponamento cardiaco, embolia polmonare, insufficienza cardiaca congestizia). 2. Diminuzione del tono vascolare (sepsi, shock tossico-infettivo, shock anafilattico, sovradosaggio di farmaci antipertensivi). 3. Diminuzione del volume intravascolare efficace (perdita di sangue, perdita di plasma, disidratazione - perdita del 7-10% del peso corporeo, vomito profuso, diarrea, poliuria, ipovolemia con nefropatia in gravidanza, sindrome nefrosica, peritonite, cirrosi epatica). 4. Violazione dell'emodinamica intrarenale (assunzione di FANS, ACE-inibitori, farmaci radiopachi, sandimmune). 5. Avvelenamento da acqua - iperidratazione (produzione incontrollata di ADH nei tumori maligni, malattie infiammatorie del sistema nervoso centrale, sovradosaggio di farmaci - farmaci, barbiturici, farmaci antidiabetici sulfanilamide, indometacina, amitriptilina, ciclofosfamide). Ragioni per lo sviluppo dell'insufficienza renale acuta renale. 1. Ischemia renale (shock, disidratazione). 2. Danno nefrotossico dovuto all'esposizione a: 1) farmaci (aminoglicosidi, FANS, agenti radiopachi, sulfamidici, fenacetina, barbiturici, cefalosporine, ampicillina, rimfapicina, sandimmune); 2) nefrotossine industriali (sali di metalli pesanti: mercurio, cromo, cadmio, piombo, arsenico, platino, bismuto, oro, uranio, bario); 3) nefrotossine domestiche (glicole etilenico, alcol metilico, dicloroetano, tetracloruro di carbonio). 3. Ostruzione intratubulare da pigmenti: 1) emoglobina (emolisi - trasfusione di sangue incompatibile, avvelenamento da funghi, acido acetico, anemia emolitica, sindrome emolitico-uremica, porpora trombotica trombocitopenica); 2) urati (gotta, terapia immunosoppressiva per il mieloma multiplo e la leucemia in forte sforzo fisico, in persone non adattate al caldo); 3) mioglobina (rabdomiolisi traumatica, rabdomiolisi non traumatica in coma, danno elettrico, congelamento, eclampsia, miopatia alcolica ed eroina, grave ipokaliemia e ipofosfatemia, avvelenamento da monossido di carbonio, sali di mercurio, zinco, rame, farmaci, miosite virale, sovradosaggio di statine e fibrati); 4) processi infiammatori: OTIN di genesi medicinale e infettiva (AIDS, HFRS, morbillo, mononucleosi, leptospirosi, micoplasmosi, rickettsiosi) pielonefrite acuta, glomerulonefrite acuta; 5) papillite necrotica (diabete mellito, analgesico, nefropatia alcolica); 6) patologia vascolare (vasculite - poliarterite nodosa, granulomatosi di Wegener, sclerodermia sistemica; trombosi arteriosa o venosa, embolia arteriosa renale bilaterale, lesione traumatica). Ragioni per lo sviluppo dell'insufficienza renale acuta postrenale. 1. Patologia degli ureteri: 1) ostruzione (calcolo, coaguli di sangue, papillite necrotica); 2) compressione (tumore degli organi pelvici, fibrosi retroperitoneale). 2. Patologia della vescica (calcoli, tumori, ostruzione infiammatoria del collo vescicale, adenoma prostatico, alterata innervazione nelle lesioni del midollo spinale e neuropatia diabetica). 3. Stenosi uretrale. Classificazione Classificazione OPN secondo E. M. Tareev. 1. Shock renale. 2. Rene tossico. 3. Rene infettivo acuto. 4. Ostruzione vascolare. 5. Rene urologico. Opzioni per il decorso dell'insufficienza renale acuta: ciclico, ricorrente e irreversibile. clinica Ci sono cinque fasi nel decorso clinico dell'insufficienza renale acuta. Lo stadio I dell'insufficienza renale acuta è iniziale, dura dal momento in cui si manifesta il fattore eziologico fino alla comparsa dei primi segni. In questa fase, le tattiche terapeutiche mirano ad eliminare o mitigare l'impatto del fattore eziologico: terapia anti-shock, reintegrare il BCC, combattere l'insufficienza cardiaca, terapia alcalinizzante per l'emolisi intravascolare, combattere il dolore, trattare condizioni settiche, ecc. Insieme a eziologico terapia, lo spasmo dei vasi renali viene eliminato sotto il controllo della diuresi oraria. Quanto prima si inizia la stimolazione della diuresi, tanto più favorevole è la prognosi. Lo stadio II dell'insufficienza renale acuta, o oligoanurico, è caratterizzato da una disfunzione del 70% dei nefroni. Una minzione inferiore a 500 ml al giorno indica lo sviluppo dell'oliguria e la sua diminuzione a 50 ml al giorno. e sotto indica l'anuria. Insieme a una violazione della capacità di eliminazione dell'acqua dei reni, soffrono anche le funzioni di concentrazione e di eliminazione dell'azoto. Nelle urine, la quantità di elettroliti e azoto diminuisce drasticamente. In questa fase si verificano i cambiamenti più pronunciati nell'emostasi. Il trattamento dovrebbe mirare a mantenere un ambiente interno costante per dare tempo e opportunità all'epitelio renale di rigenerarsi. Uno stato di iperidratazione si sviluppa a causa della perdita di elettroliti durante il vomito e la diarrea. Pertanto è necessario stimolare la diuresi, ma solo sotto il controllo della pressione venosa centrale. Migliora il flusso sanguigno renale. Poiché è necessario controllare rigorosamente la diuresi, viene eseguita la cateterizzazione della vescica. La ridotta funzione escretrice dell'azoto da parte dei reni porta all'azotemia, pertanto, per prevenire al massimo la disgregazione delle proteine nel corpo, è necessario introdurre una quantità sufficiente di carboidrati (almeno 5 g/kg al giorno). Vengono introdotti fruttosio e glucosio, aggiungendo xilitolo (sorbitolo) in proporzioni di 2: 1: 1 e, se non c'è fruttosio, quindi 3 parti di glucosio e 1 parte di sorbitolo. Se il decorso è grave e non può essere trattato, vengono eseguite sessioni di emodialisi. Se il fattore eziologico viene rimosso, dopo 5-7 giorni di trattamento la diuresi inizia ad aumentare. La durata massima di questa fase è fino a 2 settimane. III stadio di insufficienza renale acuta - poliurico precoce. È caratterizzato da un progressivo aumento della diuresi (di 200-300 ml al giorno) fino a 3 litri. Le funzioni di escrezione e concentrazione di azoto dei reni non si sono ancora completamente riprese, ma la concentrazione di potassio, magnesio e fosfati si sta gradualmente normalizzando. La terapia intensiva nella fase poliurica precoce dovrebbe comprendere le stesse misure della precedente, fatta eccezione per la stimolazione della diuresi. Spesso è necessaria l'emodialisi. C'è un alto rischio di disidratazione. IV stadio di insufficienza renale acuta - poliuria tardiva. L'aumento giornaliero delle urine raggiunge 500-1000 ml e la diuresi può raggiungere 8-10 litri al giorno o più. Nei reni, i processi di scambio ionico iniziano a riprendersi. Le perdite di potassio, magnesio, fosforo e altri elettroliti aumentano drasticamente, i pazienti sono a rischio di disidratazione e demineralizzazione. Pertanto, in questa fase gli elettroliti e il fluido vengono somministrati per via endovenosa. Fase V OPN, o fase di recupero. Viene ripristinata la funzione di concentrazione dei reni. La diuresi inizia a diminuire gradualmente fino alla normalità (2-3 litri al giorno) e la densità delle urine aumenta (1008-1028). Per determinare la gravità della malattia e l'efficacia del trattamento, i pazienti con insufficienza renale acuta vengono esaminati quotidianamente nel sangue per gli indicatori di CBS, la concentrazione di elettroliti, emoglobina, zucchero, proteine totali e frazioni proteiche, urea, residuo e azoto ureico , creatinina, ematocrito e nelle urine quotidiane - densità, quantità di elettroliti e azoto. trattamento I principi di trattamento sono i seguenti. 1. Trattamento dello shock: misure anti-shock, glucocorticosteroidi. 2. Rifornimento di BCC: poliglucina, reopoligliuchina, plasma, albumina, massa eritrocitaria. 3. Trattamento delle infezioni: adeguata terapia antibiotica. 4. Disidratazione: soluzione isotonica, ipertonica, ipotonica di cloruro di sodio, glucosio. 5. Avvelenamento con veleni: vengono introdotti gli antidoti. 6. Rene urologico: eliminazione dell'ostruzione. 7. Ostruzione intratubulare: terapia alcalinizzante intensiva continua fino a 60 ore (mannitolo 10% soluzione 3-5 ml/kg/ora con soluzione isotonica di cloruro di sodio, sodio bicarbonato, glucosio 400-600 ml/ora, furosemide 30-50 mg / kg). 8. Eliminazione dello spasmo dei vasi renali: eufillina 2,4% - 10 ml nuovamente dopo 4-6 ore, carillon 0,5% - 2-4-6 ml per via endovenosa, trental 3-5 mg / kg al giorno, pentamina 0,5-1,0 mg /kg al giorno, benzoesonio 0,3-0,5 mg/kg al giorno, droperidolo 0,12 mg/kg al giorno, dopamina 1,5-3 mg/kg. 9. Stimolazione della diuresi (dopo stabilizzazione della pressione sanguigna ed eliminazione dell'ipovolemia): aminofillina, mannitolo, lasix. 10. Controllo della diuresi oraria, pressione sanguigna, CVP. Indicazioni per l'emodialisi acuta: insufficienza renale acuta ipercatabolica, mancanza di effetto della terapia conservativa nell'insufficienza renale acuta non catabolica per 2-3 giorni, iperkaliemia superiore a 6-6,5 mmol/l, acidosi metabolica scompensata con deficit di basi superiore a 15 mmol/ l, creatinina ematica superiore a 600 µmol /l, urea ematica superiore a 30 mmol/l, iperidratazione con sviluppo di edema polmonare o cerebrale. Lezione numero 8. Insufficienza epatica acuta L'insufficienza epatica acuta è un complesso di sintomi caratterizzato da una violazione di una o più funzioni epatiche a causa di un danno acuto o cronico al suo parenchima. eziologia Le cause dell'insufficienza renale acuta possono essere virus dell'epatite A, B, C, D, E, G, nonché virus dell'herpes, citomegalovirus, virus della mononucleosi infettiva, simplex e herpes zoster, Coxsackie, morbillo, setticemia che si sviluppa con ascessi epatici e colangite purulenta, droghe, alcol, tossine industriali, insufficienza cardiaca. L'AKI procede sempre con danni d'organo multipli: i reni, il sistema cardiovascolare, i polmoni, il pancreas e il cervello sono coinvolti nel processo. La funzionalità renale compromessa si manifesta come necrosi tubulare acuta. Complicanze polmonari - aspirazione del contenuto gastrico o del sangue, atelettasia, infezioni respiratorie. La pancreatite acuta e la necrosi pancreatica possono causare la morte. Si sviluppa un disturbo dell'omeostasi pericoloso per la vita. L'insufficienza epatica è spiegata dalla distrofia e dalla necrobiosi diffusa degli epatociti. Clinica e diagnostica Le manifestazioni cliniche di ARF sono le seguenti. 1. La coagulopatia è causata da una carenza di fattori della coagulazione e da un aumento dell'attività fibrinolitica. Predispone al sanguinamento spontaneo dalle mucose: si possono osservare emorragie gastrointestinali, uterine, nasali. Sono possibili emorragie cerebrali. Per valutare lo stato del sistema emostatico, viene determinato il tempo di protrombina. 2. L'ipoglicemia è caratterizzata da un alto livello di insulina nel plasma, dovuto a una diminuzione della sua captazione da parte del fegato. Porta a un rapido deterioramento dello stato neurologico e alla morte dei pazienti. 3. Violazioni dell'equilibrio idroelettrolitico e acido-base. L'insufficienza renale acuta allo stadio terminale è caratterizzata da iponatriemia, ipofosfatemia, ipocalcemia e ipomagnesiemia. Il cambiamento nello stato acido-base non ha una direzione univoca. L'alcalosi respiratoria associata alla stimolazione del centro respiratorio con sostanze tossiche può essere sostituita dall'acidosi respiratoria a causa dell'aumento della pressione intracranica e della soppressione dell'attività respiratoria. Nello sviluppo del coma epatico come decorso grave della malattia, si distinguono gli stadi del precoma, del coma minaccioso e del coma vero e proprio. Sono presenti anche coma epatocellulare (endogeno), risultante da necrosi massiva del parenchima, porto-cavale (bypass, shunt, esogeno), a causa di una significativa esclusione del fegato dai processi metabolici per la presenza di pronunciate anastomosi porto-cavali, e coma misto, che si verifica principalmente con la cirrosi epatica. Nel periodo precomatoso si sviluppano anoressia progressiva, nausea, diminuzione delle dimensioni del fegato, aumento dell'ittero, iperbilirubinemia e aumento del contenuto di acidi biliari nel sangue. In futuro, aumentano i disturbi neuropsichici, il rallentamento del pensiero, la depressione e talvolta l'euforia. Caratterizzato da instabilità dell'umore, irritabilità, la memoria è disturbata, il sonno è disturbato. I riflessi tendinei sono aumentati, è caratteristico un piccolo tremore degli arti. Si sviluppa l'azotemia. Con una terapia tempestiva, i pazienti possono uscire da questo stato, ma più spesso con gravi cambiamenti irreversibili nel fegato, si verifica il coma. Durante il periodo di coma è possibile l'eccitazione, che viene poi sostituita dalla depressione (stupore) e da un progressivo deterioramento della coscienza fino alla sua completa perdita. Si sviluppano fenomeni meningei, riflessi patologici, irrequietezza motoria, convulsioni. La respirazione è disturbata (come Kussmaul, Cheyne-Stokes); il polso è piccolo, aritmico; c'è l'ipotermia. Il viso del paziente è smunto, le estremità sono fredde, un caratteristico odore dolciastro del fegato proviene dalla bocca e dalla pelle, i fenomeni emorragici si intensificano (emorragie cutanee, sanguinamento dal naso, gengive, vene varicose dell'esofago, ecc.). L'insufficienza epatica acuta si sviluppa rapidamente, entro poche ore o giorni, e con una terapia tempestiva può essere reversibile. Studi di laboratorio: bilirubina, urea e creatinina nel sangue e nelle urine, parametri del sistema emostatico, emocromo completo e urine, CVP, ECG, osmolarità plasmatica e urinaria, elettroliti plasmatici, emoglobina plasmatica e urinaria libera, ALT, AST, fosfatasi alcalina, LDH, CPK, tempo di protrombina. La tomografia computerizzata del fegato può rivelare una diminuzione delle sue dimensioni, ma la maggior parte dei medici si concentra sui dati clinici e di laboratorio. trattamento Il tempestivo supporto inotropo è una componente essenziale della terapia intensiva. Prevenzione delle complicanze infettive - nomina di antibiotici cefalosporinici in combinazione con farmaci antimicotici (amfotericina-B). Epatoprotettori e farmaci stabilizzanti di membrana: prednisolone fino a 300 mg, vitamina C 500 mg, troxevasina 5 ml, sodio etamsilato 750 mg, Essentiale 30 ml, tocoferolo 4 ml per via intramuscolare, citomak 35 mg, cocarbossilasi 300 mg, acido nicotinico 30-40 mg, complamin 900 mg, sirepar 5-10 ml, acido glutammico 1% 400 ml, vikasol 10 ml per via endovenosa, vitamine del gruppo B. Inibitori della proteasi, che comprendono 100 mila unità corticali, trasilolo 400 mila unità, antagonosan, gordox. Stimolazione della diuresi: reogluman 400 ml, mannitolo, lasix fino a 200 mg per via endovenosa, eufillina 240 mg. Per correggere la coagulopatia, viene utilizzata la somministrazione endovenosa di vitamina K (10 mg al giorno per 3 giorni). L'effetto si verifica dopo 3 ore In questo caso, l'eliminazione dell'ipoprotrombinemia è associata a un ridotto assorbimento della vitamina K, derivante da una carenza di acidi biliari. In caso di sanguinamento o di sospette procedure invasive (cateterizzazione vascolare, dialisi peritoneale), la massa piastrinica o il plasma fresco congelato vengono somministrati per via endovenosa. L'edema cerebrale è una causa comune di morte. Il mannitolo viene somministrato alla velocità di 1 g/kg di peso corporeo. Nei pazienti con insufficienza renale, il mannitolo viene prescritto in combinazione con l'ultrafiltrazione per evitare iperosmolarità e iperidratazione. Con lo sviluppo del coma epatico, viene prescritto cloruro di potassio (soluzione allo 0,4-0,5% in una soluzione di glucosio al 5% con un volume di 500 ml per via endovenosa) o soluzione di bicarbonato di sodio (con acidosi metabolica); I pazienti respirano ossigeno umidificato attraverso un catetere nasale. Con una diminuzione della pressione arteriosa e venosa, la poliglucina e l'albumina vengono somministrate per via endovenosa. In presenza di emorragie massicce, vengono prese misure appropriate per fermarli, viene trasfuso sangue di un gruppo e vengono somministrati farmaci che contengono fattori di coagulazione del sangue. Con segni significativi di coagulazione intravascolare disseminata, l'eparina viene somministrata per via endovenosa alla dose di 10-000 UI in bolo. In caso di insufficienza renale, vengono eseguite l'emodialisi peritoneale e la plasmaferesi, che danno un buon risultato, ma l'introduzione dell'eparina è controindicata prima di queste manipolazioni. Per fermare l'agitazione psicomotoria e le convulsioni, vengono prescritti diprazina, aloperidolo, sodio ossibutirrato. Nei casi più gravi, ricorrere all'intubazione e alla ventilazione meccanica. È importante ricordare che esiste un alto rischio di sanguinamento, quindi tutte le manipolazioni devono essere eseguite con estrema cautela. Quando si rimuove il paziente dal coma, il passo successivo è condurre una terapia intensiva per la malattia sottostante. Lezione n. 9. Shock Lo shock è una forma di uno stato critico del corpo, manifestato da disfunzioni multiple d'organo, che si sviluppa a cascata sulla base di una crisi circolatoria generalizzata e, di regola, termina con la morte senza trattamento. Un fattore shock è qualsiasi effetto sul corpo che supera i meccanismi adattivi in termini di forza. In stato di shock, le funzioni della respirazione, del sistema cardiovascolare e dei reni cambiano, i processi di microcircolazione di organi e tessuti e i processi metabolici sono disturbati. Eziologia e patogenesi Lo shock è una malattia di natura polietiologica. A seconda dell'eziologia dell'occorrenza, i tipi di shock possono essere diversi. 1. Shock traumatico: 1) con lesioni meccaniche - fratture ossee, ferite, compressione dei tessuti molli, ecc.; 2) con ustioni (ustioni termiche e chimiche); 3) sotto l'influenza della bassa temperatura - shock da freddo; 4) in caso di lesioni elettriche - scossa elettrica. 2. Shock emorragico o ipovolemico: 1) si sviluppa a causa di sanguinamento, perdita di sangue acuta; 2) a seguito di una grave violazione del bilancio idrico, si verifica la disidratazione del corpo. 3. Shock settico (batterico-tossico) (processi purulenti generalizzati causati da microflora gram-negativa o gram-positiva). 4. Shock anafilattico. 5. Shock cardiogeno (infarto del miocardio, insufficienza cardiaca acuta). Considerato nella sezione condizioni di emergenza in cardiologia. In tutti i tipi di shock, il principale meccanismo di sviluppo è la vasodilatazione e, di conseguenza, aumenta la capacità del letto vascolare, l'ipovolemia - il volume del sangue circolante (BCC) diminuisce, poiché ci sono vari fattori: perdita di sangue, ridistribuzione di fluido tra il sangue e i tessuti o una mancata corrispondenza del volume sanguigno normale che aumenta la capacità vascolare. La conseguente discrepanza tra il BCC e la capacità del letto vascolare è alla base della diminuzione della gittata cardiaca e dei disturbi del microcircolo. Quest'ultimo porta a seri cambiamenti nel corpo, poiché è qui che si svolge la funzione principale della circolazione sanguigna: lo scambio di sostanze e ossigeno tra la cellula e il sangue. Si verifica un ispessimento del sangue, un aumento della sua viscosità e una microtrombosi intracapillare. Successivamente, le funzioni cellulari vengono interrotte fino alla loro morte. Nei tessuti, i processi anaerobici iniziano a prevalere su quelli aerobici, il che porta allo sviluppo dell'acidosi metabolica. L'accumulo di prodotti metabolici, principalmente acido lattico, aumenta l'acidosi. Una caratteristica della patogenesi dello shock settico è una violazione della circolazione sanguigna sotto l'influenza di tossine batteriche, che contribuisce all'apertura di shunt artero-venosi e il sangue inizia a bypassare il letto capillare e scorre dalle arteriole alle venule. A causa della diminuzione del flusso sanguigno capillare e dell'azione delle tossine batteriche specificamente sulla cellula, la nutrizione cellulare viene interrotta, il che porta a una diminuzione dell'apporto di ossigeno alle cellule. Nello shock anafilattico, sotto l'influenza dell'istamina e di altre sostanze biologicamente attive, i capillari e le vene perdono il loro tono, mentre il letto vascolare periferico si espande, la sua capacità aumenta, il che porta a una ridistribuzione patologica del sangue. Il sangue inizia ad accumularsi nei capillari e nelle venule, causando una violazione dell'attività cardiaca. Il BCC formato contemporaneamente non corrisponde alla capacità del letto vascolare e il volume minuto del cuore (gittata cardiaca) diminuisce di conseguenza. Il conseguente ristagno di sangue nel letto microcircolatorio porta a una rottura del metabolismo e dell'ossigeno tra la cellula e il sangue a livello del letto capillare. I suddetti processi portano all'ischemia del tessuto epatico e all'interruzione delle sue funzioni, che esacerba ulteriormente l'ipossia nelle fasi gravi dello sviluppo dello shock. Disintossicazione violata, formazione di proteine, formazione di glicogeno e altre funzioni del fegato. Il disturbo del flusso sanguigno regionale principale e della microcircolazione nel tessuto renale contribuisce all'interruzione delle funzioni di filtrazione e concentrazione dei reni con una diminuzione della diuresi dall'oliguria all'anuria, che porta all'accumulo di rifiuti azotati nel paziente corpo, come urea, creatinina e altre sostanze di prodotti metabolici tossici. Le funzioni della corteccia surrenale sono compromesse, la sintesi di corticosteroidi (glucocorticoidi, mineralcorticoidi e ormoni androgeni) è ridotta, il che aggrava i processi in corso. I disturbi circolatori nei polmoni spiegano la violazione della respirazione esterna, lo scambio di gas alveolare diminuisce, si verifica lo shunt di sangue, si forma la microtrombosi e, di conseguenza, lo sviluppo di insufficienza respiratoria, che aggrava l'ipossia tissutale. clinica Lo shock emorragico è una reazione del corpo alla conseguente perdita di sangue (la perdita del 25-30% di BCC porta a uno shock grave). In caso di shock da ustione, il fattore del dolore e la massiccia perdita di plasma giocano un ruolo dominante. Oliguria e anuria in rapido sviluppo. Lo sviluppo dello shock e la sua gravità sono caratterizzati dal volume e dal tasso di perdita di sangue. Sulla base di quest'ultimo, si distinguono lo shock emorragico compensato, lo shock reversibile scompensato e lo shock irreversibile scompensato. Con shock compensato, pallore della pelle, sudore freddo e appiccicoso, il polso diventa piccolo e frequente, la pressione sanguigna rimane nell'intervallo normale o è leggermente ridotta, ma leggermente la minzione diminuisce. Con shock reversibile non compensato, la pelle e le mucose diventano cianotiche, il paziente diventa letargico, il polso è piccolo e frequente, c'è una significativa diminuzione della pressione arteriosa e venosa centrale, si sviluppa oliguria, l'indice di Algover è aumentato, l'ECG mostra un violazione dell'apporto di ossigeno al miocardio. Con un corso irreversibile di shock, la coscienza è assente, la pressione sanguigna scende a valori critici e potrebbe non essere rilevata, la pelle è color marmo, si sviluppa anuria - la cessazione della minzione. L'indice Algover è alto. Per valutare la gravità dello shock emorragico, la determinazione del BCC, il volume della perdita di sangue, è di grande importanza. La mappa di analisi della gravità dello shock e la valutazione dei risultati ottenuti sono mostrate in Tabella 4 e Tabella 5. Tabella 4 Mappa dell'analisi della gravità degli urti
Tabella 5 Valutazione dei risultati per punti totali
L'indice di shock, o indice di Algover, è il rapporto tra frequenza cardiaca e pressione sistolica. In stato di shock del primo grado, l'indice Algover non supera 1. Nel secondo grado - non più di 2; con un indice superiore a 2, la condizione si caratterizza come incompatibile con la vita. Tipi di shock Lo shock anafilattico è un complesso di varie reazioni allergiche di tipo immediato, che raggiungono un grado estremo di gravità. Esistono le seguenti forme di shock anafilattico: 1) forma cardiovascolare, in cui si sviluppa un'insufficienza circolatoria acuta, manifestata da tachicardia, spesso con disturbi del ritmo cardiaco, fibrillazione ventricolare e atriale e diminuzione della pressione sanguigna; 2) forma respiratoria, accompagnata da insufficienza respiratoria acuta: mancanza di respiro, cianosi, stridore, respiro gorgogliante, rantoli umidi nei polmoni. Ciò è dovuto a una violazione della circolazione capillare, gonfiore del tessuto polmonare, laringe, epiglottide; 3) forma cerebrale dovuta a ipossia, alterata microcircolazione ed edema cerebrale. In base alla gravità del corso, si distinguono 4 gradi di shock anafilattico. I grado (lieve) è caratterizzato da prurito della pelle, comparsa di eruzioni cutanee, mal di testa, vertigini, sensazione di vampate alla testa. II grado (moderato) - Ai sintomi precedentemente indicati si uniscono edema di Quincke, tachicardia, abbassamento della pressione arteriosa, aumento dell'indice di Algover. Il grado III (grave) si manifesta con perdita di coscienza, insufficienza respiratoria e cardiovascolare acuta (mancanza di respiro, cianosi, respiro stridore, polso piccolo e rapido, forte diminuzione della pressione sanguigna, alto indice di Algover). Il grado IV (estremamente grave) è accompagnato da perdita di coscienza, grave insufficienza cardiovascolare: il polso non è determinato, la pressione sanguigna è bassa. Trattamento. Il trattamento viene effettuato secondo i principi generali del trattamento d'urto: ripristino dell'emodinamica, flusso sanguigno capillare, uso di vasocostrittori, normalizzazione del BCC e microcircolazione. Misure specifiche mirano a inattivare l'antigene nel corpo umano (ad esempio, penicillinasi o b-lattamasi sotto shock causati da antibiotici) o prevenire l'effetto dell'antigene sul corpo - antistaminici e stabilizzatori di membrana. 1. Infusione endovenosa di adrenalina fino alla stabilizzazione emodinamica. Puoi usare la dopmina 10-15 mcg / kg / min e con sintomi di broncospasmo e agonisti b-adrenergici: alupent, brikanil flebo per via endovenosa. 2. Terapia infusionale in un volume di 2500-3000 ml con l'inclusione di poliglucina e reopoliglucina, a meno che la reazione non sia causata da questi farmaci. Sodio bicarbonato 4% 400 ml, soluzioni di glucosio per ripristinare bcc ed emodinamica. 3. Stabilizzatori di membrana per via endovenosa: prednisolone fino a 600 mg, acido ascorbico 500 mg, troxevasina 5 ml, sodio etamsilato 750 mg, citocromo C 30 mg (sono indicate le dosi giornaliere). 4. Broncodilatatori: eufillin 240-480 mg, noshpa 2 ml, alupent (brikanil) 0,5 mg flebo. 5. Antistaminici: difenidramina 40 mg (suprastin 60 mg, tavegil 6 ml), cimetidina 200-400 mg per via endovenosa (sono indicate le dosi giornaliere). 6. Inibitori della proteasi: trasylol 400 mila U, contrical 100 mila U. Lo shock traumatico è una condizione patologica e critica del corpo che si è verificata in risposta a una lesione, in cui le funzioni dei sistemi e degli organi vitali sono compromesse e inibite. Durante lo shock da trauma si distinguono le fasi torpide ed erettile. Al momento del verificarsi, lo shock può essere primario (1-2 ore) e secondario (più di 2 ore dopo l'infortunio). Stadio erettile o fase dell'occorrenza. La coscienza rimane, il paziente è pallido, irrequieto, euforico, inadeguato, può urlare, correre da qualche parte, scoppiare, ecc. In questa fase viene rilasciata adrenalina, a causa della quale pressione e polso possono rimanere normali per qualche tempo. La durata di questa fase va da alcuni minuti e ore a diversi giorni. Ma nella maggior parte dei casi è breve. La fase torpida sostituisce quella erettile, quando il paziente diventa letargico e adinamico, la pressione sanguigna diminuisce e compare la tachicardia. Le stime della gravità delle lesioni sono riportate nella Tabella 6. Tabella 6 Valutazione dell'entità della gravità della lesione
Dopo aver calcolato i punti, il numero risultante viene moltiplicato per il coefficiente. Note 1. Se vi sono infortuni che non sono specificati nell'elenco del volume e della gravità dell'infortunio, il numero di punti è assegnato in base al tipo di infortunio, in base alla gravità corrispondente ad uno di quelli elencati. 2. In presenza di malattie somatiche che riducono le funzioni adattative del corpo, la somma dei punti trovata viene moltiplicata per un coefficiente da 1,2 a 2,0. 3. All'età di 50-60 anni, la somma dei punti viene moltiplicata per un fattore 1,2, più vecchio - per 1,5. Trattamento. Le principali direzioni di trattamento. 1. Eliminazione dell'azione dell'agente traumatico. 2. Eliminazione dell'ipovolemia. 3. Eliminazione dell'ipossia. L'anestesia viene effettuata mediante l'introduzione di analgesici e farmaci, l'attuazione di blocchi. Ossigenoterapia, se necessario, intubazione tracheale. Compensazione per perdita di sangue e BCC (plasma, sangue, reopoliglucina, poliglucina, eritromassa). Normalizzazione del metabolismo, con lo sviluppo dell'acidosi metabolica, vengono introdotti cloruro di calcio 10% - 10 ml, cloruro di sodio 10% - 20 ml, glucosio 40% - 100 ml. Combattere la carenza di vitamine (vitamine del gruppo B, vitamina C). Terapia ormonale con glucocorticosteroidi - prednisolone per via endovenosa una volta 90 ml e successivamente 60 ml ogni 10 ore. Stimolazione del tono vascolare (mezaton, norepinefrina), ma solo con un volume reintegrato di sangue circolante. Anche gli antistaminici (difenidramina, sibazon) sono coinvolti nella terapia anti-shock. Lo shock emorragico è una condizione di insufficienza cardiovascolare acuta che si sviluppa dopo la perdita di una quantità significativa di sangue e porta ad una diminuzione della perfusione degli organi vitali. Eziologia: lesioni con danno ai grandi vasi, ulcere gastriche e duodenali acute, rottura di un aneurisma aortico, pancreatite emorragica, rottura della milza o del fegato, rottura del tubo o gravidanza extrauterina, presenza di lobuli placentari nell'utero, ecc. In base ai dati clinici e all'entità della carenza di volume del sangue, si distinguono i seguenti gradi di gravità. 1. Non espresso - non ci sono dati clinici, il livello di pressione sanguigna è normale. Il volume della perdita di sangue è fino al 10% (500 ml). 2. Debole - tachicardia minima, leggera diminuzione della pressione sanguigna, alcuni segni di vasocostrizione periferica (mani e piedi freddi). Il volume della perdita di sangue va dal 15 al 25% (750-1200 ml). 3. Moderato: tachicardia fino a 100-120 battiti al minuto, diminuzione della pressione del polso, pressione sistolica 1-90 mm Hg. Art., ansia, sudorazione, pallore, oliguria. Il volume della perdita di sangue va dal 100 al 25% (35-1250 ml). 4. Grave - tachicardia superiore a 120 battiti al minuto, pressione sistolica inferiore a 60 mm Hg. Art., spesso non determinato dal tonometro, stupore, pallore estremo, estremità fredde, anuria. Il volume della perdita di sangue è superiore al 35% (più di 1750 ml). Laboratorio nell'analisi del sangue generale, una diminuzione del livello di emoglobina, eritrociti ed ematocrito. L'ECG mostra cambiamenti aspecifici nel segmento ST e nell'onda T, che sono dovuti a una circolazione coronarica insufficiente. Il trattamento dello shock emorragico comprende l'arresto dell'emorragia, l'uso della terapia infusionale per ripristinare il BCC, l'uso di vasocostrittori o vasodilatatori, a seconda della situazione. La terapia infusionale prevede la somministrazione endovenosa di liquidi ed elettroliti in un volume di 4 litri (soluzione salina, glucosio, albumina, poliglucina). In caso di sanguinamento, è indicata la trasfusione di sangue e plasma di un singolo gruppo in un volume totale di almeno 4 dosi (1 dose è 250 ml). Viene mostrata l'introduzione di farmaci ormonali, come stabilizzatori di membrana (prednisolone 90-120 mg). A seconda dell'eziologia, viene eseguita una terapia specifica. Lo shock settico è la penetrazione di un agente infettivo dal suo focus iniziale nel sistema sanguigno e la sua diffusione in tutto il corpo. Gli agenti causali possono essere: batteri stafilococcici, streptococcici, pneumococcici, meningococcici ed enterococcici, nonché Escherichia, Salmonella e Pseudomonas aeruginosa, ecc. Lo shock settico è accompagnato da una disfunzione del sistema polmonare, epatico e renale, una violazione del sangue sistema di coagulazione, che porta alla sindrome tromboemorragica ( sindrome di Machabeli), che si sviluppa in tutti i casi di sepsi. Il decorso della sepsi è influenzato dal tipo di agente patogeno, questo è particolarmente importante con i moderni metodi di trattamento. Si nota l'anemia progressiva di laboratorio (a causa dell'emolisi e dell'oppressione dell'emopoiesi). Leucocitosi fino a 12 109 / l, tuttavia, nei casi più gravi, quando si forma una forte depressione degli organi ematopoietici, si può anche osservare la leucopenia. Sintomi clinici di shock batterico: brividi, febbre alta, ipotensione, pelle calda e secca - dapprima e poi - fredda e umida, pallore, cianosi, disturbo dello stato mentale, vomito, diarrea, oliguria. Caratterizzato da neutrofilia con spostamento della formula dei leucociti a sinistra fino ai mielociti; La VES aumenta a 30-60 mm/h o più. Il livello di bilirubina nel sangue è aumentato (fino a 35-85 µmol/l), che si applica anche al contenuto di azoto residuo nel sangue. La coagulazione del sangue e l'indice di protrombina sono ridotti (fino al 50-70%), il contenuto di calcio e cloruri è ridotto. La proteina ematica totale si riduce, a causa dell'albumina, e il livello di globuline (alfa-globuline e b-globuline) aumenta. Nelle urine, proteine, leucociti, eritrociti e cilindri. Il livello di cloruri nelle urine è ridotto e l'urea e l'acido urico sono elevati. Il trattamento è principalmente di natura eziologica, pertanto, prima di prescrivere la terapia antibiotica, è necessario determinare l'agente patogeno e la sua sensibilità agli antibiotici. Gli agenti antimicrobici devono essere usati alle dosi massime. Per il trattamento dello shock settico, è necessario utilizzare antibiotici che coprano l'intero spettro dei microrganismi gram-negativi. La più razionale è la combinazione di ceftazidima e impinem, che si sono dimostrati efficaci contro Pseudomonas aeruginosa. Farmaci come clindamicina, metronidazolo, ticarcillina o imipinem sono i farmaci di scelta quando si verifica un patogeno resistente. Se gli stafilococchi vengono seminati dal sangue, è necessario iniziare il trattamento con farmaci del gruppo delle penicilline. Il trattamento dell'ipotensione è nella prima fase del trattamento nell'adeguatezza del volume del liquido intravascolare. Utilizzare soluzioni di cristalloidi (soluzione isotonica di cloruro di sodio, lattato di Ringer) o colloidi (albumina, destrano, polivinilpirrolidone). Il vantaggio dei colloidi è che quando vengono introdotti, le pressioni di riempimento richieste vengono raggiunte più rapidamente e tali rimangono per lungo tempo. Se non vi è alcun effetto, vengono utilizzati il supporto inotropo e (o) i farmaci vasoattivi. La dopamina è il farmaco di scelta perché è un β-agonista cardioselettivo. I corticosteroidi riducono la risposta generale alle endotossine, aiutano a ridurre la febbre e danno un effetto emodinamico positivo. Prednisolone alla dose da 60 a 90 mg al giorno. Lezione numero 10. Avvelenamento acuto L'avvelenamento acuto è una malattia di eziologia chimica, il cui quadro clinico si sviluppa con una singola ingestione di sostanze chimiche nel corpo umano in una dose tossica che può causare violazioni delle funzioni vitali e mettere in pericolo la vita. In base alla causa e al luogo dell'evento, si distinguono i seguenti tipi di avvelenamento. 1. Avvelenamento accidentale (incidenti) sul lavoro - esposizione a veleni industriali durante un incidente o in violazione delle norme tecniche di sicurezza durante il periodo di lavoro con sostanze nocive; nella vita di tutti i giorni - quando c'è un uso errato o improprio di prodotti chimici domestici, in caso di automedicazione con farmaci, loro sovradosaggio o uso errato, con intossicazione da alcol e droghe, morsi di insetti velenosi e serpenti; errori medici. 2. Avvelenamento deliberato - avvelenamento suicida (vero o dimostrativo) e avvelenamento criminale (con lo scopo di uccidere o portare in uno stato di impotenza); "polizia" (quando si utilizzano sostanze chimiche e veleni per ristabilire l'ordine pubblico) e combattere l'avvelenamento (quando si utilizzano armi chimiche), anche a seguito di atti terroristici. In base al numero delle vittime si distinguono le intossicazioni acute individuali, di gruppo e di massa. L'assunzione di una sostanza tossica è possibile attraverso la bocca (incorporata, orale), attraverso le vie respiratorie (inalazione), la pelle non protetta (percutanea), per iniezione parenterale o quando iniettata nel retto, vagina, canale uditivo esterno. Nel decorso clinico dell'avvelenamento acuto si distinguono due fasi: tossicogeno e somatogeno. L'essenza della fase tossica è che il principio attivo nel corpo ha una dose che può causare un effetto tossico specifico. Lo stadio somatogeno si verifica dopo la rimozione o la distruzione di una sostanza tossica e si manifesta sotto forma di "traccia" o violazioni residue dello stato strutturale e funzionale di organi e sistemi. Principi generali per la diagnosi di avvelenamento acuto 1. La diagnosi clinica si basa sui seguenti dati: 1) ispezione del luogo per il ritrovamento di prove materiali di avvelenamento; 2) anamnesi dalle parole della vittima o di altri: puoi scoprire quale sostanza tossica ha assunto la vittima, il tempo di assunzione della sostanza tossica, la dose della sostanza tossica assunta, la via di penetrazione della sostanza tossica nel corpo , le circostanze che hanno accompagnato lo sviluppo dell'avvelenamento, ecc .; 3) studiare il quadro clinico della malattia per identificare sintomi specifici di avvelenamento che sono caratteristici di una determinata sostanza tossica o gruppo di sostanze secondo il principio della "tossicità selettiva". 2. La diagnostica tossicologica di laboratorio è finalizzata alla determinazione qualitativa o quantitativa di sostanze tossiche nei mezzi biologici dell'organismo (sangue, urina, ecc.). 3. La diagnostica patologica consiste nella rilevazione di specifici segni post mortem di avvelenamento e viene eseguita da esperti forensi. 1. Avvelenamento da alcol metilico L'alcol metilico viene assorbito da tutte le vie: respiratoria, digestiva e percutanea. La dose letale di metanolo se assunta per via orale varia da 40 a 250 ml, ma l'assunzione anche di 10-20 ml può causare cecità. L'avvelenamento si verifica anche dopo l'assunzione di varie miscele alcoliche contenenti dall'1,5 al 2,5% di metanolo. Dopo l'assorbimento, il metanolo viene distribuito in tutti i tessuti grazie alla sua solubilità in acqua. La maggior parte si accumula nei reni e nel tratto gastrointestinale, la più piccola nel cervello, nei muscoli e nel tessuto adiposo. Le lesioni patologiche comprendono edema cerebrale e danni alla natura inizialmente infiammatoria e successivamente distrofica delle cellule gangliari retiniche. In alcuni casi, oltre a danni al sistema nervoso, si riscontrano lesioni degenerative del fegato, dei reni, dei polmoni e del muscolo cardiaco. Quadro clinico Nell'effetto tossico del metanolo si può distinguere l'azione a due fasi. Nel periodo iniziale (fase I), il metanolo agisce sull'organismo come molecola intera e ha un effetto prevalentemente narcotico, ma più debole di quello dell'alcol etilico. Successivamente (fase II) si manifesta l'effetto dannoso dei prodotti di ossidazione. Nel quadro clinico si distinguono i periodi: intossicazione, benessere latente o relativo (che dura da alcune ore a 1-2 giorni), le principali manifestazioni di intossicazione e, con esito favorevole, sviluppo inverso. In base alla gravità si distinguono lieve, moderata (o oftalmica) e grave (o generalizzata). Con lieve avvelenamento, si notano affaticamento, mal di testa, nausea e uno stato di leggera intossicazione, che si verificano dopo un periodo di latenza da 30 minuti a diverse ore. L'assorbimento simultaneo di alcol etilico e metilico aumenta il periodo di latenza e riduce la gravità dell'avvelenamento. In caso di avvelenamento moderato, dopo un breve periodo di latenza, il paziente sviluppa mal di testa, vertigini, dolore acuto all'addome (principalmente nella regione epigastrica), vomito, irrequietezza, delirio, convulsioni. Alla fine, inizia un coma profondo. Il paziente presenta ipotermia, in alcuni casi, cianosi, quando si sviluppa un'insufficienza respiratoria di natura centrale, seguita da insufficienza cardiovascolare. In questa fase le pupille si dilatano e lo studio del fondo oculare indica la presenza di edema retinico. Disturbi visivi tipici, come ridotta acuità visiva, restringimento del campo, pupille dilatate, perdita del riflesso alla luce, dolore al bulbo oculare si verificano il 2°-6° giorno. L'esame del fondo oculare rivela segni di atrofia del nervo ottico. La complicanza più grave è la cecità totale. trattamento Il trattamento include i seguenti punti. 1. Fermare l'ingresso di veleno nel corpo. Cessazione dell'uso del veleno, rimozione dall'atmosfera contaminata, rimozione del veleno dalla pelle. 2. Rimozione del veleno non assorbito (dal tratto gastrointestinale): 1) sondare la lavanda gastrica; 2) l'uso di adsorbenti o lassativi salini; 3) clistere purificante o sifone. 3. Rimozione del veleno assorbito: 1) forzare la diuresi; 2) metodi di disintossicazione extracorporea (emosorbimento, emodialisi, dialisi peritoneale, intervento di sostituzione del sangue). 4. Terapia antidotica, ovvero neutralizzazione del veleno dovuta alla neutralizzazione fisica o chimica, nonché competizione con il veleno per i punti di applicazione. 6. Mantenimento delle funzioni vitali del corpo. 7. Normalizzazione dell'acqua-elettrolita, stato acido-base del corpo. 8. Trattamento delle conseguenze e delle complicanze a lungo termine. Lavanda gastrica con acqua o soluzione di bicarbonato di sodio al 2%, seguita dall'ingestione di 30 g di solfato di magnesio (sodio) in 100 ml di acqua. Per via sottocutanea 2 ml di cordiamina, 1 ml di soluzione di caffeina al 20%. In coma, per via endovenosa, una soluzione al 5% di alcol etilico in una soluzione di glucosio al 5% al ritmo di 1,5-2 g di alcol per 1 kg di peso del paziente al giorno. Per via endovenosa 400 ml di poliglucina (reopoliglucina), 50-100 mg di prednisolone, miscela di glucosone-vocaina (400 ml di soluzione di glucosio al 5% con 25 ml di soluzione di novocaina al 2%), 80-120 mg di furosemide (lasix), 40 ml del 40% - soluzione di glucosio con 8 UI di insulina. 2. Avvelenamento da alcol etilico clinica Quando si assumono dosi tossiche - agitazione, atassia, stupore, coma con inibizione dei riflessi, odore di alcol dalla bocca, rossore al viso, congiuntivite, "gioco" delle pupille, vomito, minzione involontaria, tachicardia, respirazione "rauca" , collasso, vomito con possibile aspirazione di emetico wt. trattamento Lavanda gastrica attraverso una sonda spessa, seguita dall'introduzione di un lassativo salino, clistere a sifone. Per via sottocutanea 1 ml di una soluzione allo 0,1% di atropina, 2 ml di cordiamina, 1 ml di una soluzione al 20% di caffeina, con collasso - per via intramuscolare 1 ml di una soluzione all'1% di mezaton. In assenza di riflessi faringei - intubazione tracheale e ventilazione meccanica. Forzare la diuresi con la somministrazione simultanea di una soluzione di bicarbonato di sodio al 4% in un volume calcolato secondo la formula di Astrup, soluzioni di glucosio ipertoniche (10 e 20%) con insulina, vitamine B e C, cocarbossilasi, acido nicotinico. Con depressione respiratoria - per via endovenosa lentamente 3-5 ml di una soluzione all'1,5% di etimizolo, 10 ml di una soluzione al 2,4% di aminofillina, 1 ml di una soluzione al 5% di efedrina, inalazione di ossigeno. Con aspirazione - broncoscopia di sanificazione di emergenza. Antibiotici parenterali. 3. Avvelenamento da glicole etilenico (antigelo). La dose letale media è di circa 100 ml. Viene rapidamente assorbito nel tratto digerente e distribuito a tutti i tessuti, creando la massima concentrazione nel cervello. Il principale effetto tossico si osserva nel parenchima renale, dove si sviluppano necrosi dell'epitelio tubulare, edema interstiziale e focolai di necrosi emorragica nello strato corticale. L'edema si trova nel cervello. clinica Nella clinica dell'intossicazione si distinguono 3 periodi: 1) iniziale - che dura fino a 12 ore, predominano i sintomi del danno al SNC dovuti al tipo di intossicazione da alcol; 2) neurotossico - quando i sintomi del danno al SNC progrediscono e si uniscono disturbi del sistema respiratorio e cardiovascolare; 3) nefrotossico - il 2°-5° giorno, il danno renale predomina nel quadro clinico dell'intossicazione. La durata e la gravità dei periodi di intossicazione dipendono dalla gravità dell'avvelenamento. Nei casi lievi, dopo un periodo di intossicazione (10-15 ore), si sviluppano un leggero malessere, mal di testa e nausea. La coscienza rimane chiara, il danno renale non si osserva. In caso di avvelenamento di moderata gravità, sullo sfondo di sintomi di intossicazione, vomito, diarrea, dolore nella regione epigastrica e mal di testa. Il 3-5 ° giorno compaiono i sintomi di danno renale. In caso di avvelenamento grave, si verifica rapidamente una perdita di coscienza, torcicollo, convulsioni clonico-toniche, febbre, respiro profondo rumoroso, collasso ed edema polmonare. Se il paziente non muore il primo giorno, dal 2-3o giorno si sviluppano sintomi di insufficienza renale: appare la sete, il mal di schiena, la quantità di urina diminuisce, fino all'anuria. Il fegato è ingrossato, doloroso. La morte viene dall'uremia. trattamento Lavaggio gastrico con acqua o soluzione di bicarbonato di sodio al 2%, seguito dall'introduzione di 30 g di solfato di magnesio in 200 ml di acqua. Dentro 200 ml di una soluzione al 30% di alcol etilico. 3-5 g di bicarbonato di sodio in 100 ml di acqua. Bevanda abbondante. Per via intramuscolare 1-2 ml di cordiammina, 1 ml di una soluzione di caffeina al 20%. Per via endovenosa 400 ml di soluzione di glucosio al 5% con 5 ml di soluzione di acido ascorbico al 5% e 8 unità di insulina, miscela di glucosone-vocaina, 400 ml di poliglucina, 400 ml di emodez, 80-120 g di furosemide, 60-100 mg di prednisolone. 4. Avvelenamento da dicloroetano Le principali vie di ingresso sono il tratto digerente, il tratto respiratorio e la pelle. La dose letale di DCE per l'uomo quando somministrata per via orale è di 10-20 ml. L'effetto tossico del DCE è dovuto all'effetto narcotico sul sistema nervoso centrale, al danno al fegato, ai reni, al tratto gastrointestinale e a un pronunciato effetto sul sistema cardiovascolare. clinica Nel quadro clinico, i sintomi principali sono: encefalopatia tossica, gastrite e gastroenterite tossica acuta, respirazione esterna alterata, epatite tossica, funzionalità renale compromessa. Nelle prime ore dopo l'assunzione compaiono vertigini, atassia, agitazione psicomotoria, convulsioni clonico-toniche, depressione della coscienza, fino al coma. Uno dei primi segni di avvelenamento sono i disturbi gastrointestinali sotto forma di nausea, vomito ripetuto con una miscela di bile. La violazione della funzione della respirazione esterna si verifica spesso secondo il tipo di aspirazione ostruttiva ed è associata ad aumento della salivazione, broncorrea e aspirazione. Si nota l'inibizione della funzione del centro respiratorio, lo sviluppo dell'ipertono dei muscoli respiratori e la rigidità del torace. Una grave complicanza è lo shock esotossico, che si manifesta con raffreddamento e cianosi della pelle, sudore freddo, mancanza di respiro, tachicardia e ipovolemia. Diminuzione della funzione escretoria dei reni. In base alla gravità dell'avvelenamento da DCE sono suddivisi nei seguenti. 1. Avvelenamento lieve, caratterizzato dallo sviluppo di disturbi dispeptici, lievi sintomi neurologici e lieve epatopatia. 2. Avvelenamento moderato. Si verificano con sintomi di gastrite tossica, gastroenterite, encefalopatia tossica, epatopatia moderata, nefropatia lieve. 3. L'avvelenamento grave si verifica con gravi manifestazioni di encefalopatia tossica, epatopatia grave, nefropatia tossica, gastroenterite. In caso di avvelenamento da vapore, c'è mal di testa, sonnolenza, sapore dolciastro in bocca, odore di veleno dalla bocca, irritazione delle mucose, perdita di coscienza, insufficienza epatica e renale acuta con ingiallimento della sclera e della pelle , fegato ingrossato, anuria. Se ingerito - vomito ripetuto, dolore addominale, feci molli con odore di veleno, iperemia della sclera, agitazione psicomotoria, alternata a depressione e coma, collasso, shock tossico, sindrome emorragica, insufficienza epatica-renale acuta. Quando il veleno viene a contatto con la pelle, si sviluppa la dermatite. trattamento In caso di avvelenamento da vapore: rimozione della vittima dall'area interessata, con depressione respiratoria del ventilatore. Se il veleno penetra all'interno - lavanda gastrica attraverso una sonda densa, seguita dall'introduzione di 3-4 cucchiai di carbone attivo in polvere in 200 ml di acqua e 150-200 ml di olio di vaselina, clistere a sifone. Per via endovenosa 20-40 ml di una soluzione al 30% di tiosolfato di sodio, per via intramuscolare 5 ml di una soluzione al 5% di unitiolo. per via endovenosa 400 ml di poliglucina, 400 ml di hemodez, 400 ml di soluzione di glucosio al 5%, 80-120 mg di furosemide (lasix), 6-8 ml di soluzione al 5% di acido ascorbico. Per via intramuscolare 2 ml di cordiammina, con collasso - 1 ml di una soluzione all'1% di mezaton, 1 ml di una soluzione al 20% di caffeina, 100-150 mg di prednisolone. Con un aumento dell'insufficienza epatico-renale, viene eseguita una terapia specifica. Bolo endovenoso 400 ml di poliglucina, 400 ml di gemodez, 400 ml di glucosio al 5%, 80-120 mg di furosemide, 6-8 ml di acido ascorbico al 5%, 100-150 mg di prednisolone, con collasso 1 ml dell'1% mezzoton. Per via intramuscolare 2-4 ml di bromuro di tiamina al 6% e 2-4 ml di piridossina al 5%. Con agitazione psicomotoria, 1 ml di una soluzione al 3% di fenozepam. Inalazione di ossigeno, con depressione respiratoria - IVL attraverso un tubo di respirazione. Durante il primo giorno, il metodo più efficace e parsimonioso è la dialisi peritoneale. La composizione della soluzione per dialisi standard comprende: cloruro di potassio 0,3 g, cloruro di sodio 8,3 g, cloruro di magnesio 0,1 g, cloruro di calcio 0,3 g, glucosio 6 g per 1 litro di acqua. Allo stesso tempo, nella cavità addominale del paziente vengono iniettati fino a 2 litri di soluzione elettrolitica con l'aggiunta di 500 mila unità di penicillina e 1000 unità di eparina. Nella fase somatogena dell'avvelenamento, la terapia principale è finalizzata al trattamento delle complicanze sviluppate: polmonite, epatopatia, ecc. 5. Avvelenamento con funghi velenosi (agarico di mosca, finti funghi, spugnole, svasso pallido) clinica Dopo un periodo di latenza che dura da 1-2 a 36 ore, compaiono crampi addominali, salivazione, nausea, vomito indomabile, diarrea, disidratazione, collasso, delirio, allucinazioni, convulsioni. Il 2-3 ° giorno - i fenomeni di insufficienza renale ed epatica con anuria, azotemia, ittero. In caso di avvelenamento grave con linee e spugnole, è possibile l'emolisi. trattamento Lavanda gastrica attraverso una sonda densa, seguita dall'introduzione di 3-4 cucchiai di carbone attivo in polvere in 200 ml di acqua e 30 g di solfato di magnesio (sodio) in 100 ml di acqua, sifone clistere. Per via sottocutanea 1 ml di una soluzione allo 0,1% di atropina, 2 ml di cordiamina. Nell'avvelenamento da spugnole, l'atropina non è usata come antidoto. Per via endovenosa 400 ml di poliglucina, 400 ml di gemodez, 400 ml di soluzione di glucosio al 5% con 4-6 ml di soluzione di acido ascorbico al 5%, 80-120 mg di furosemide (lasix). Per via intramuscolare 1-2 ml di una soluzione al 6% di bromuro di tiamina e 2 ml di una soluzione al 5% di piridossina cloridrato (non iniettare in una siringa). Sollievo dalla sindrome del dolore per via intramuscolare con l'introduzione di 1 ml di una soluzione allo 0,2% di platifillina, 2 ml di una soluzione al 2% di papaverina. Con convulsioni, agitazione psicomotoria - per via intramuscolare 1-2 ml di una soluzione al 3% di fenozepam o una miscela litica (1-2 ml di una soluzione al 2,5% di aminazina, 1-2 ml di una soluzione all'1% di difenidramina, 5-10 ml 25 % di soluzione di solfato di magnesio) sotto il controllo della pressione sanguigna. Forzare la diuresi. Nei casi più gravi: emosorbimento, emodialisi precoce. In caso di avvelenamento grave con fili e spugnole, in caso di grave emolisi e assenza di possibilità di emodialisi, viene eseguito un intervento chirurgico di sostituzione del sangue. Correzione dell'acidosi mediante somministrazione endovenosa di una soluzione al 4% di bicarbonato di sodio in un volume determinato secondo la formula Astrup. Antibiotici: benzilpenicillina fino a 10 milioni di unità al giorno. Terapia sintomatica. Con l'aumento dell'insufficienza epatica e renale - terapia per infusione con una soluzione di glucosio al 5-10% con insulina, vitamine del gruppo B e C, 20-30 mila UI di eparina, aminofillina. 6. Avvelenamento da veleno di serpente clinica Dolore e gonfiore a rapida diffusione nella sede del morso, sonnolenza, depressione respiratoria, collasso, emolisi intravascolare con emoglobinuria, gravi emorragie sottocutanee, a volte convulsioni. Possibile insufficienza renale. Con un morso di cobra, i cambiamenti locali sono meno pronunciati, predominano i disturbi bulbari (disturbi del linguaggio e della deglutizione, ptosi, paralisi dei muscoli motori) e la depressione respiratoria. Mostra il riposo completo in posizione orizzontale. Spremere le prime gocce di sangue dalla ferita. Immobilizzazione dell'arto ferito. Al posto del morso - freddo. Bevanda abbondante. trattamento Aspirazione di sangue e linfa dalla ferita (non oltre 30-60 minuti dopo il morso), formata nel sito del morso, usando un barattolo succhiasangue. Lavare la ferita con una soluzione di permanganato di potassio all'1%. Introduzione alla ferita 0,3-0,5 ml di una soluzione di adrenalina allo 0,1%. Se possibile, l'introduzione urgente di un siero anti-serpente specifico mono o polivalente dopo un'iniezione endovenosa preliminare di 100-150 ml di idrocortisone o 50-100 ml di prednisolone. In caso di morsi di cobra - siero Anticobra per via endovenosa alla dose di 300 ml in combinazione con 1 ml di una soluzione allo 0,05% di prozerin e somministrazione ripetuta ogni 30 minuti con 1 ml di una soluzione allo 0,1% di atropina. A scopo profilattico - siero antitetanico secondo Bezredka, miscela polarizzante per via endovenosa, 10-15 mila UI di eparina, 1-2 ml di soluzione di difenidramina all'1%, 10 ml di soluzione di cloruro di calcio al 10% (gluconato), 5-10 ml di 5 % - soluzione di acido ascorbico, 50-100 mg di prednisolone o 100-150 mg di idrocortisone, 400 ml di gemodez, 400 ml di poliglucina, 40-80 mg di lasix. Sollievo dal dolore mediante somministrazione endovenosa di 1 ml di una soluzione al 2% di promedol. Nell'insufficienza respiratoria acuta - ventilazione meccanica attraverso un tubo di respirazione, inalazione di ossigeno. In grave tossicosi - emoassorbimento, con la progressione dell'insufficienza epatica-renale - emodialisi in combinazione con emoassorbimento. Terapia sintomatica. 7. Avvelenamento con acidi concentrati (nitrico, acetico, solforico) clinica L'inalazione dei vapori provoca irritazione degli occhi e delle prime vie respiratorie (lacrimazione, naso che cola, tosse, respiro corto). Possibile arresto respiratorio riflesso. Dopo un periodo di latenza (da 2 a 24 ore), si forma polmonite tossica o edema polmonare tossico. A colpo in occhi, su pelle - ustioni chimiche. Se ingerito, è possibile un'ustione chimica della cavità orale, faringe, esofago, stomaco, gonfiore della laringe con insufficienza respiratoria. Vomito ripetuto con sangue, irritazione peritoneale e occasionalmente perforazione dell'esofago o dello stomaco. Collasso, shock, sindrome emorragica. Possibile emolisi intravascolare, nefrosi emoglobinurica con insufficienza renale acuta (renale-epatica). La lavanda gastrica tubeless e il vomito artificiale sono pericolosi a causa della possibilità di bruciare nuovamente l'esofago e l'aspirazione acida. Non iniettare soluzioni saline lassative e alcaline. trattamento Lavaggio gastrico attraverso un tubo spesso con acqua fredda dopo un'iniezione endovenosa o intramuscolare preliminare di 1-2 ml di una soluzione al 2% di promedol. Dentro pezzi di ghiaccio, Almagel A 15-20 ml ogni ora. Per via endovenosa 800 ml di poliglucina, 400 ml di emodez, miscela di glucosone-vocaina (400 ml di soluzione di glucosio al 5% con 25 ml di soluzione di novocaina al 2%), 50-150 mg di prednisolone o 150-250 mg di idrocortisone, 10 mila unità di eparina, 80-120 mg di furosemide (Lasix). Il sollievo dalla sindrome del dolore si ottiene per via endovenosa con l'introduzione di 1-2 ml di una soluzione allo 0,005% di fentanil e 2-4 ml di una soluzione allo 0,25% di droperidolo, con dolore persistente nell'addome - per via intramuscolare 1-2 ml di un Soluzione allo 0,2% di platyfillin, 2 ml di soluzione di papaverina al 2%. Inalazione di ossigeno con un antischiuma. Con l'aumento dell'edema laringeo - per via endovenosa 200-400 mg di prednisolone, 1-2 ml di una soluzione all'1% di difenidramina, 10-20 ml di una soluzione al 2,4% di aminofillina, 1-2 ml di una soluzione al 5% di efedrina. In assenza di effetto - tracheostomia, inalazione di ossigeno, secondo indicazioni - ventilazione meccanica. 8. Avvelenamento con arsenico e suoi composti clinica C'è un sapore metallico in bocca, dolore addominale, vomito, feci molli, grave disidratazione, convulsioni, tachicardia, abbassamento della pressione sanguigna, coma, insufficienza renale acuta. L'avvelenamento da idrogeno arsenico sviluppa emolisi intravascolare, emoglobinuria. trattamento Lavaggio gastrico attraverso un tubo spesso (2-3 volte al giorno) con l'introduzione all'inizio e alla fine del lavaggio 50 ml di una soluzione al 5% di unithiol, ripetuti clisteri sifone con l'aggiunta di unithiol. Continuazione della terapia antidoto per via endovenosa o intramuscolare con l'introduzione di una soluzione al 5% di unitiol (fino a 300 ml al giorno), gocciolamento endovenoso di 20 ml di tetacina di calcio al 10% (ED1A) in 400 ml di una soluzione di glucosio al 5%. In caso di avvelenamento con idrogeno arsenico - per via intramuscolare, 1-2 ml di una soluzione al 40% di mecaptide (fino a 6-8 ml al giorno). Forzare la diuresi con la somministrazione simultanea di soluzioni poliioniche ipertoniche (al 10-20% di soluzione di glucosio), soluzione di bicarbonato di sodio al 4% in un volume calcolato secondo la formula di Astrup, miscela di glucosone-vocaina, aminofillina, vitamine B e C, citocromo C. In caso di avvelenamento grave - emodialisi precoce. Nel processo di emodialisi, una soluzione di unithiolo al 5% viene iniettata per via endovenosa (30-40 ml / h per avvelenamento grave, 20-30 ml / h per avvelenamento moderato). Nell'emolisi acuta e nell'impossibilità dell'emodialisi, viene eseguita un'operazione di sostituzione del sangue. 9. Avvelenamento da liscivia clinica Se ingerito, si sviluppa un'ustione chimica della mucosa della cavità orale, dell'esofago e dello stomaco. Dolore lungo l'esofago e nell'addome, vomito con una miscela di sangue, sanguinamento esofageo-gastrico. Possibile perforazione dell'esofago, stomaco con sviluppo di mediastinite, peritonite. Con un'ustione della laringe - raucedine della voce, afonia, difficoltà (stridore) di respirazione. Nei casi più gravi - shock da ustione, oliguria. Il contatto con la pelle provoca ustioni chimiche. trattamento Trattare come in avvelenamento da acido. 10. Avvelenamento da atropina clinica Secchezza delle fauci, raucedine, pelle secca e iperemica, pupille dilatate, mancanza di respiro, palpitazioni, tachicardia, sete, nausea, difficoltà a urinare. In grave avvelenamento - sono possibili agitazione psicomotoria, delirio, allucinazioni, convulsioni, disturbi del ritmo cardiaco, coma, collasso. trattamento Se necessario - lavanda gastrica attraverso una sonda densa, riccamente lubrificata con olio di vaselina, l'introduzione di 3-4 cucchiai. l. carbone attivo in polvere in 200 ml di acqua e 30 mg di solfato di magnesio in 100 ml di acqua. per via endovenosa 2-4 ml di soluzione di proserina allo 0,05%, 400-800 ml di soluzione di glucosio al 5%, 40-80 mg di furosemide (lasix). Bevanda abbondante. Sollievo dall'agitazione psicomotoria e dalle convulsioni per via intramuscolare con l'introduzione di 1-2 ml di una soluzione al 3% di fenozepam o una miscela litica (2 ml di una soluzione al 2,5% di aminazina, 2 ml di una soluzione all'1% di difenidramina e 10 ml di una soluzione al 25% di solfato di magnesio) o 1-2 g di cloralio idrato in un clistere con 1-2 g di amido per 25-50 ml di acqua, per via endovenosa 10-15 ml di una soluzione di idrossibutirrato di sodio al 20%, 2-4 ml di una soluzione allo 0,5% di seduxen. Con grave tachicardia, extrasistole - anaprilina per via endovenosa (1-2 ml di una soluzione allo 0,25%) o una compressa di anaprilina (40 mg) sotto la lingua. Con il collasso - per via endovenosa 1 ml di una soluzione all'1% di mezaton in 10 ml di una soluzione allo 0,9% di cloruro di sodio. Con una forte ipertermia - per via intramuscolare 2 ml di una soluzione al 50% di analgin, impacchi di ghiaccio su grandi vasi e testa, impacchi umidi. 11. Avvelenamento da canapa (hashish, marijuana, marijuana, piano) clinica C'è euforia, agitazione psicomotoria, allucinazioni visive vivide, pupille dilatate, tinnito. Successivamente debolezza, letargia, depressione dell'umore, sonnolenza, bradicardia, ipotermia. trattamento In caso di avvelenamento orale - lavanda gastrica attraverso un tubo spesso, seguita dall'introduzione di 3-4 cucchiai di carbone attivo in polvere in 200 ml di acqua. Per via endovenosa 400-800 ml di una soluzione di glucosio al 5% con 5-10 ml di una soluzione al 5% di acido ascorbico e 8-16 unità di insulina, 40-80 mg di furosemide (lasix), per via intramuscolare 2 ml di una soluzione al 6% di bromuro di tiamina. Con una forte eccitazione - per via intramuscolare 3-5 ml di una soluzione al 2,5% di clorpromazina o una miscela litica (2 ml di una soluzione al 2,5% di clorpromazina, 1-2 ml di una soluzione all'1% di difenidramina e 5-10 ml di 25 % - una soluzione di solfato di magnesio) sotto il controllo della pressione sanguigna. inalazione di ossigeno. Forzare la diuresi. Nei casi più gravi ricorrere all'emoassorbimento. 12. Avvelenamento da cocaina e da dicaina clinica Si manifesta clinicamente con agitazione generale, mal di testa, arrossamento del viso, pupille dilatate, tachicardia, aumento della respirazione, aumento della pressione sanguigna, allucinazioni. Nei casi più gravi - convulsioni, coma, paralisi respiratoria, collasso. trattamento Lavanda gastrica ripetuta attraverso una sonda spessa con una soluzione allo 0,1% di permanganato di potassio, seguita dall'introduzione di 3-4 cucchiai. l. carbone attivo in polvere in 200 ml di acqua e 30 g di solfato di magnesio in 100 ml di acqua. Per via endovenosa 400 ml di gemodez, 400 ml di soluzione di glucosio al 5% con 5-10 ml di soluzione di acido ascorbico al 5%, 40-80 mg di furosemide (lasix). Quando è eccitato - fissando la vittima, per via intramuscolare 1-2 ml di una soluzione al 3% di fenozepam o una miscela litica (1-2 ml di una soluzione al 2,5% di clorpromazina, 2 ml di una soluzione all'1% di difenidramina e 5-10 ml di un 25% - una soluzione di solfato di magnesio) sotto il controllo della pressione sanguigna. Con le convulsioni, 1-2 g di cloralio idrato vengono somministrati in un clistere con 1-2 g di amido in 25-50 ml di acqua, per via endovenosa lentamente 15-20 ml di una soluzione di ossibutirrato di sodio al 20%, se non vi è alcun effetto, lentamente per via intramuscolare fino a 20 ml di soluzione al 2,5% di sodio tiopentale o esenale. Con lo sviluppo di un coma - un impacco di ghiaccio sulla testa, per via endovenosa 40 ml di una soluzione di glucosio al 40% con 4-6 ml di una soluzione al 5% di acido ascorbico e 8 unità di insulina, per via endovenosa lentamente o per via intramuscolare 2-4 ml di una soluzione al 6% di bromuro di tiamina e 2-4 ml di una soluzione al 5% di piridossina cloridrato, 80-120 mg di furosemide. Con grave depressione respiratoria, viene eseguita la ventilazione meccanica, per via endovenosa lentamente 2 ml di cordiamina, inalazione di ossigeno. 13. Avvelenamento con analgesici narcotici (morfina, omnopon, droperidolo) clinica Sonnolenza o perdita di coscienza, costrizione pupillare, ipertono muscolare (talvolta convulsioni), depressione respiratoria, bradicardia, collasso. La paralisi respiratoria è possibile con la conservazione della coscienza del paziente. trattamento Lavaggio gastrico attraverso una sonda spessa (mantenendo la coscienza), seguito dall'introduzione di 3-4 cucchiai di carbone attivo in polvere e 30 g di solfato di sodio, clistere a sifone. Per via endovenosa 400 ml di gemodez, 400 ml di poliglucina, 400 ml di soluzione di glucosio al 5%, 60-80 mg di furosemide (lasix). Per via sottocutanea 1-2 ml di una soluzione allo 0,1% di atropina, 1-2 ml di cordiamina, 1 ml di una soluzione al 20% di caffeina. Con lo sviluppo di un coma, un impacco di ghiaccio sulla testa, per via endovenosa 40 ml di una soluzione di glucosio al 40% con 5-10 ml di una soluzione al 5% di acido ascorbico e 8 unità di insulina, per via endovenosa lentamente o per via intramuscolare 2-4 ml di una soluzione al 6% di bromuro di tiamina e 2-4 ml di una soluzione al 5% di piridossina cloridrato, 80-120 mg di furosemide (lasix). Se necessario - cateterizzazione vescicale ed estrazione delle urine. Con depressione respiratoria - IVL, inalazione di ossigeno. Emoassorbimento (2-3 volte al giorno fino al ripristino della coscienza). Lezione n. 11. Dolore e analgesici 1. Dolore Il dolore è uno stato sensoriale ed emotivo spiacevole causato da effetti patologici reali o potenziali sui tessuti. Nel SNC, il dolore è condotto lungo due vie principali. Percorso specifico: le corna posteriori del midollo spinale, i nuclei specifici del talamo, la corteccia del giro centrale posteriore. Questo percorso è a basso neurone, veloce, conduce il dolore di soglia, emotivamente incolore, precisamente localizzato (dolore epicritico). Modo non specifico: le corna posteriori del midollo spinale, i nuclei non specifici del talamo, la corteccia dei lobi frontali e parietali in modo diffuso. Conduce dolore sottosoglia, emotivamente colorato, scarsamente localizzato. È lento, multineuronale, poiché forma numerose collaterali al midollo allungato, alla formazione reticolare, al sistema limbico e all'ippocampo. Gli impulsi del dolore sottosoglia subiscono la somma nel talamo. Gli impulsi condotti lungo la via del dolore aspecifico eccitano i centri emotivi del sistema limbico, i centri autonomici dell'ipotalamo e il midollo allungato. Pertanto, il dolore è accompagnato da paura, esperienze dolorose, aumento della respirazione, polso, aumento della pressione sanguigna, dilatazione della pupilla, disturbi dispeptici. L'azione del sistema nocicettivo del dolore è contrastata dal sistema antinocecettivo, i cui neuroni principali sono localizzati nella sostanza grigia periacqueduttale (l'acquedotto di Sylvius collega il III e il IV ventricolo). I loro assoni formano percorsi discendenti verso il midollo allungato e il midollo spinale e percorsi ascendenti verso la formazione reticolare, il talamo, l'ipotalamo, il sistema limbico, i gangli della base e la corteccia. I mediatori di questi neuroni sono i pentapeptidi: methenkephalin e leuenkephalin, che hanno rispettivamente metionina e leucina come amminoacidi terminali. Le encefaline eccitano i recettori degli oppiacei. Nelle sinapsi encefalinergiche, i recettori degli oppiacei si trovano sulla membrana postsinaptica, ma la stessa membrana è presinaptica per altre sinapsi. I recettori degli oppiacei sono associati all'adenilato ciclasi e ne causano l'inibizione interrompendo la sintesi di cAMP nei neuroni. Di conseguenza, l'ingresso del calcio e il rilascio di mediatori, inclusi i mediatori del dolore - diminuiscono i peptidi: sostanza P, colecistochinina, somatostatina, acido glutammico. I recettori degli oppiacei sono eccitati non solo dai mediatori - le encefaline, ma anche da altri componenti del sistema antinocecettivo - gli ormoni cerebrali (endorfine). Gli agonisti peptidici dei recettori degli oppiacei si formano durante la proteolisi delle sostanze peptidiche del cervello: proopiocortina, proencefaline A e B. Tutti questi peptidi si formano nell'ipotalamo. I recettori degli oppiacei eccitano i recettori in tutte le strutture cerebrali coinvolte nella conduzione e nella percezione del dolore, nella formazione di reazioni emotivamente colorate al dolore. Allo stesso tempo, il rilascio dei mediatori del dolore diminuisce e tutte le reazioni che accompagnano il dolore sono indebolite. 2. Farmaci analgesici Un analgesico (acido acetilsalicilico, paracetamolo, morfina) è un farmaco che riduce il dolore di varia origine. I farmaci che riducono il dolore provocato solo da un determinato fattore causale o eliminano una specifica sindrome del dolore, ad esempio antiacidi, ergotamina (emicrania), carbamazepina (nevralgia), nitroglicerina (angina pectoris), non appartengono agli analgesici classici. I corticosteroidi sopprimono la risposta infiammatoria e il conseguente dolore, ma nonostante il loro uso diffuso per questi scopi, non rappresentano nemmeno gli analgesici classici. Gli analgesici si classificano in narcotici, agendo sulle strutture del SNC e provocando sonnolenza, come gli oppioidi, e non narcotici, agendo principalmente sulle strutture periferiche, come il paracetamolo, l'acido acetilsalicilico. Ulteriori farmaci che migliorano l'effetto degli analgesici I farmaci di questo gruppo non sono analgesici di per sé, ma vengono utilizzati in combinazione con analgesici per il dolore, in quanto possono modificare l'atteggiamento nei confronti del dolore, la sua percezione e il livello di ansia, paura, depressione (gli antidepressivi triciclici possono anche causare una diminuzione della necessità di morfina in un paziente in stato terminale). Tali farmaci possono essere psicofarmaci, nonché quelli che influenzano i meccanismi del dolore, ad esempio eliminando lo spasmo dei muscoli lisci e striati. Gli analgesici narcotici sono farmaci erboristici e sintetici che riducono selettivamente la percezione del dolore, aumentano la tolleranza al dolore riducendo la colorazione emotiva del dolore e il suo accompagnamento vegetativo, provocano euforia e tossicodipendenza. Gli analgesici narcotici riducono la conduzione e la percezione del dolore solo entro i confini del sistema nervoso centrale, sopprimendo principalmente la via aspecifica. I mezzi di questo gruppo eccitano i recettori degli oppiacei, creano un'azione simile agli effetti dei peptidi del sistema anti-norecettivo. Pertanto, i principali meccanismi dell'anestesia sono i seguenti: un disturbo nella conduzione di un impulso doloroso dall'assone del I neurone, il cui corpo si trova nel ganglio spinale, al II neurone, situato nella sostanza gelatinosa del posteriore corna del midollo spinale. Soppressione della somma degli impulsi sottosoglia nel talamo. Diminuzione della partecipazione alla reazione al dolore del midollo allungato, dell'ipotalamo, del sistema limbico (atteggiamento non accentato al dolore). Classificazione degli analgesici narcotici e dei loro antagonisti La classificazione è la seguente. 1. Derivati piperidina-fenantrene: 1) morfina; 2) codeina (metilmorfina, 5-7 volte più debole della morfina come analgesico); 3) etilmorfina (dionina, uguale in forza alla morfina). 2. Derivati della fenilpiperidina: 1) promedolo (3-4 volte più debole della morfina); 2) fentanil (100-400 volte più forte della morfina). 3. Derivati del difenilmetano: 1) piritrammide (dipidolor) - uguale alla morfina; 2) tramadolo (tramal) - leggermente inferiore alla morfina. 4. Agonisti-antagonisti: 1) agonisti del recettore degli oppiacei e antagonisti del recettore degli oppiacei - buprenorfina (norfina) (25-30 volte più forte della morfina); 2) agonisti dei recettori degli oppiacei e antagonisti dei recettori degli oppiacei - pentazocina (lexir) (2-3 volte più debole della morfina) e butorfanolo (moradolo) (uguale alla morfina). Gli agonisti-antagonisti sono molto meno propensi e più deboli degli agonisti completi a causare euforia e dipendenza dalla droga. Narorfina - da sola (ad esempio con avvelenamento da barbiturici) e con lieve avvelenamento da morfina, ha un effetto analgesico, provoca miosi, bradicardia ed esacerba la depressione del centro respiratorio. In caso di grave avvelenamento con morfina e altri agonisti, li sposta dai recettori degli oppiacei del centro respiratorio e ripristina la respirazione. Provoca disforia, irritabilità, depressione, ridotta focalizzazione dello sguardo. Antagonisti completi del recettore degli oppiacei Il naloxone non ha un'azione indipendente, è efficace come antidoto per l'avvelenamento con analgesici narcotici. Gli analgesici narcotici dovrebbero essere usati solo per il dolore acuto per un breve periodo. Più spesso utilizzato per lesioni, ustioni, infarto del miocardio, peritonite (dopo aver chiarito la diagnosi e deciso l'operazione). Gli analgesici narcotici fanno parte delle miscele litiche per il potenziamento dell'anestesia. I farmaci di questo gruppo sono usati per il dolore postoperatorio in combinazione con anticolinergici M e antispastici miotropici. Sono prescritti per fermare la colica epatica (pentazocina) e renale (promedolo). Il dolore cronico è una controindicazione alla prescrizione di farmaci, ad eccezione delle forme avanzate di tumore maligno (dipidolor, tramadolo, agonisti-antagonisti). Gli analgesici narcotici sono combinati con farmaci psicotropi per tipi speciali di anestesia. La neuroleptanalgesia allevia il dolore con una combinazione di fentanil (forte, dura 30-40 minuti) e droperidolo (un leggero antipsicotico). Droperidol ha un lieve effetto sedativo, blocca le reazioni emotive e riduce il tono dei muscoli scheletrici. Anche gli effetti importanti del droperidolo sono antiemetico e antishock. Dosi di droperidolo - 1: 50. Droga combinata - talamonale. La neuroleptanalgesia viene utilizzata in operazioni a basso trauma, nel campo della neurochirurgia e in cardiologia per infarto del miocardio, ecc. Atalgesia o analgesia tranquillante - fentanil in combinazione con un forte tranquillante come sibazon, fenazepam. Lo svantaggio principale è la forte depressione respiratoria del fentanil e la conservazione della coscienza. Lezione n. 12. Anestesia. Tipi e fasi dell'anestesia L'anestesia generale, o anestesia, è uno stato del corpo caratterizzato da un arresto temporaneo della coscienza di una persona, dalla sua sensibilità al dolore e dai suoi riflessi, nonché dal rilassamento dei muscoli dei muscoli scheletrici, causato dall'azione degli analgesici narcotici su il sistema nervoso centrale. A seconda delle vie di somministrazione di sostanze stupefacenti nel corpo, si distinguono l'anestesia per inalazione e non per inalazione. 1. Teorie dell'anestesia Attualmente non ci sono teorie sull'anestesia che definiscano chiaramente il meccanismo d'azione narcotico degli anestetici. Tra le teorie disponibili sull'anestesia, le più significative sono le seguenti. I farmaci possono causare cambiamenti specifici in tutti gli organi e sistemi. Durante il periodo in cui il corpo è saturo di un analgesico narcotico, c'è una certa messa in scena nel cambiamento della coscienza, della respirazione e della circolazione sanguigna del paziente. Pertanto, ci sono fasi che caratterizzano la profondità dell'anestesia. Queste fasi si manifestano particolarmente chiaramente durante l'anestesia con etere. Ci sono 4 fasi: 1) analgesia; 2) eccitazione; 3) stadio chirurgico, suddiviso in 4 livelli; 4) fase del risveglio. Fase di analgesia Il paziente è cosciente, ma si nota un po' di letargia, sonnecchia, risponde a domande a monosillabi. La sensibilità superficiale e al dolore è assente, ma per quanto riguarda la sensibilità tattile e termica, sono preservate. In questa fase vengono eseguiti interventi chirurgici a breve termine, come apertura di flemmone, ascessi, studi diagnostici, ecc. La fase è a breve termine, della durata di 3-4 minuti. Fase di eccitazione In questa fase, i centri della corteccia cerebrale sono inibiti e i centri sottocorticali in questo momento sono in uno stato di eccitazione. Allo stesso tempo, la coscienza del paziente è completamente assente, si nota un'eccitazione motoria e vocale pronunciata. I pazienti iniziano a urlare, tentano di alzarsi dal tavolo operatorio. Si nota iperemia della pelle, il polso diventa frequente, la pressione sanguigna sistolica aumenta. La pupilla dell'occhio si allarga, ma la reazione alla luce persiste, si nota la lacrimazione. Spesso c'è tosse, aumento della secrezione bronchiale, a volte vomito. L'intervento chirurgico sullo sfondo dell'eccitazione non può essere eseguito. Durante questo periodo, dovresti continuare a saturare il corpo con un narcotico per migliorare l'anestesia. La durata della fase dipende dalle condizioni generali del paziente e dall'esperienza dell'anestesista. In genere, la durata dell'eccitazione è di 7-15 minuti. Fase chirurgica Con l'inizio di questa fase dell'anestesia, il paziente si calma, la respirazione diventa calma e uniforme, la frequenza cardiaca e la pressione sanguigna si avvicinano alla normalità. Durante questo periodo, sono possibili interventi chirurgici. A seconda della profondità dell'anestesia, si distinguono 4 livelli e lo stadio III dell'anestesia. Primo livello: il paziente è calmo, il numero dei movimenti respiratori, il numero dei battiti cardiaci e la pressione sanguigna si stanno avvicinando ai valori iniziali. La pupilla inizia gradualmente a restringersi, la sua reazione alla luce viene preservata. C'è un movimento regolare dei bulbi oculari, una disposizione eccentrica. I riflessi corneali e faringeo-laringei sono stati preservati. Il tono muscolare è preservato, quindi le operazioni addominali a questo livello non vengono eseguite. Secondo livello: il movimento dei bulbi oculari è interrotto, sono fissati in posizione centrale. Le pupille si dilatano e la loro reazione alla luce si indebolisce. L'attività dei riflessi corneale e faringeo-laringeo inizia a indebolirsi con una graduale scomparsa entro la fine del secondo livello. I movimenti respiratori sono calmi e uniformi. I valori di pressione arteriosa e polso acquisiscono valori normali. Il tono muscolare è ridotto, il che consente operazioni addominali. L'anestesia, di regola, viene eseguita nel periodo del primo e del secondo livello. Il terzo livello è caratterizzato come anestesia profonda. Allo stesso tempo, le pupille degli occhi si dilatano con una reazione a un forte stimolo luminoso. Per quanto riguarda il riflesso corneale, è assente. Si sviluppa il completo rilassamento dei muscoli scheletrici, compresi i muscoli intercostali. A causa di quest'ultimo, i movimenti respiratori diventano superficiali o diaframmatici. La mascella inferiore si abbassa, mentre i suoi muscoli si rilassano, la radice della lingua affonda e chiude l'ingresso della laringe. Tutto quanto sopra porta all'arresto respiratorio. Per prevenire questa complicazione, la mascella inferiore viene portata in avanti e mantenuta in questa posizione. A questo livello si sviluppa la tachicardia e il polso diventa un piccolo riempimento e tensione. Il livello di pressione arteriosa diminuisce. L'esecuzione dell'anestesia a questo livello è pericolosa per la vita del paziente. quarto livello; la massima espansione della pupilla con l'assenza della sua reazione alla luce, la cornea è opaca e secca. Dato che si sviluppa la paralisi dei muscoli intercostali, la respirazione diventa superficiale e viene eseguita dai movimenti del diaframma. La tachicardia è caratteristica, mentre il polso diventa filiforme, frequente e difficile da determinare in periferia, la pressione sanguigna si riduce drasticamente o non viene rilevata affatto. L'anestesia al quarto livello è pericolosa per la vita del paziente, poiché può verificarsi un arresto respiratorio e circolatorio. Fase di risveglio Non appena l'introduzione di stupefacenti si interrompe, la loro concentrazione nel sangue diminuisce e il paziente attraversa tutte le fasi dell'anestesia in ordine inverso, si verifica il risveglio. 2. Preparare il paziente per l'anestesia L'anestesista assume un ruolo diretto e spesso principale nella preparazione del paziente all'anestesia e alla chirurgia. Momento d'obbligo è l'esame del paziente prima dell'operazione, ma allo stesso tempo è importante non solo la malattia di base, per la quale si vuole operare, ma anche la presenza di patologie concomitanti, che l'anestesista chiede in dettaglio. . È necessario sapere come è stato trattato il paziente per queste malattie, l'effetto del trattamento, la durata del trattamento, la presenza di reazioni allergiche, il tempo dell'ultima esacerbazione. Se il paziente subisce un intervento chirurgico in modo pianificato, se necessario, viene eseguita la correzione delle malattie concomitanti esistenti. L'igiene del cavo orale è importante in presenza di denti sciolti e cariati, poiché possono essere un'ulteriore e indesiderata fonte di infezione. L'anestesista scopre e valuta lo stato psiconevrologico del paziente. Quindi, ad esempio, nella schizofrenia, l'uso di droghe allucinogene (ketamina) è controindicato. La chirurgia durante il periodo di psicosi è controindicata. In presenza di un deficit neurologico, viene preliminarmente corretto. L'anamnesi allergica è di grande importanza per l'anestesista, per questo viene specificata l'intolleranza ai farmaci, oltre al cibo, ai prodotti chimici domestici, ecc.. Se il paziente ha un'anamnesi allergica aggravata, nemmeno ai farmaci, durante l'anestesia, una reazione allergica può svilupparsi fino a shock anafilattico. Pertanto, gli agenti desensibilizzanti (difenidramina, suprastin) vengono introdotti nella premedicazione in grandi quantità. Un punto importante è la presenza di un paziente in passato operazioni e anestesia. Si scopre che cos'era l'anestesia e se ci sono state complicazioni. Si richiama l'attenzione sulla condizione somatica del paziente: la forma del viso, la forma e il tipo del torace, la struttura e la lunghezza del collo, la gravità del grasso sottocutaneo, la presenza di edema. Tutto ciò è necessario per scegliere il giusto metodo di anestesia e farmaci. La prima regola per preparare un paziente all'anestesia durante qualsiasi operazione e quando si utilizza qualsiasi anestesia è la pulizia del tratto gastrointestinale (lo stomaco viene lavato attraverso la sonda, vengono eseguiti clisteri purificanti). Per sopprimere la reazione psico-emotiva e sopprimere l'attività del nervo vago, prima dell'intervento chirurgico al paziente vengono somministrati farmaci: la premedicazione. Di notte, il fenazepam viene prescritto per via intramuscolare. Ai pazienti con un sistema nervoso labile vengono prescritti tranquillanti (seduxen, relanium) il giorno prima dell'intervento chirurgico. 40 minuti prima dell'intervento, gli analgesici narcotici vengono iniettati per via intramuscolare o sottocutanea: 1 ml di una soluzione all'1-2% di promololo o 1 ml di pentozocina (lexir), 2 ml di fentanil o 1 ml di morfina all'1%. Per sopprimere la funzione del nervo vago e ridurre la salivazione, vengono somministrati 0,5 ml di una soluzione allo 0,1% di atropina. Immediatamente prima dell'operazione, viene esaminata la cavità orale per la presenza di denti rimovibili e protesi che vengono rimosse. 3. Anestesia endovenosa I vantaggi dell'anestesia generale per via endovenosa sono la rapida introduzione del paziente in anestesia. Con questo tipo di anestesia, non c'è eccitazione e il paziente si addormenta rapidamente. Ma i narcotici utilizzati per la somministrazione endovenosa creano un'anestesia a breve termine, quindi non possono essere utilizzati nella loro forma pura come mononarcosi per operazioni a lungo termine. I barbiturici - sodio tiopentale ed esenale - sono in grado di indurre rapidamente il sonno narcotico, mentre non c'è stadio di eccitazione e il risveglio è veloce. I quadri clinici dell'anestesia condotta con sodio tiopentale ed esenale sono simili. Geksenal ha un effetto meno inibitorio sul centro respiratorio. Vengono utilizzate soluzioni appena preparate di derivati dell'acido barbiturico. Il contenuto della fiala (1 g del farmaco) viene sciolto prima dell'inizio dell'anestesia in 100 ml di soluzione isotonica di cloruro di sodio (soluzione all'1%). La vena periferica o centrale (secondo le indicazioni) viene perforata e la soluzione preparata viene iniettata lentamente alla velocità di 1 ml per 10-15 s. Quando la soluzione è stata iniettata in un volume di 3-5 ml, la sensibilità del paziente ai derivati dell'acido barbiturico viene determinata entro 30 secondi. Se non si nota alcuna reazione allergica, continuare l'introduzione del farmaco fino alla fase chirurgica dell'anestesia. Dall'inizio del sonno narcotico, con una singola iniezione di anestetico, la durata dell'anestesia è di 10-15 minuti. Per mantenere l'anestesia, i barbiturici vengono somministrati in frazioni di 100-200 mg del farmaco, fino a una dose totale non superiore a 1 g Durante la somministrazione di barbiturici, l'infermiera registra il polso, la pressione sanguigna e la respirazione. L'anestesista controlla lo stato della pupilla, il movimento dei bulbi oculari, la presenza di un riflesso corneale per determinare il livello di anestesia. L'anestesia con barbiturici, in particolare tiopentale-sodio, è caratterizzata da depressione del centro respiratorio, quindi è necessaria la presenza di un apparato respiratorio artificiale. Quando si verifica un arresto respiratorio (apnea), la ventilazione polmonare artificiale (ALV) viene eseguita utilizzando una maschera di un autorespiratore. La rapida somministrazione di tiopentale sodico può portare ad una diminuzione della pressione sanguigna e depressione cardiaca. In questo caso, la somministrazione del farmaco viene interrotta. In chirurgia, l'anestesia con barbiturici come mononarcosi viene utilizzata per operazioni a breve termine che non superano i 20 minuti di durata (ad esempio apertura di ascessi, flemmone, riduzione delle lussazioni, manipolazioni diagnostiche e riposizionamento di frammenti ossei). I derivati dell'acido barbiturico sono utilizzati anche per l'anestesia di induzione. Viadryl (predion per iniezione) viene utilizzato alla dose di 15 mg/kg, con una dose totale in media di 1000 mg. Viadryl è utilizzato principalmente in piccole dosi insieme al protossido di azoto. A dosi elevate, questo farmaco può causare una diminuzione della pressione sanguigna. Una complicazione del suo utilizzo è lo sviluppo di flebiti e tromboflebiti. Per prevenirne lo sviluppo, si raccomanda di somministrare lentamente il farmaco nella vena centrale sotto forma di una soluzione al 2,5%. Viadryl è utilizzato per gli esami endoscopici come tipo introduttivo di anestesia. Il propanidide (epontol, sombrevin) è disponibile in fiale da 10 ml di una soluzione al 5%. La dose del farmaco è di 7-10 mg / kg, somministrata per via endovenosa, rapidamente (l'intera dose è di 500 mg in 30 secondi). Il sonno arriva immediatamente - "alla fine dell'ago". La durata del sonno anestetico è di 5-6 minuti. Il risveglio è veloce, calmo. L'uso di propanidide provoca iperventilazione, che si verifica immediatamente dopo la perdita di coscienza. A volte può verificarsi apnea. In questo caso, la ventilazione deve essere eseguita utilizzando un autorespiratore. Il lato negativo è la possibilità di formazione di ipossia sullo sfondo della somministrazione del farmaco. È necessario controllare la pressione sanguigna e il polso. Il farmaco viene utilizzato per l'anestesia di induzione nella pratica chirurgica ambulatoriale per piccole operazioni. L'idrossibutirrato di sodio viene somministrato per via endovenosa molto lentamente. La dose media è di 100-150 mg/kg. Il farmaco crea un'anestesia superficiale, quindi viene spesso utilizzato in combinazione con altri narcotici, come i barbiturici - il propanidide. Viene spesso utilizzato per l'anestesia di induzione. La ketamina (ketalar) può essere utilizzata per la somministrazione endovenosa e intramuscolare. La dose stimata del farmaco è di 2-5 mg / kg. La ketamina può essere utilizzata per la mononarcosi e per l'anestesia di induzione. Il farmaco provoca un sonno superficiale, stimola l'attività del sistema cardiovascolare (la pressione sanguigna aumenta, il polso accelera). L'introduzione del farmaco è controindicata nei pazienti con ipertensione. Ampiamente usato in stato di shock nei pazienti con ipotensione. Gli effetti collaterali della ketamina possono essere allucinazioni spiacevoli al termine dell'anestesia e al risveglio. 4. Anestesia per inalazione L'anestesia per inalazione viene eseguita con l'aiuto di liquidi (volatili) facilmente evaporabili - etere, alotano, metossiflurano (pentran), tricloroetilene, cloroformio o sostanze stupefacenti gassose - protossido di azoto, ciclopropano. Con il metodo endotracheale dell'anestesia, la sostanza narcotica entra nel corpo dalla macchina per anestesia attraverso un tubo inserito nella trachea. Il vantaggio del metodo sta nel fatto che fornisce la pervietà libera delle vie respiratorie e può essere utilizzato in operazioni su collo, viso, testa, elimina la possibilità di aspirazione di vomito, sangue; riduce la quantità di droga utilizzata; migliora lo scambio di gas riducendo lo spazio "morto". L'anestesia endotracheale è indicata per interventi chirurgici importanti, viene utilizzata come anestesia multicomponente con miorilassanti (anestesia combinata). L'uso totale di diversi farmaci a piccole dosi riduce gli effetti tossici sul corpo di ciascuno di essi. La moderna anestesia mista viene utilizzata per fornire analgesia, spegnere la coscienza, rilassamento. L'analgesia e lo spegnimento della coscienza vengono effettuati utilizzando una o più sostanze stupefacenti, inalate o non. L'anestesia viene eseguita al primo livello della fase chirurgica. Il rilassamento muscolare, o rilassamento, si ottiene con la somministrazione frazionata di miorilassanti. 5. Fasi dell'anestesia Ci sono tre fasi dell'anestesia. 1. Introduzione all'anestesia. L'anestesia introduttiva può essere eseguita con qualsiasi sostanza narcotica, contro la quale si verifica un sonno anestetico piuttosto profondo senza uno stadio di eccitazione. Vengono utilizzati principalmente barbiturici, fentanil in combinazione con sombrevin, macinato con sombrevin. Viene spesso utilizzato anche il tiopentale di sodio. I farmaci vengono utilizzati sotto forma di una soluzione all'1%, vengono somministrati per via endovenosa alla dose di 400-500 mg. Sullo sfondo dell'anestesia di induzione, vengono somministrati miorilassanti e viene eseguita l'intubazione tracheale. 2. Mantenimento dell'anestesia. Per mantenere l'anestesia generale, è possibile utilizzare qualsiasi farmaco in grado di proteggere il corpo da traumi chirurgici (alotano, ciclopropano, protossido di azoto con ossigeno) e neuroleptanalgesia. L'anestesia viene mantenuta al primo e al secondo livello della fase chirurgica e vengono somministrati miorilassanti per eliminare le tensioni muscolari, che causano mioplegia di tutti i gruppi muscolari scheletrici, compresi quelli respiratori. Pertanto, la condizione principale per il moderno metodo combinato di anestesia è la ventilazione meccanica, che viene eseguita schiacciando ritmicamente una borsa o una pelliccia o utilizzando un apparato di respirazione artificiale. Recentemente, la neuroleptanalgesia più diffusa. Con questo metodo, per l'anestesia vengono utilizzati protossido di azoto con ossigeno, fentanil, droperidolo, miorilassanti. Anestesia introduttiva endovenosa. L'anestesia viene mantenuta mediante inalazione di protossido di azoto con ossigeno in un rapporto di 2: 1, somministrazione endovenosa frazionata di fentanil e droperidolo 1-2 ml ogni 15-20 minuti. Con l'aumento della frequenza cardiaca, viene somministrato il fentanil, con un aumento della pressione sanguigna - droperidolo. Questo tipo di anestesia è più sicuro per il paziente. Il fentanil migliora il sollievo dal dolore, il droperidolo sopprime le reazioni vegetative. 3. Ritiro dall'anestesia. Entro la fine dell'operazione, l'anestesista interrompe gradualmente la somministrazione di sostanze stupefacenti e miorilassanti. La coscienza ritorna al paziente, la respirazione indipendente e il tono muscolare vengono ripristinati. Il criterio per valutare l'adeguatezza della respirazione spontanea sono indicatori di RO2, RSO2, pH. Dopo il risveglio, il ripristino della respirazione spontanea e del tono muscolare scheletrico, l'anestesista può estubare il paziente e trasportarlo per un'ulteriore osservazione nella sala di risveglio. 6. Metodi per monitorare lo svolgimento dell'anestesia Durante l'anestesia generale, i principali parametri dell'emodinamica vengono costantemente determinati e valutati. Misurare la pressione sanguigna, la frequenza cardiaca ogni 10-15 minuti. Nelle persone con malattie del sistema cardiovascolare, così come durante le operazioni toraciche, è necessario monitorare costantemente la funzione del muscolo cardiaco. L'osservazione elettroencefalografica può essere utilizzata per determinare il livello di anestesia. Per controllare la ventilazione polmonare e i cambiamenti metabolici durante l'anestesia e la chirurgia, è necessario condurre uno studio dello stato acido-base (RO2, RSO2, pH, BE). Durante l'anestesia, l'infermiera mantiene una cartella anestetica del paziente, in cui registra necessariamente i principali indicatori dell'omeostasi: frequenza cardiaca, pressione sanguigna, pressione venosa centrale, frequenza respiratoria e parametri del ventilatore. In questa mappa sono fissate tutte le fasi dell'anestesia e della chirurgia, sono indicate le dosi di sostanze stupefacenti e miorilassanti. Vengono annotati tutti i farmaci utilizzati durante l'anestesia, compresi i mezzi trasfusionali. Viene registrato il tempo di tutte le fasi dell'operazione e della somministrazione dei farmaci. Al termine dell'operazione viene indicato il numero totale di tutti i mezzi utilizzati, che si riflette anche nella scheda di anestesia. Viene registrato un registro di tutte le complicazioni durante l'anestesia e l'intervento chirurgico. La scheda dell'anestesia è inserita nell'anamnesi. 7. Complicazioni dell'anestesia Complicazioni durante l'anestesia possono verificarsi a causa di una tecnica di anestesia impropria o dell'effetto degli anestetici sugli organi vitali. Una di queste complicazioni è il vomito. All'inizio dell'introduzione dell'anestesia, il vomito può essere associato alla natura della malattia dominante (stenosi pilorica, ostruzione intestinale) o all'effetto diretto del farmaco sul centro del vomito. Sullo sfondo del vomito, l'aspirazione è pericolosa: l'ingresso del contenuto gastrico nella trachea e nei bronchi. I contenuti gastrici che hanno una reazione acida pronunciata, che cadono sulle corde vocali e poi penetrano nella trachea, possono portare a laringospasmo o broncospasmo, con conseguente insufficienza respiratoria con successiva ipossia - questa è la cosiddetta sindrome di Mendelssohn, accompagnata da cianosi, broncospasmo, tachicardia. Pericoloso può essere il rigurgito: lancio passivo del contenuto gastrico nella trachea e nei bronchi. Questo di solito si verifica sullo sfondo di un'anestesia profonda utilizzando una maschera con rilassamento degli sfinteri e trabocco dello stomaco o dopo l'introduzione di miorilassanti (prima dell'intubazione). L'ingestione nel polmone durante il vomito o il rigurgito di contenuto gastrico acido porta a una grave polmonite, spesso fatale. Per evitare la comparsa di vomito e rigurgito, è necessario rimuovere il suo contenuto dallo stomaco con una sonda prima dell'anestesia. Nei pazienti con peritonite e ostruzione intestinale, la sonda viene lasciata nello stomaco durante l'intera anestesia, mentre è necessaria una posizione moderata di Trendelenburg. Prima di iniziare l'anestesia, il metodo Selick può essere utilizzato per prevenire il rigurgito, premendo la cartilagine cricoidea posteriormente, che provoca la compressione dell'esofago. In caso di vomito è necessario rimuovere rapidamente il contenuto gastrico dal cavo orale con tampone e aspirazione; in caso di rigurgito, il contenuto gastrico viene rimosso per aspirazione attraverso un catetere inserito nella trachea e nei bronchi. Il vomito seguito da aspirazione può verificarsi non solo durante l'anestesia, ma anche quando il paziente si sveglia. Per prevenire l'aspirazione in questi casi, è necessario che il paziente prenda una posizione orizzontale o Trendelenburg, giri la testa di lato. Il paziente deve essere monitorato. Possono verificarsi complicazioni dell'apparato respiratorio a causa della ridotta pervietà delle vie aeree. Ciò può essere dovuto a difetti nella macchina per anestesia. Prima di iniziare l'anestesia, è necessario controllare il funzionamento del dispositivo, la sua tenuta e la permeabilità dei gas attraverso i tubi respiratori. L'ostruzione delle vie aeree può verificarsi a seguito della retrazione della lingua durante l'anestesia profonda (livello III della fase chirurgica dell'anestesia). Durante l'anestesia, corpi estranei solidi (denti, protesi) possono entrare nel tratto respiratorio superiore. Per prevenire queste complicazioni, è necessario far avanzare e sostenere la mascella inferiore sullo sfondo dell'anestesia profonda. Prima dell'anestesia, la dentiera deve essere rimossa, i denti del paziente devono essere esaminati. Le complicanze dell'intubazione tracheale eseguita mediante laringoscopia diretta possono essere raggruppate come segue: 1) danno ai denti da parte della lama del laringoscopio; 2) danno alle corde vocali; 3) introduzione di un tubo endotracheale nell'esofago; 4) introduzione di un tubo endotracheale nel bronco destro; 5) uscita del tubo endotracheale dalla trachea o piegamento dello stesso. Le complicanze descritte possono essere prevenute grazie a una chiara conoscenza della tecnica di intubazione e al controllo della posizione del tubo endotracheale nella trachea al di sopra della sua biforcazione (mediante l'auscultazione dei polmoni). Complicazioni dal sistema circolatorio. Una diminuzione della pressione sanguigna sia durante il periodo dell'anestesia che durante l'anestesia può verificarsi a causa dell'effetto di sostanze narcotiche sull'attività del cuore o sul centro vascolare-motorio. Ciò accade con un sovradosaggio di sostanze stupefacenti (spesso alotano). L'ipotensione può comparire in pazienti con BCC basso con il dosaggio ottimale di sostanze stupefacenti. Per prevenire questa complicazione, è necessario colmare la carenza di BCC prima dell'anestesia e durante l'operazione, accompagnata da perdita di sangue, trasfondere soluzioni sostitutive del sangue e sangue. Disturbi del ritmo cardiaco (tachicardia ventricolare, extrasistole, fibrillazione ventricolare) possono verificarsi per una serie di motivi: 1) ipossia e ipercapnia derivanti da intubazione prolungata o ventilazione insufficiente durante l'anestesia; 2) sovradosaggio di sostanze stupefacenti - barbiturici, alotano; 3) l'uso di epinefrina sullo sfondo dell'alotano, che aumenta la sensibilità dell'alotano alle catecolamine. Il controllo elettrocardiografico è necessario per determinare il ritmo cardiaco. Il trattamento viene effettuato in base alla causa della complicazione e comprende l'eliminazione dell'ipossia, una diminuzione della dose del farmaco, l'uso di farmaci chinino. L'arresto cardiaco è la complicanza più pericolosa durante l'anestesia. Il motivo è il più delle volte un controllo errato sulle condizioni del paziente, errori nella tecnica dell'anestesia, ipossia, ipercapnia. Il trattamento consiste nella rianimazione cardiopolmonare immediata. Complicazioni del sistema nervoso. Durante l'anestesia generale, è consentita una moderata diminuzione della temperatura corporea a causa dell'influenza delle sostanze narcotiche sui meccanismi centrali di termoregolazione e raffreddamento del paziente in sala operatoria. Il corpo dei pazienti con ipotermia dopo l'anestesia cerca di ripristinare la temperatura corporea a causa dell'aumento del metabolismo. In questo contesto, alla fine dell'anestesia e dopo di essa compaiono brividi, che si osservano dopo l'anestesia con alotano. Per prevenire l'ipotermia, è necessario monitorare la temperatura in sala operatoria (21-22 ° C), coprire il paziente, se necessario, la terapia infusionale, versare soluzioni riscaldate alla temperatura corporea e inalare narcotici caldi e inumiditi. L'edema cerebrale è una conseguenza dell'ipossia prolungata e profonda durante l'anestesia. Il trattamento deve essere immediato, è necessario seguire i principi di disidratazione, iperventilazione, raffreddamento locale del cervello. Danno ai nervi periferici. Questa complicanza si verifica un giorno o più dopo l'anestesia. Molto spesso, i nervi degli arti superiori e inferiori e il plesso brachiale sono danneggiati. Questo è il risultato di un'errata posizione del paziente sul tavolo operatorio (abduzione del braccio a più di 90° dal corpo, posizionamento del braccio dietro la testa, fissaggio del braccio all'arco del tavolo operatorio, appoggio delle gambe supporti senza imbottitura). La corretta posizione del paziente sul lettino elimina la tensione dei tronchi nervosi. Il trattamento viene effettuato da un neuropatologo e un fisioterapista. Lezione numero 13. Anestesia locale 1. Anestesia di superficie Questo tipo di anestesia viene effettuato per contatto della sostanza anestetica con l'uno o l'altro organo, la sua superficie. A tale scopo vengono utilizzate una soluzione all'1-3% di cocaina, una soluzione allo 0,25-2% di dicaina, una soluzione all'1-2% di lidocaina, una soluzione all'1-5% di trimecaina e una soluzione allo 0,5-2%. soluzione. La maggior parte degli anestetici locali si lega ai canali del sodio inattivati, impedendo la loro attivazione e l'ingresso del sodio nella cellula durante la depolarizzazione della membrana, ottenendo così un effetto analgesico. La tecnica dell'anestesia superficiale è semplice e consiste nel lubrificare, instillare una soluzione o spruzzarla utilizzando speciali pistole a spruzzo. L'inizio dell'azione dell'anestetico dipende dal pH, con un pH basso che richiede più tempo per avere effetto rispetto a un pH alto. La durata dell'azione dell'anestetico dipende dal grado del suo legame con le proteine. Questo tipo di anestesia viene utilizzato nelle manipolazioni diagnostiche e in oftalmologia, otorinolaringoiatria. 2. Anestesia regionale L'anestesia regionale comprende plesso, conduzione, epidurale, paravertebrale e altri tipi di anestesia. A differenza dell'anestesia generale, l'anestesia regionale fornisce un'adeguata analgesia chirurgica a causa del blocco periferico degli impulsi del dolore pur mantenendo le normali funzioni vitali. L'anestesia regionale è tecnicamente difficile e richiede un'accurata conoscenza della posizione anatomica e topografica del plesso nervoso o conduttore nervoso, un chiaro orientamento nei punti di identificazione permanente (sporgenza ossea, arterie, muscoli), la capacità di valutare la resistenza dei tessuti e le sensazioni del paziente. Per disattivare la sensibilità al dolore, è sufficiente introdurre una soluzione all'1% di trimecaina (lidocaina) e per disattivare la sensibilità propriocettiva e ottenere il rilassamento muscolare, devono essere utilizzate soluzioni anestetiche locali più concentrate (ad esempio trimecaina 2-2,5%) . Il ripristino della sensibilità avviene nell'ordine inverso, cioè compaiono prima il tono muscolare e le sensazioni propriocettive, quindi le sensazioni di dolore e temperatura. È importante considerare che con un aumento della concentrazione e della quantità di anestetico locale, aumenta la sua tossicità. Le soluzioni più utilizzate sono trimecaina 1-2%, lidocaina 1-2% e bupivocaina 0,75-0,5%. Gli anestetici locali bloccano le fibre mieliniche prive di mielina e sottili più facilmente e rapidamente (tutte vegetative, oltre a condurre gli stimoli di temperatura e dolore). Le spesse fibre mieliniche che vanno ai muscoli scheletrici, ai recettori tattili e ai propriocettori sono altamente resistenti all'anestesia, poiché sono interessate dall'anestesia locale nell'area delle intercettazioni di Ranvier. La diffusione dell'anestetico nella parte lipoide della fibra nervosa è rapida, ma solo fino a quando la concentrazione all'esterno del nervo non è superiore a quella del nervo stesso. Dopo che questo rapporto cambia, l'anestetico si diffonde nella direzione opposta dal nervo nei tessuti circostanti. Soluzioni anestetiche debolmente concentrate, iniettate in grandi volumi, si diffondono ampiamente, ma la loro diffusione è trascurabile. Le soluzioni concentrate introdotte in piccoli volumi hanno un buon grado di diffusione. L'effetto dell'anestesia dipende dalla quantità di anestetico che penetra per via transperineurale e provoca un adeguato blocco della soglia. Il raddoppio della concentrazione dell'anestetico iniettato prolunga l'anestesia di 1/3 e l'introduzione di un doppio volume - solo del 3-9%. Gli anestetici locali spesso portano a reazioni anafilattiche. Trimecaina: la durata dell'azione è di 1-1,5 ore, la dose singola massima è di 800-1000 mg La lidocaina (xicaina) viene utilizzata in una soluzione all'1-2%, la durata dell'anestesia è fino a 2,5-3 ore Bupivocaina (marcaina ) viene utilizzato in una soluzione allo 0,5-0,75% in una singola dose massima di 150-170 mg, la durata dell'azione è di 8-12 ore Per l'uso di anestetici a lunga durata d'azione, l'aggiunta di lidocaina accelera chiaramente l'insorgenza del effetto, riducendo il periodo di latenza. Quando si esegue l'anestesia regionale, è necessario conoscere e seguire le regole generali: 1) conoscere chiaramente le caratteristiche anatomiche e topografiche dei plessi nervosi e dei conduttori nell'area dell'anestesia proposta, nonché la tecnica di esecuzione dell'anestesia; 2) scegliere il giusto anestetico locale, determinarne la concentrazione, la dose totale e la modalità di somministrazione al plesso nervoso o al conduttore; 3) valutare le condizioni del paziente e scoprire il background allergico e farmacoterapeutico; 4) avvertire il paziente della possibile conservazione della sensibilità tattile e propriocettiva profonda durante la conduzione e l'anestesia del plesso; 5) monitorare costantemente l'emodinamica e la respirazione del paziente dopo l'anestesia; 6) prima o subito dopo l'anestesia, eseguire la venipuntura e adottare misure per prevenire possibili complicanze; 7) eseguire nel rispetto delle misure asettiche e antisettiche e rimuovere accuratamente le sostanze chimicamente attive (iodio, clorexidina, ecc.) dalla superficie cutanea prima della puntura; 8) prima dell'introduzione di un anestetico locale, è indispensabile eseguire un test di aspirazione per evitare che l'ago entri nel vaso arterioso; 9) ricordare che la parestesia avvertita dal paziente durante l'anestesia regionale è un prerequisito per il successo nell'ottenere l'analgesia; la sua assenza indica un possibile fallimento; 10) per facilitare il ritrovamento del conduttore nervoso o del plesso, si consiglia di utilizzare la stimolazione elettrica, applicando un impulso negativo all'ago, e un impulso positivo (anodo) al polo indifferente dell'elettrodo, che è fissato al paziente pelle. 3. Anestesia del plesso cervicale (ASP) L'ACS, eseguita su uno o entrambi i lati, consente di eseguire tutti gli interventi su collo, tiroide, vasi brachiocefalici in caso di ferite da arma da fuoco, lesioni e malattie tumorali. Il plesso cervicale (Plexus cervicalis) è formato dai rami anteriori dei quattro nervi cervicali superiori (C1-INSIEME A4) alla loro uscita dai fori intervertebrali. Si trova sulla superficie anteriore del muscolo scaleno medio e del muscolo che solleva la scapola, lateralmente ai processi trasversali delle vertebre cervicali. I nervi motori del plesso cervicale innervano i muscoli del collo e i nervi sensoriali: la pelle della regione occipitale della testa, le superfici anteriore e laterale del collo, la regione succlavia al livello delle costole I e II e il padiglione auricolare. Il nervo più grande del plesso cervicale è il frenico (p. prenicus), formato da C3-INSIEME A4 e meno spesso a causa di un ramo aggiuntivo da C5. La maggior parte dei nervi sensoriali esce nel mezzo da sotto il bordo posteriore del muscolo sternocleidomastoideo e diverge negli strati superficiali del collo, nella pelle della regione occipitale della testa e nella parte superiore del torace. Quando l'anestesia dei nervi sensibili del plesso cervicale lungo il bordo posteriore nel mezzo del muscolo sternocleidomastoideo, è possibile eseguire una serie di operazioni sul collo, ma va ricordato che l'anestesia deve essere bilaterale, poiché i nervi si anastomizzano lungo il linea mediana del collo. Per interventi di grandi dimensioni negli strati profondi del collo (strumectomia, asportazione di tumori del collo, laringectomia, endoarteriectomia carotidea, ecc.), è necessario anestetizzare il plesso cervicale con approccio anteriore. Con l'accesso laterale, c'è il rischio di gravi complicazioni (introduzione di una soluzione anestetica nello spazio subdurale), quindi non viene utilizzato. Per eseguire un ASS con approccio anteriore, è necessario che il paziente si corichi supino con un piccolo rotolo sotto il collo. La testa dovrebbe giacere piatta, dritta sulla linea mediana senza girarsi o essere leggermente ruotata nella direzione opposta alla puntura. Mani lungo il corpo, l'anestesista si trova alla testa della puntura. Punti di riferimento: muscolo sternocleidomastoideo, osso ioide, arteria carotide interna e angolo mandibolare. Tecnica di anestesia 2 cm sotto l'angolo della mascella inferiore, anteriormente al muscolo sternocleidomastoideo, viene determinata la pulsazione dell'arteria carotide interna. Il ramo orizzontale dell'osso ioide corrisponde al livello del processo trasversale della vertebra C3. Il punto di iniezione dell'ago si trova all'intersezione della linea, che è una continuazione del ramo orizzontale dell'osso ioide, con il bordo anteriore del muscolo sternocleidomastoideo. A questo punto di intersezione, in condizioni asettiche, si forma una "buccia di limone" attraverso la quale viene diretto un ago per iniezione dall'esterno verso l'interno e dalla parte anteriore a quella posteriore, facendolo avanzare medialmente al muscolo sternocleidomastoideo e dietro la carotide interna (nella fessura tra il muscolo sternocleidomastoideo e l'arteria carotide interna palpabile) fino a quando il paziente non sviluppa parestesie o l'ago colpisce il processo trasversale della vertebra C3. La profondità dell'iniezione non supera i 2-5 cm L'ago è fissato saldamente in questa posizione e viene eseguito un test di aspirazione, determinando se l'estremità dell'ago si trova nel lume della nave. Per l'anestesia, vengono iniettati 10-12 ml di una soluzione al 2% di trimecaina da entrambi i lati. Per migliorare l'anestesia del plesso cervicale, puoi inoltre bloccare i rami superficiali che vanno alla superficie anteriore del collo. Il luogo della loro uscita è al centro del bordo posteriore del muscolo sternocleidomastoideo. L'ago viene iniettato nel punto della loro uscita sotto la fascia superficiale del collo. Una soluzione al 2% di trimecaina viene somministrata in una quantità di 3-5 ml cranialmente e caudalmente (a forma di ventaglio). Un'adeguata anestesia si verifica dopo 8-12 minuti e fornisce un efficace sollievo dal dolore nella maggior parte dei pazienti entro 1,5-2 ore. complicazioni Sindrome di Horner, blocco del nervo frenico, paresi nervosa ricorrente, ipotensione con iniezione intravascolare di anestetico. La raucedine è il sintomo principale del blocco del plesso cervicale. La complicazione più pericolosa con l'accesso laterale è lo sviluppo di un'anestesia spinale elevata e l'ingresso di anestetico nella cavità del ventricolo IV, i cui sintomi sono la paralisi dei centri bulbari, la dilatazione della pupilla, l'abbassamento della pressione sanguigna, l'insufficienza respiratoria e l'atonia muscolare . Controindicazioni assolute all'anestesia del plesso cervicale sono la paresi del nervo frenico sul lato opposto, il danno ai nervi del plesso cervicale. 4. Anestesia del plesso brachiale (APS) L'APS consente di eseguire tutti gli interventi sull'arto superiore, sull'articolazione della spalla, sulla spalla, sull'avambraccio e sulla mano: amputazioni, trattamento chirurgico delle ferite con riposizionamento e fissazione di frammenti ossei, interventi sui vasi sanguigni e sui nervi, riduzione della lussazione della spalla, ecc. Un'elevata frequenza di interventi chirurgici sull'arto superiore, soprattutto in tempo di guerra, solleva la questione di metodi razionali di anestesia durante queste operazioni. Topograficamente, ci sono 2 parti del plesso brachiale: sopraclavicolare e succlavia. I rami si estendono dalla parte sopraclavicolare ai muscoli profondi del collo e ai muscoli del cingolo scapolare. La parte succlavia del plesso brachiale è costituita da tre tronchi che coprono l'arteria ascellare dai lati interno, posteriore ed esterno. I nervi lunghi hanno origine dai tronchi, andando alla parte libera dell'arto superiore, e un nervo corto al cingolo scapolare. Dal tronco interno si dipartono il nervo ulnare e la radice inferiore al nervo mediano; i nervi radiale e ascellare partono dal tronco posteriore, e il nervo muscolocutaneo e la radice superiore del nervo mediano partono dal tronco esterno. Pertanto, l'anestesia del plesso brachiale è possibile in varie versioni utilizzando approcci sopraclavicolari, ascellari e succlavi. Tra gli approcci sopraclavicolari, i metodi di anestesia nello spazio interstiziale sono i più ampiamente utilizzati come la più semplice, la più affidabile e la meno complicata. Anestesia del plesso brachiale di Winnie Il paziente giace supino, la testa è girata nella direzione opposta rispetto al sito di puntura, il mento è portato al cingolo scapolare controlaterale. La mano dal lato della puntura giace lungo il corpo, leggermente abbassata. Punti di riferimento: muscolo sternocleidomastoideo, scaleno anteriore, spazio interstiziale, vena giugulare esterna, clavicola, cartilagine cricoidea. Tecnica di anestesia. La pelle viene trattata con una soluzione antisettica. Dietro il muscolo sternocleidomastoideo, che contorna nettamente con un leggero rialzo della testa, a livello della cartilagine cricoidea, i polpastrelli della mano sinistra sono posti sul muscolo scaleno anteriore. Con un ulteriore spostamento delle dita lateralmente di 0,5-1,5 cm tra i muscoli scaleni anteriori e medi, viene sondato lo spazio interscalenico. Diventa più distinto con un respiro profondo, poiché questo tende i muscoli scaleni. Nella profondità dello spazio interstiziale vengono palpati i processi trasversali delle vertebre cervicali (sensazione di ferma resistenza) e con l'aumento della pressione con la punta del dito si provoca spesso parestesia nella spalla o nel cingolo scapolare; più caudalmente, nello spazio interstiziale, si può palpare l'arteria succlavia. Lo spazio interstiziale nella parte superiore è attraversato dalla vena giugulare esterna. Il punto di iniezione dell'ago si trova nella parte superiore dello spazio interstiziale a livello della cartilagine cricoidea. A questo punto si forma una "crosta di limone" e attraverso di essa l'ago viene diretto medialmente e leggermente verso il basso, da davanti a dietro (in direzione dorsale) al processo trasversale C6 ad un angolo di 30° rispetto al piano sagittale. Quando l'ago viene fatto avanzare verso l'interno a una distanza di 1,5-4 cm, si verifica una parestesia e la punta dell'ago poggia sul processo trasversale della sesta vertebra cervicale. In questa posizione, l'ago viene fissato o sollevato di 6-1 mm e, dopo un test di aspirazione, si ottengono 2-30 ml di una soluzione al 40% di trimecaina (lidocaina) o una soluzione allo 2-0,5% di bupivocaina (marcaina) iniettato. Durante l'introduzione dei primi millilitri di soluzione di anestetico locale, il paziente avverte un dolore a breve termine ("scossa elettrica"), che indica la corretta posizione della punta dell'ago. In assenza di parestesie, la posizione della punta dell'ago può essere verificata introducendo 0,75 ml di una soluzione di cloruro di sodio allo 0,5% prelevata dal frigorifero. La comparsa di una sensazione di dolore all'arto superiore indica il contatto di una soluzione fredda con un nervo. Controindicazioni: paresi del nervo ricorrente o frenico sul lato opposto, danno ai nervi del plesso brachiale. Possibili complicazioni: iniezione intravascolare di una soluzione di anestetico locale, soprattutto nell'arteria vertebrale, la cui rapida diffusione porta all'intossicazione del SNC; la somministrazione subaracnoidea di una soluzione anestetica provoca un blocco spinale totale; la somministrazione epidurale determina un'elevata anestesia epidurale. Anestesia del plesso brachiale nello spazio interstiziale secondo il metodo di S. V. Gavrilin e L. G. Tikhonov La principale differenza di questo metodo rispetto ad altri è che non ci sono cupola della pleura e grandi vasi sanguigni nel sito della puntura. Il paziente giace supino, la testa è girata nella direzione opposta rispetto al sito della puntura, il mento è portato al cingolo scapolare controlaterale. Un piccolo rullo è posizionato sotto le spalle, il braccio dal lato della puntura giace lungo il corpo. Punti di riferimento: clavicola, muscolo sternocleidomastoideo. Tecnica di anestesia. Il punto di iniezione dell'ago si trova nella parte superiore della perpendicolare, ripristinato dal bordo superiore del centro della clavicola, la cui lunghezza è ¼ della lunghezza del muscolo sternocleidomastoideo. A questo punto si forma una “buccia di limone”, l'ago per iniezione intramuscolare viene inserito con un angolo di 60° rispetto alla superficie della pelle, mentre l'ago e una perpendicolare immaginaria o disegnata dovrebbero trovarsi sullo stesso piano. L'ago viene inserito nella direzione del processo trasverso della 6a vertebra cervicale fino alla comparsa della parestesia nell'arto superiore. In assenza di parestesia, l'ago viene fatto avanzare fino in fondo nel processo trasversale della 6a vertebra cervicale e dopo averlo tirato verso se stesso di 1-2 mm, vengono iniettati 30-40 ml di una soluzione al 2% di trimecaina o lidocaina . La profondità di inserimento dell'ago è di 2-5 cm. Anestesia del plesso brachiale nella modifica di V. S. Sokolovsky Il paziente giace sulla schiena, la testa si trova sulla linea mediana, le braccia giacciono lungo il corpo. Punti di riferimento: muscolo sternocleidomastoideo e clavicola. Tecnica di anestesia. Per facilitare la ricerca di un punto sulla pelle del collo, viene costruito un triangolo con un vertice nell'area dell'articolazione sternoclavicolare sul lato dell'anestesia. I raggi del triangolo sono l'asse della clavicola e una linea retta che collega il processo mastoideo con l'articolazione sternoclavicolare. Viene ripristinata una perpendicolare alla bisettrice dell'angolo ABC dal centro della clavicola. Il punto di intersezione è il punto di iniezione dell'ago, che avanza di un angolo di 45° rispetto al piano orizzontale del tavolo operatorio e perpendicolare all'asse del rachide cervicale. A una profondità di 2-3 cm, dopo aver ricevuto parestesia e aver condotto un test di aspirazione, vengono iniettati 30-40 ml di una soluzione al 2% di trimecaina (lidocaina). L'anestesia si verifica in 10-12 minuti. Quando si ottiene una parestesia inconcludente, è desiderabile utilizzare la stimolazione elettrica per identificare il tronco nervoso del plesso cervicale. 5. Anestesia dei nervi periferici nell'area del polso Per le operazioni alla mano, è necessario anestetizzare i nervi ulnare, mediano e radiale. In tutti i casi, l'ago viene iniettato a livello della piega prossimale del polso. Durante l'anestesia, il paziente giace sulla schiena, nell'area del polso, il braccio è supinato e leggermente piegato. Punti di riferimento: stiloide dell'ulna, tendine pisiforme, flessore del carpo ulnare e tendine flessore del carpo lungo. Anestesia del nervo ulnare Topografia del nervo ulnare. Nel terzo inferiore dell'avambraccio, il nervo ulnare corre lateralmente al tendine flessore ulnare e medialmente all'arteria ulnare. A livello del polso o sulla superficie flessoria dell'avambraccio, 3-5 cm prossimale al polso, il nervo ulnare si divide in due rami: dorsale e palmare. Il ramo dorsale è sensibile, va sotto il tendine del flessore ulnare della mano ed esce nel tessuto sottocutaneo del dorso della mano all'incirca a livello dell'articolazione del polso. Anastomizzante con i rami del nervo radiale, innerva 2 ½ dita. Il ramo palmare del nervo ulnare è misto e a livello dell'osso pisiforme è diviso in due rami: profondo e superficiale. Quest'ultimo è sensibile e innerva la regione ipotenare del 5° dito e il lato ulnare dell'anulare. Tecnica per l'anestesia del ramo palmare del nervo ulnare. Il punto di iniezione dell'ago è a livello della piega prossimale del polso medialmente al tendine del flessore ulnare della mano. L'ago a una profondità di 1-2 cm viene fatto passare attraverso il tessuto sottocutaneo verso l'osso pisiforme. Dopo la comparsa della parestesia e con un test di aspirazione negativo, l'ago viene fissato e vengono iniettati 3-5 ml di una soluzione di trimecaina al 2%. In assenza di parestesia, l'ago viene fatto avanzare fino al contatto con l'osso e, una volta rimosso, i tessuti vengono infiltrati con una soluzione al 2% di trimekia. Tecnica per l'anestesia del ramo dorsale del nervo ulnare. Il punto di iniezione dell'ago si trova a livello dell'intersezione della piega prossimale del polso con il bordo mediale del tendine del muscolo flessore ulnare. L'ago è diretto al processo stiloideo dell'ulna. Per ottenere la parestesia, vengono iniettati 3-5 ml di una soluzione al 2% di trimecaina. In assenza di parestesia, l'ago viene rimosso e 5-10 ml di una soluzione di trimecaina al 2% vengono infiltrati nei tessuti. Non ci sono complicazioni. anestesia del nervo mediano Il paziente giace supino, il braccio è supinato e raddrizzato. Punti di riferimento: tendine del muscolo palmare lungo, tendine del flessore radiale della mano e piega cutanea prossimale del polso. Topografia. Nel terzo inferiore dell'avambraccio, il nervo mediano passa nel solco mediale molto vicino alla superficie della pelle, situato sotto la fascia, e circa 4-5 cm sopra la piega cutanea distale. Il solco mediale è formato dall'esterno dal tendine del flessore radiale della mano, sul lato ulnare - dal tendine del lungo flessore della mano. I rami del nervo mediano innervano il 1°, 2°, 3° dito e la superficie esterna del 4° dito, così come i muscoli tenari. Tecnica di anestesia. Il punto di iniezione dell'ago si trova sulla linea della piega cutanea prossimale del polso tra il tendine del muscolo palmare lungo e il flessore radiale della mano. Dopo l'avanzamento perpendicolare dell'ago attraverso il tessuto sottocutaneo fino a una profondità di 0,5-1 cm e ottenuto la parestesia, l'ago viene fissato e vengono iniettati 3-5 ml di una soluzione di lidocaina al 2%. Se non è possibile raggiungere la parestesia a una profondità di 1 cm, i tessuti vengono infiltrati a forma di ventaglio con 5-10 ml di una soluzione di trimecaina al 2% estraendo lentamente l'ago. Anestesia del nervo radiale Punti di riferimento: processo stiloideo del radio, arteria radiale, "tabacchiere anatomico". Topografia. Il ramo superficiale del nervo radiale va prima all'avambraccio insieme all'arteria radiale, quindi nel terzo inferiore dell'avambraccio a una distanza di circa 8 cm dall'articolazione del polso, il nervo si incrocia con il tendine del muscolo brachioradiale e passa alla superficie posteriore dell'avambraccio, dove va distalmente e posteriormente, incrociando il lungo abduttore del dito grosso e il suo corto estensore. A livello del polso nella parte superiore della "tabacchiera anatomica" si divide in rami terminali che innervano le dita 1, 2 e la superficie esterna delle dita 3. I rami di tutti e tre i nervi spesso si anastomizzano l'uno con l'altro nell'area dell'avambraccio, del polso e della mano. Tecnica di anestesia. Il punto di iniezione si trova a livello della piega cutanea prossimale del polso lateralmente all'arteria radiale sulla sporgenza della sommità della "tabacchiera anatomica" Si inietta, e l'ago è diretto verso la "tabacchiera". Quando si verifica la parestesia, l'ago viene fissato, con un test di aspirazione negativo, vengono iniettati 3-5 ml di una soluzione di trimecaina al 2%. In assenza di parestesie, 5-10 ml di una soluzione al 2% di trimecaina vengono iniettati a ventaglio nei tessuti sottostanti, creando un "braccialetto" di infiltrazione lungo 3-3,5 cm dai tendini del corto estensore e del lungo abduttore del pollice da un lato, al lungo estensore del pollice - con un altro. 6. Anestesia degli arti inferiori Per eseguire interventi chirurgici sull'arto inferiore è necessario anestetizzare tutti e quattro i nervi principali. Tre di loro - il nervo femorale, otturatorio e cutaneo esterno della coscia - provengono dal plesso lombare e il nervo sciatico è formato in parte dal lombare e da tre rami del plesso sacrale. Ogni nervo innerva alcune aree dell'arto inferiore: il nervo femorale - la superficie anteriore della coscia, la superficie interna anteriore della parte inferiore della gamba e la parte posteriore del piede; ischiatico - superficie posteriore e laterale della parte inferiore della gamba, superficie plantare del piede e suo bordo esterno, otturatore - superficie interna della coscia; nervo cutaneo esterno della coscia - la superficie laterale della coscia. Le zone di profonda sensibilità coincidono con l'innervazione delle zone cutanee. Tutti i muscoli dell'arto inferiore ricevono fibre motorie dai nervi femorale e sciatico, ad eccezione del gruppo di abduttori innervati dal nervo otturatore. L'articolazione del ginocchio e la sua superficie anteriore sono innervate dal nervo femorale, la superficie interna dall'otturatore, quella laterale dall'esterno cutaneo e sciatico e quella posteriore dai nervi cutaneo, femorale e sciatico posteriore. Anestesia del plesso lombare mediante accesso anteriore (inguinale). Il paziente giace supino. Punti di riferimento: legamento inguinale e arteria femorale. Topografia. Il plesso lombare è formato dai rami anteriori anastomosi delle radici L.1-L2-L3 e in parte dai rami anteriori di Th12 e L4 nervi. Il plesso si trova davanti ai processi trasversali delle vertebre lombari tra il muscolo quadrato della parte bassa della schiena - dorsalmente, il muscolo maggiore psoas - ventralmente, i corpi vertebrali - medialmente, emette rami muscolari e scende nel letto fasciale. I nervi spinali lombari hanno rami di collegamento con i nodi lombari dei tronchi simpatici, contengono fibre nervose motorie, sensoriali e simpatiche. I nervi più grandi del plesso lombare sono il nervo cutaneo femorale esterno (L2-L3), otturatore (L2-L4) e femorale (L2-L4) nervi. Quest'ultimo è una continuazione del plesso lombare, si estende fino alla coscia sotto il legamento pupartito attraverso la lacuna muscolare, essendo separato dall'arteria femorale situata medialmente dal legamento ileopectineale. La larghezza del nervo femorale in questo punto è di circa 0,7-0,8 cm La profondità del nervo femorale è in media di 1,8-3 cm -0,5 cm Sotto il legamento inguinale, il nervo forma due fasci. I rami del fascio anteriore innervano il muscolo quadricipite femorale, il lato medio e mediale dell'articolazione del ginocchio e passano nel nervo safeno, che innerva la superficie mediale della parte inferiore della gamba e la caviglia interna. L'anestesia del nervo sciatico consente di operare in qualsiasi area al di sotto dell'articolazione del ginocchio, per ridurre tutte le fratture delle ossa dell'arto inferiore, esclusa una frattura del collo del femore. Tecnica di anestesia. La pelle viene trattata con una soluzione disinfettante. Con una soluzione anestetica si forma una "buccia di limone", dopo di che l'ago viene iniettato sotto il legamento inguinale 1-1,5 cm sotto quest'ultimo e 0,5-1 cm lateralmente all'arteria femorale palpata. L'ago viene diretto attraverso il tessuto sottocutaneo un po' in direzione prossimale sotto il legamento inguinale, dove a una profondità di 3-4 cm dopo la puntura della fascia, l'ago si rompe con perdita di resistenza e può verificarsi parestesia, estendendosi alla superficie anteriore della coscia. In questa posizione, l'ago viene fissato con il pollice e l'indice della mano sinistra e il bordo del palmo della mano sinistra viene premuto con forza sui tessuti molli della coscia distalmente all'ago e 35-40 ml di un Viene iniettata una soluzione di trimecaina all'1,5%. La pressione sui tessuti molli dura 1,5-2 minuti. Pertanto, l'anestesia del nervo femorale con il bloccaggio si trasforma in anestesia del plesso lombare, eseguita dall'approccio anteriore. L'azione dell'anestesia dura 2-2,5 ore. Complicazioni: è possibile un riassorbimento abbastanza rapido della soluzione anestetica quando l'anestesia del plesso lombare è combinata con l'anestesia del nervo sciatico, quando la dose singola totale supera 1 g del farmaco. L'anestesia del plesso lombare può essere eseguita con l'approccio posteriore, anestetizzando contemporaneamente il femore (L2-L4) e nervi otturatori (L2-L3), nervo genitofemorale (L1-L2) e il nervo cutaneo femorale laterale (L2-L3). La posizione del paziente durante l'anestesia è su un lato sano con le gambe piegate. Punti di riferimento: processo spinoso della 4a vertebra lombare (linea che collega le creste iliache dietro); 3 cm caudali lungo le creste dei processi spinosi dal processo spinoso della 4a vertebra lombare e 5 cm lateralmente dall'ultimo punto. Tecnica di anestesia. Dal processo spinoso della 4a vertebra lombare in direzione caudale si traccia una linea lunga 3 cm, dall'estremità della quale viene ripristinata lateralmente verso l'alto una perpendicolare lunga 5 cm Il punto terminale della perpendicolare, che giace vicino alla cresta iliaca, è il punto di iniezione dell'ago. Dopo aver creato una "buccia di limone", un ago lungo 12-15 cm viene inserito perpendicolarmente alla pelle fino a quando non entra in contatto con il processo trasversale della 5a vertebra lombare. Cranialmente, scivolando fuori dal processo trasversale della 5a vertebra lombare, l'ago entra nello spessore del muscolo psoas quadrato. Allo stesso tempo, si avverte resistenza all'introduzione di una soluzione al suo interno con una siringa (o si verifica una resistenza elastica con la deformazione della bolla d'aria nella siringa). L'ago viene passato a una profondità in cui si avverte una sensazione di "perdita di resistenza" (o la bolla d'aria non è deformata). Questo test indica che l'ago si trova nella fascia tra lo psoas quadrato e lo psoas major. L'ago viene fissato a questa profondità e vengono iniettati 35-40 ml di una soluzione di trimecaina (lidocaina) all'1,5-2% per ottenere l'anestesia. Possibili complicazioni: iniezione intramuscolare di una soluzione di anestetico locale con la posizione errata dell'ago, nonché rapido riassorbimento dell'anestetico nel sangue quando viene iniettata una soluzione concentrata. Anestesia del nervo sciatico dall'approccio anteriore Topografia. Il nervo sciatico origina dal plesso sacrale (L4-S3). Si forma nella piccola pelvi e lascia la cavità pelvica attraverso l'apertura piriforme insieme all'arteria. Medialmente ad esso, passa il nervo cutaneo posteriore, così come il fascio neurovascolare, costituito dall'arteria pudendo interna, dalla vena e dal nervo pudendo. Nella regione glutea, il nervo sciatico si trova sotto il grande gluteo, dietro i muscoli gemelli, otturatore interno e quadrato femorale. Su quest'ultimo si trova approssimativamente ad una uguale distanza dalla tuberosità ischiatica e dal grande trocantere del femore. Di norma, nella parte superiore della fossa poplitea, il nervo si divide in rami terminali: i nervi tibiale e peroneo comune. Il nervo tibiale passa attraverso il centro della fossa poplitea, situata lateralmente e superficialmente alla vena e all'arteria poplitea e, insieme ai vasi, entra nel canale caviglia-popliteo. Il nervo tibiale innerva i muscoli posteriori della gamba, tutti i muscoli della pianta del piede, la pelle della superficie posteriore della parte inferiore della gamba, il tallone e il bordo laterale del piede. Rami dal nervo sciatico all'articolazione dell'anca. Nella regione della piega glutea, giace superficialmente sotto l'ampia fascia della coscia verso l'esterno dal capo lungo del bicipite femorale. Il nervo peroneo comune corre lungo il lato laterale della fossa poplitea, attorno alla testa del perone. Da esso ci sono rami per l'articolazione del ginocchio e la pelle della superficie laterale della parte inferiore della gamba, innerva anche i muscoli della parte inferiore della gamba, i muscoli della schiena del piede e la pelle della parte posteriore delle dita dei piedi. L'anestesia del nervo sciatico viene eseguita dall'approccio anteriore. Punti di riferimento: asse iliaco antero-superiore e la parte più sporgente del grande trocantere del femore. Tecnica di anestesia. Il paziente giace supino La spina iliaca antero-superiore e il punto più sporgente del grande trocantere del femore sono collegati da una linea retta e dall'ultimo punto viene ripristinata una perpendicolare alla superficie anteriore della coscia. La lunghezza della perpendicolare è uguale alla distanza tra la spina iliaca antero-superiore e il grande trocantere del femore, la cui estremità è il punto di proiezione. Nella posizione fisiologica dell'arto inferiore, dopo aver trattato la pelle con una soluzione disinfettante e aver creato una "buccia di limone", un ago lungo 12-15 cm viene diretto verticalmente verso il basso fino ad appoggiarsi al piccolo trocantere del femore. Dopo che l'ago è scivolato via dal piccolo trocantere, senza cambiare la direzione principale, l'ago viene portato ancora più in profondità - 4-5 cm fino a quando non si verifica la parestesia. Se non è possibile ottenere la parestesia, l'ago viene riportato all'osso e, ruotando l'arto verso l'interno di 7-10°, l'ago viene fatto avanzare nuovamente fino alla comparsa della parestesia nel paziente. Anestesia del nervo sciatico dall'approccio posteriore Tecnica di anestesia. Il paziente giace su un lato sano, l'arto anestetizzato è piegato alle articolazioni dell'anca e del ginocchio con un angolo di 45-60°. Dalla parte più sporgente del grande trocantere del femore, viene tracciata una linea retta alla spina iliaca posteriore superiore, dal centro della quale si abbassa in direzione caudale una perpendicolare lunga 4-5 cm L'estremità della perpendicolare serve come punto di proiezione per il nervo sciatico. L'ago viene iniettato con un angolo di 90° rispetto al piano frontale del corpo del paziente e fatto avanzare fino a ottenere la parestesia o il contatto con l'osso. Se necessario, l'ago viene sollevato e inserito a circa 0,5 cm lateralmente o medialmente rispetto all'iniezione originale. Ottenere parestesie è d'obbligo. Immettere 20-25 ml di una soluzione al 2% di lidocaina (trimecaina). La tecnica dell'anestesia non cambierà se il paziente giace a pancia in giù. Anestesia nella fossa poplitea Per gli interventi chirurgici sulla parte inferiore della gamba e del piede è sufficiente anestetizzare i nervi tibiale e peroneale nella fossa poplitea. La posizione del paziente - su un lato sano o sullo stomaco. Punti di riferimento: tendini del bicipite, muscoli semimembranoso e semitendinoso della coscia, rotula, muscolo del polpaccio. Topografia. La fossa poplitea contiene fibre, vasi sanguigni, nervi e linfonodi. Il bordo esterno superiore è formato dal tendine del muscolo bicipite femorale, il bordo interno superiore è formato dai tendini dei muscoli semimembranoso e semitendinoso, la testa laterale del muscolo gastrocnemio è al di sotto e all'esterno e l'interno inferiore è il mediale testa del muscolo gastrocnemio. La proiezione dell'angolo superiore della fossa poplitea corrisponde principalmente al bordo superiore della rotula nell'angolo superiore della fossa romboidale del nervo sciatico ed è suddivisa nei nervi tibiale e peroneo comune. Quest'ultimo dal bordo superiore va al bordo laterale del gastrocnemio e avvolge il collo della testa del perone a semispirale. Nella fossa poplitea, il nervo tibiale passa più superficialmente lungo la linea mediana, una vena si trova più in profondità e medialmente da essa, e ancora più in profondità e medialmente, più vicino all'osso, è l'arteria poplitea. Tecnica di anestesia. L'angolo superiore della fossa romboidale è a livello del bordo superiore della rotula. Il punto di iniezione si trova 1-1,5 cm sotto l'angolo superiore sulla bisettrice abbassata da questo angolo, formata dall'esterno dal tendine del bicipite femorale, dall'interno dai tendini dei muscoli semimembranoso e semitendinoso della coscia. La direzione del movimento dell'ago è rigorosamente verticale con il paziente in posizione prona fino a quando non si ottiene la parestesia del nervo tibiale. In assenza di parestesia, l'ago viene diretto a forma di ventaglio, tirandolo ogni volta verso l'alto fino al livello del tessuto sottocutaneo. Dopo un test di aspirazione, vengono iniettati 5-10 ml di una soluzione al 2% di trimecaina. Per bloccare il nervo peroneo comune dallo stesso punto, l'ago è diretto lateralmente con un angolo di 30-45° rispetto al piano frontale. Dopo aver ricevuto la parestesia, vengono iniettati 5-10 ml di una soluzione al 2% di trimecaina. Non ci sono complicazioni o controindicazioni. Complicanze dell'anestesia regionale Durante l'AR, le complicazioni si verificano abbastanza raramente e possono essere divise in due gruppi. 1. Specifici, che sono più legati agli errori tecnici della metodologia: 1) errata iniezione di un anestetico locale nel canale spinale o nello spazio epidurale, per via endovenosa o intra-arteriosa (con anestesia del plesso cervicale, anestesia del plesso lombare con accesso inguinale); 2) puntura di cavità e organi (cavità pleurica, polmone); 3) la formazione di un ematoma con abbandono della puntura e danno a una grande nave; l'ematoma comprime il tessuto circostante o il fascio neurovascolare; 4) ipotensione prolungata e grave che si manifesta con un rapido riassorbimento dell'anestetico locale; 5) trauma al plesso nervoso o al conduttore con l'estremità dell'ago per iniezione durante una manipolazione approssimativa; 6) l'assenza di un effetto analgesico dopo l'anestesia del plesso o della conduzione. 2. Non specifico, manifestato principalmente da reazioni generali e locali del corpo all'azione di un anestetico locale sotto forma di reazioni tossiche e allergiche. Complicanze non specifiche possono svilupparsi a seconda del tempo, della dose e del sito di somministrazione dell'anestetico. In questo caso predominano le lesioni del sistema nervoso centrale o cardiovascolare. Le complicanze del SNC possono essere lievi (limitate solo all'eccitazione centrale) o gravi, che si manifestano con l'inibizione del SNC con possibile paralisi totale. La natura delle complicanze non specifiche: 1) un sovradosaggio di anestetico con la somministrazione simultanea di una dose elevata (più di 1 g) di trimecaina o lidocaina per via intraarteriosa o endovenosa. Con l'iniezione intravascolare di un anestetico locale, compaiono immediatamente reazioni tossiche e in caso di sovradosaggio del farmaco - dopo 10-15 minuti. Le reazioni tossiche gravi con dosaggi eccessivi di anestetici locali sono estremamente rare. Molto più spesso (fino alla morte) si osservano con la somministrazione intravascolare di una soluzione altamente concentrata di anestetico locale; 2) reazioni allergiche all'introduzione di un anestetico locale, caratterizzate da un complesso di sintomi di disturbi del sistema nervoso centrale e cardiovascolare: ansia, alterazione della coscienza, disturbi del linguaggio, contrazioni muscolari, convulsioni, respiro profondo, disturbi del ritmo cardiaco, espansione QR, abbassamento della pressione sanguigna, tachicardia, apnea , asistolia; 3) complicazioni infettive dovute a un'elaborazione di scarsa qualità del campo chirurgico nel sito dell'anestesia, sterilizzazione insufficiente di siringhe, aghi e soluzioni, nonché in presenza di un'infezione cutanea locale (piodermite) nell'area del manipolazione proposta; 4) lo sviluppo dell'ipotensione con anestesia del plesso e della conduzione è molto meno comune rispetto all'anestesia epidurale e spinale, ma ciò non riduce l'importanza di correggere l'ipovolemia; 5) con l'introduzione di soluzioni concentrate di anestetici locali in una piccola percentuale di casi, si nota lo sviluppo di bradicardia, che è ben fermato dall'atropina solfato. I casi di fibrillazione ventricolare e arresto cardiaco sono estremamente rari. Controindicazioni per la conduzione Le controindicazioni sono le seguenti. 1. Isteria. 2. Tendenza ad aggravare. 3. Complicanze neurologiche: emiplegia ed emiparesi dell'area proposta di anestesia, malattie del midollo spinale, sclerosi multipla, malattie dei nervi periferici. 4. Infezione della pelle nell'area del punto di iniezione dell'ago. 5. Setticemia. 6. Tendenza al sanguinamento e grave ipovolemia dopo una massiccia perdita di sangue. 7. Anemia perniciosa (controindicazione relativa). 7. Anestesia epidurale La sua essenza sta nel blocco dei nervi spinali e delle loro radici con un anestetico introdotto nello spazio epidurale. La tecnica di conduzione e la zona di anestesia sono indicate nella lezione n. 2. Dosi e durata dell'analgesia 1. La lidocaina viene iniettata in un volume di 4 ml (2%), la durata dell'anestesia è di 4 ore. 2. La marcaina viene somministrata alla dose di 6-10 ml (0,5%), la durata dell'anestesia è di 6-8 ore. 3. Naropin viene somministrato alla dose di 4-6 ml (1%), la durata dell'anestesia è di 4-6 ore. Con questo tipo di anestesia, l'emodinamica soffre, c'è una forte diminuzione della pressione sanguigna. Pertanto, quando si utilizza questo tipo di anestesia, è necessario un monitoraggio costante della pressione del paziente e, se necessario, la sua correzione. 8. Anestesia lombare Questo tipo di anestesia si ottiene iniettando un anestetico nel canale spinale. La tecnica della puntura lombare è descritta nella lezione n. 2. Le caratteristiche sono che il livello di puntura è più alto (T12-L1, L1-L2) e dopo aver rimosso il mandrino dall'ago, viene immediatamente iniettato un anestetico. Il volume dell'anestetico è di 3-5 ml. Naropin viene somministrato in una concentrazione dello 0,5%, lidocaina - nel 2%, marcaina - nello 0,5%. La durata dell'anestesia è di 4-6 ore Questo tipo di anestesia provoca anche una grave ipotensione. Con un alto livello di anestesia (T12-L1) può causare problemi respiratori. La complicanza più comune è il mal di testa. 9. Blocco vagosimpatico cervicale secondo A. V. Vishnevsky Il paziente viene posizionato sul tavolo sulla schiena in modo che la mano sul lato del blocco proposto penda oltre il bordo del tavolo. Il muscolo sternocleidomastoideo deve essere rilassato. Un rullo è posto sotto il cingolo scapolare, la testa è retratta nella direzione opposta; in questa posizione i contorni anatomici del collo sono ben delineati. Il campo viene trattato con lubrificazione con alcool e iodio. Il dottore si trova dalla parte dell'omonimo blocco. Il sito di iniezione è l'angolo formato dall'intersezione del bordo posteriore del muscolo sternocleidomastoideo con una vena. L'indice della mano sinistra è posizionato sul bordo posteriore del muscolo sternocleidomastoideo, sopra il punto in cui si incrocia con la vena giugulare esterna. Premendo con forza un dito su questo punto, cercano di spostare il fascio neurovascolare sulla linea mediana. In questo caso, il dito sente facilmente la superficie anteriore delle vertebre cervicali. L'iniezione dell'ago e il suo avanzamento devono essere eseguiti lentamente, verso l'alto e verso l'interno, concentrandosi sempre sulla superficie anteriore della colonna vertebrale. L'ago si muove lungo la soluzione di novocaina allo 2% inviata in piccole porzioni (3-0,25 cm), il che garantisce la sicurezza dell'iniezione. La siringa durante l'iniezione viene rimossa ripetutamente dall'ago a scopo di controllo (sangue). Dopo aver portato l'ago alla vertebra, sentono come si appoggia contro di essa. Quindi la pressione sull'ago si indebolisce, a causa della quale si allontana di 1-2 mm, dopo di che vengono iniettati da 40 a 60 ml di una soluzione che, diffondendosi in un infiltrato strisciante lungo l'aponeurosi prevertebrale, copre il vago, simpatico , e spesso i nervi frenici, interrompendo (bloccando) la trasmissione delle irritazioni dalla regione pleuropolmonare. L'efficacia del blocco vagosimpatico è evidenziata dalla comparsa del sintomo di Horner (restringimento della pupilla, restringimento della fessura palpebrale e retrazione del bulbo oculare). Il ritmo respiratorio e il polso diventano meno frequenti, la mancanza di respiro e la cianosi diminuiscono e le condizioni generali migliorano. Per evitare che l'ago penetri nei vasi del collo, il muscolo sternocleidomastoideo con il fascio neurovascolare sottostante deve essere spostato con sufficiente forza con l'indice sulla linea mediana. È importante dirigere l'ago verso l'alto e verso l'interno, poiché spostarlo in direzione orizzontale minaccia di introdurre una soluzione sotto l'aponeurosi prevertebrale e la successiva complicazione sotto forma di una sindrome del dolore che non si ferma durante il giorno. Lezione n. 14. Valutazione della gravità del paziente e monitoraggio Valutazione della condizione somatica del paziente. 1 punto - pazienti la cui malattia è localizzata e, di regola, non causa disturbi sistemici, ad es. persone praticamente sane. 2 punti: questo include pazienti con disturbi inespressi che interrompono moderatamente l'attività vitale del corpo senza cambiamenti pronunciati nell'omeostasi. 3 punti: pazienti con disturbi sistemici vitali che interrompono in modo significativo il funzionamento del corpo, ma non portano a disabilità. 4 punti - pazienti con gravi disturbi sistemici che rappresentano un grave pericolo per la vita umana e portano alla disabilità. 5 punti - pazienti la cui condizione è considerata critica, il rischio di morte entro 24 ore è alto. Il volume e la natura dell'intervento chirurgico: 1 punto - piccole operazioni per: rimozione di tumori localizzati e localizzati superficialmente, apertura di piccoli ascessi, amputazione delle dita delle mani e dei piedi, legatura e rimozione di emorroidi, appendicectomia semplice ed erniotomia. 2 punti - operazioni di moderata gravità: rimozione di tumori maligni localizzati superficialmente che richiedono un intervento esteso; apertura di ascessi localizzati in cavità; amputazione e disarticolazione degli arti superiori e inferiori; operazioni su navi periferiche; appendicectomia complicata ed erniotomia che richiedono un ampio intervento; toracotomia e laparotomia di prova; altri simili per complessità e portata di intervento. 3 punti - interventi chirurgici estesi: operazioni radicali sugli organi addominali (tranne quelli sopra elencati); operazioni radicali sugli organi della cavità toracica; amputazioni estese degli arti, come l'amputazione transiliosacrale; neurochirurgia. 4 punti: operazioni sul cuore, vasi di grandi dimensioni e altri interventi complessi eseguiti in condizioni speciali (circolazione artificiale, ipotermia, ecc.). Gli interventi chirurgici d'urgenza sono valutati, come quelli pianificati, in base alle condizioni fisiche e al volume dell'operazione, ma sono inclusi in un gruppo separato o indicati in aggiunta alla figura dall'indice "C". Nota Il rischio operativo e anestetico è designato come segue: il numeratore indica la gravità della condizione iniziale in punti, il denominatore - il volume dell'operazione, anche in punti. Classificazione dello stato oggettivo del paziente, sviluppata dall'American Society of Anesthesiologists (ASA). 1. Non ci sono disturbi sistemici. 2. Disturbi sistemici lievi senza compromissione funzionale. 3. Malattie sistemiche moderate e gravi con disfunzione. 4. Grave malattia sistemica che rappresenta costantemente una minaccia per la vita e porta al fallimento delle funzioni. 5. Stato terminale, alto rischio di morte durante il giorno, indipendentemente dall'operazione. 6. Morte cerebrale, donazione di organi per trapianto. Se l'intervento è effettuato in via d'urgenza, la valutazione dello stato è integrata dalla lettera "E". La valutazione delle condizioni del paziente e la possibile letalità di ciascun caso sono riportate nella Tabella 7. Tabella 7 Valutazione delle condizioni del paziente e della mortalità perioperatoria
Il monitoraggio (Tabella 7) è il controllo di funzioni e processi, l'identificazione delle loro pericolose deviazioni al fine di prevenire complicazioni, in particolare durante l'anestesia e la terapia intensiva. Il monitoraggio viene effettuato per controllare: 1) per le funzioni del paziente (elettrocardiografia, pulsossimetria, capnografia, ecc.); 2) azioni terapeutiche (controllo del blocco neuromuscolare); 3) ambiente (composizione gassosa della miscela inalata); 4) azionamento di mezzi tecnici (ventilatore, ecc.). Il monitoraggio delle funzioni per grado di complessità può essere effettuato da: 1) monitoraggio continuo dei parametri; 2) controllo con segnalazione quando un parametro viene a mancare oltre i limiti stabiliti; 3) monitoraggio continuo con notifica quando il parametro supera i limiti stabiliti, ed inoltre indicazione per la soluzione; 4) lo stesso con l'attuazione di misure di normalizzazione della funzione. La rilevanza del monitoraggio è dovuta a: 1) la sempre maggiore complessità e durata degli interventi chirurgici; 2) un aumento della gravità dei disturbi funzionali nei pazienti; 3) la complicazione dei mezzi tecnici utilizzati in medicina critica. Significato del monitoraggio: 1) diagnosi tempestiva dei disturbi e prevenzione di gravi complicanze, compreso l'arresto cardiaco e respiratorio; 2) tattiche più adeguate di terapia intensiva e alta efficienza di trattamento. Indicazioni di monitoraggio: 1) monitoraggio minimo - sempre richiesto durante l'anestesia e la terapia intensiva; 2) monitoraggio approfondito (metodiche non invasive e invasive) in caso di violazioni significative delle funzioni dell'organismo, soprattutto quando un paziente sviluppa insufficienza multiorgano; 3) monitoraggio preventivo - a rischio di sviluppare una condizione critica. Norme di monitoraggio. Nel 1978, il Dutch Board of Health ha introdotto il primo standard di monitoraggio in sala operatoria, che elencava le apparecchiature necessarie per il monitoraggio. Nel 1985, su suggerimento delle compagnie assicurative, è stato proposto lo standard di monitoraggio di Harvard per l'anestesiologia, che fornisce i parametri per il monitoraggio dei pazienti durante l'anestesia durante l'intervento chirurgico e le modalità di tale monitoraggio. La sua introduzione nella pratica ha ridotto il rischio di complicanze anestetiche e lo ha reso più sicuro per il paziente. In Russia nel 1997, il sistema MORF ha delineato gli standard per il monitoraggio minimo dell'anestesia, della rianimazione e della terapia intensiva (n. 161/DM-2 del 24 febbraio 1997 “Sulle misure per garantire la sicurezza dei pazienti durante l'anestesia, la rianimazione e la terapia intensiva " ). I dati sono riportati nella tabella 8, tabella 9. Tabella 8 anestesia
Tabella 9 Conduzione di rianimazione e terapia intensiva
Per condurre una terapia intensiva efficace, è necessario monitorare i sistemi cardiovascolare, respiratorio e nervoso, le funzioni del fegato, dei reni, del tratto gastrointestinale, dell'emopoiesi, dell'emostasi, nonché dell'energia, dell'elettrolita idrico, dell'acido-base e dell'onco-osmosi equilibrio. Altrettanto importante è il monitoraggio intensivo degli interventi terapeutici in corso e dei loro risultati. Un ruolo importante è svolto dal monitoraggio dello stato microbiologico esterno ed interno, nonché dall'uso di criteri prognostici e dalla valutazione degli esiti. Innanzitutto è necessario utilizzare una valutazione clinica dello stato del paziente e metodi di monitoraggio non invasivi. Il monitoraggio clinico, ovvero l'osservazione di segni e sintomi clinici, dati qualitativi, non è meno importante degli indicatori quantitativi ottenuti utilizzando una tecnologia sofisticata. Monitoraggio delle funzioni del sistema Monitoraggio del sistema circolatorio Il monitoraggio della circolazione consente il rilevamento tempestivo delle aritmie cardiache e dell'ischemia miocardica attraverso l'uso dell'elettrocardiografia. Le aritmie cardiache possono essere identificate dall'onda P e dal complesso ORS sull'elettrocardiomonitor nelle derivazioni V1 e V2 dell'elettrocatetere standard degli arti o loro modifiche. L'ischemia miocardica può essere identificata dalla conseguente depressione del segmento ST sull'ECG: 1) nel torace V5, così come su una delle sue modifiche - ischemia del setto della parete laterale sinistra; 2) derivazione standard 2 dalle estremità - ischemia della zona basale del miocardio nel bacino dell'arteria coronaria destra. La depressione del tratto ST in discesa (elevazione) è un indicatore di ischemia indotta da stress. Il monitoraggio dell'emodinamica viene effettuato da: 1) misurazioni della pressione sanguigna; 2) misurazioni CVP in combinazione con prove di stress volumetriche (queste sono informazioni sul riempimento vascolare); 3) la determinazione della pressione dell'arteria polmonare e della pressione di cuneo (PWP) utilizzando un catetere arterioso polmonare galleggiante è un metodo più accurato per valutare il volume intravascolare rispetto alla CVP e può anche servire come misura del precarico ventricolare sinistro; 4) determinazione della gittata cardiaca mediante una tecnica di termodiluizione, il metodo Fick (CO = VCO2 /CaCO2), varie modifiche della tecnica Doppler (ecocardiografia Doppler esofagea), ecografia del cuore. Monitoraggio del respiro Il monitoraggio respiratorio viene effettuato in base ai sintomi clinici e ai dati di capnografia, pulsossimetria, spirometria volumetrica ed emogasanalisi periodica. Durante la ventilazione meccanica, la pressione nel sistema "ventilatore - paziente" e la concentrazione di ossigeno nella miscela inalata (FiO2). Segni clinici di insufficienza respiratoria: frequente (più di 24-30 al minuto per gli adulti) respirazione superficiale, partecipazione alla respirazione di muscoli aggiuntivi (sternocleidomastoideo, addominale e altri, che si manifesta con retrazione degli spazi intercostali, gonfiore delle ali del naso, posizione semiseduta forzata), sudorazione, cianosi, cambiamento della frequenza cardiaca (prima aumento e poi potrebbe esserci aritmia) e pressione sanguigna (aumento e con grave ipossia - diminuzione), un cambiamento nella coscienza da euforia a coma. La capnografia consente il rilevamento tempestivo dei disturbi della ventilazione: ipoventilazione (aumento della CO2 nell'aria espirata finale - FetCO2 > 6,4%), iperventilazione (FetCO2 < 4,9%), ventilazione irregolare (angolo di inclinazione del plateau del capnogramma alveolare - 5°). Durante la ventilazione meccanica, in assenza di capnografo, il volume di ventilazione è controllato dal volume minuto di respirazione (Vist.), misurato mediante uno spirometro volumetrico, che è installato nel percorso espiratorio. Inoltre, viene monitorato il volume inspiratorio minuto (Vappar.), necessario per calcolare la concentrazione di ossigeno nella miscela di gas inalata e determinare la tenuta di questo sistema - "ventilatore-paziente". Il controllo della tenuta è ottenuto anche dalla pressione nel sistema "device-sick", misurata per mezzo di un monovacuometro. La pulsossimetria consente il rilevamento tempestivo di ridotta ossigenazione nei polmoni, ipossiemia (SaO2 < 94%. Inoltre, in base alla natura del pletismogramma, si può giudicare lo stato del microcircolo e della gittata cardiaca. Un ulteriore studio dei gas nel sangue aiuta a valutare il grado di alterato scambio gassoso nei polmoni (in base all'entità del gradiente alveolo-arterioso della tensione di ossigeno. Alcuni monitor possono fornire una valutazione della biomeccanica della respirazione durante la ventilazione meccanica basata sulla compliance dei polmoni e del torace (C, normalmente 60-100 ml) e della resistenza (resistenza) delle vie respiratorie (R, normalmente 2-3 cm). Monitoraggio delle funzioni neurologiche Il monitoraggio delle funzioni neurologiche viene effettuato valutando la coscienza sulla scala di Glasgow (basata sulla reazione di apertura degli occhi, sulle risposte motorie e verbali a uno stimolo crescente: 15 punti - normale, 3 punti - morte cerebrale). Inoltre, vengono determinati la pressione intracranica e il flusso sanguigno cerebrale (ad esempio, utilizzando un monitor Doppler transcranico). La funzionalità renale è più comunemente monitorata misurando la produzione oraria di urina, che è normalmente > 0,5 ml/kg/h. Lezione numero 15. Ventilazione polmonare artificiale La ventilazione polmonare artificiale (ALV) fornisce lo scambio di gas tra l'aria circostante (o una certa miscela di gas) e gli alveoli dei polmoni, viene utilizzata come mezzo di rianimazione in caso di interruzione improvvisa della respirazione, come componente dell'anestesia e come mezzo di terapia intensiva per l'insufficienza respiratoria acuta, nonché alcune malattie del sistema nervoso e muscolare. I moderni metodi di ventilazione polmonare artificiale (ALV) possono essere suddivisi in semplici e hardware. Un metodo semplice di ventilazione meccanica viene solitamente utilizzato in situazioni di emergenza (apnea, con ritmo anomalo, respirazione agonica, con aumento dell'ipossiemia e (o) ipercapnia e gravi disturbi metabolici). I metodi espiratori di IVL (respirazione artificiale) dalla bocca alla bocca e dalla bocca al naso sono semplici. I metodi hardware vengono utilizzati se necessario per la ventilazione meccanica a lungo termine (da un'ora a diversi mesi e persino anni). Il respiratore Phase-50 ha un grande potenziale. Per la pratica pediatrica viene prodotto l'apparato "Vita-1". Il respiratore è collegato alle vie aeree del paziente attraverso un tubo endotracheale o una cannula tracheostomica. La ventilazione hardware viene eseguita nella modalità di frequenza normale, che varia da 12 a 20 cicli per 1 minuto. In pratica esistono ventilazione meccanica in modalità ad alta frequenza (più di 60 cicli per 1 min), in cui il volume corrente diminuisce notevolmente (fino a 150 ml o meno), la pressione positiva nei polmoni al termine dell'inalazione diminuisce , così come la pressione intratoracica e il flusso sanguigno al cuore migliora. Inoltre, in modalità ad alta frequenza, l'adattamento del paziente al respiratore è facilitato. Esistono tre metodi di ventilazione ad alta frequenza: volumetrica, oscillatoria e a getto. Il volume viene solitamente eseguito con una frequenza respiratoria di 80-100 per 1 minuto, IVL oscillatorio - 600-3600 per 1 minuto, che garantisce la vibrazione di un flusso di gas continuo o intermittente. La ventilazione a getto ad alta frequenza più diffusa con una frequenza respiratoria di 100-300 al minuto, in cui un getto di ossigeno a una pressione di 1-2 atm viene soffiato nelle vie aeree attraverso un ago o un catetere con un diametro di 2-4 mm. La ventilazione a getto viene effettuata attraverso un tubo endotracheale o tracheostomia (contemporaneamente l'aria atmosferica viene aspirata nelle vie respiratorie) e attraverso un catetere che viene inserito nella trachea attraverso il passaggio nasale o percutaneamente (puntura). Quest'ultimo è importante in situazioni in cui non ci sono condizioni per l'intubazione tracheale. La ventilazione artificiale dei polmoni può essere eseguita in modalità automatica, ma ciò è accettabile nei casi in cui la respirazione spontanea in un paziente è completamente assente o soppressa da farmaci (rilassanti muscolari). Viene anche eseguita la ventilazione assistita, ma in questo caso viene preservata la respirazione indipendente del paziente. Il gas viene erogato dopo che il paziente ha fatto un debole tentativo di inalare o il paziente è sincronizzato con una modalità di funzionamento del dispositivo selezionata individualmente. Esiste anche una modalità di ventilazione obbligatoria intermittente (PMV) che viene applicata durante il passaggio graduale dalla ventilazione meccanica alla respirazione spontanea. In questo caso, il paziente respira da solo, ma inoltre viene fornito un flusso continuo della miscela di gas alle vie aeree. In questo contesto, con una frequenza specificata (da 10 a 1 volta al minuto), il dispositivo esegue un respiro artificiale, coincidente (PVL sincronizzato) o non coincidente (PVL non sincronizzato) con l'inspirazione indipendente del paziente. La graduale riduzione dei respiri artificiali consente di preparare il paziente alla respirazione spontanea. I circuiti respiratori sono mostrati nella Tabella 10. Tabella 10 Circuiti respiratori
La ventilazione manuale con una sacca o una maschera è prontamente disponibile ed è spesso sufficiente per gonfiare adeguatamente i polmoni. Il suo successo, di regola, è determinato dalla corretta selezione delle dimensioni della maschera e dall'esperienza dell'operatore, e non dalla gravità della patologia polmonare. Показания 1. Rianimazione e preparazione del paziente in breve tempo per la successiva intubazione. 2. Ventilazione periodica con borsa e maschera per prevenire l'atelettasia post-estubazione. 3. Restrizioni alla ventilazione con borsa e maschera. Attrezzatura Vengono utilizzati un pallone respiratorio convenzionale e una maschera con un manometro installato o un pallone respiratorio autogonfiabile con camera di ossigeno. Tecnica 1. È necessario appoggiare la mascherina ben salda sul viso del paziente, dando alla testa del paziente una posizione mediana con il mento fissato con un dito. La maschera non deve giacere sugli occhi. 2. Frequenza respiratoria - di solito 30-50 per 1 min. 3. Pressione inspiratoria - di solito 20-30 cm di acqua. Arte. 4. Una maggiore pressione (30-60 cm di colonna d'acqua) è accettabile durante la rianimazione primaria nell'attività lavorativa di una donna. Valutazione dell'efficacia 1. Ritorno della frequenza cardiaca a valori normali e scomparsa della cianosi centrale. 2. L'escursione del torace dovrebbe essere buona, la respirazione viene eseguita ugualmente bene su entrambi i lati. 3. Lo studio della composizione gassosa del sangue è solitamente richiesto e condotto durante la rianimazione prolungata. complicazioni 1. Pneumotorace. 2. Gonfiore. 3. Sindrome da ipoventilazione o episodi di apnea. 4. Irritazione della pelle del viso. 5. Distacco della retina (quando si applica una maschera agli occhi e si crea un picco di pressione elevato a lungo termine). 6. La ventilazione di maschera e sacca può peggiorare le condizioni del paziente se si oppone attivamente alla procedura. Hardware IVL Показания 1. Apnea. 2. Coma nel periodo acuto, anche senza segni di insufficienza respiratoria. 3. Convulsioni non controllate dalla terapia anticonvulsivante standard. 4. Shock di qualsiasi eziologia. 5. Aumento della dinamica della sindrome della depressione del SNC nella sindrome da iperventilazione. 6. Con una lesione spinale alla nascita nei neonati - la comparsa di respirazione forzata e sibilo diffuso crepitante sullo sfondo della mancanza di respiro. 7. RO2 sangue capillare inferiore a 50 mm Hg. Arte. durante la respirazione spontanea con una miscela con FiO2 0,6 o più. 8. RSO2 sangue capillare superiore a 60 mm Hg. Arte. o inferiore a 35 mm Hg. Arte. con respiro spontaneo. Equipaggiamento: "FASE-5", "BP-2001", "Infant-Star 100 o 200", "Sechrist 100 o 200", "Babylog 1", "Stephan", ecc. Principi di trattamento 1. L'ossigenazione nei polmoni rigidi può essere ottenuta aumentando la concentrazione di ossigeno inspirato, aumentando la pressione inspiratoria, aumentando la PEEP, prolungando il tempo inspiratorio, aumentando la pressione di plateau. 2. Ventilazione (rimozione di CO2) può essere potenziato da un aumento del volume corrente, un aumento della frequenza e un prolungamento del tempo espiratorio. 3. La selezione dei parametri di ventilazione (frequenza, pressione inspiratoria, plateau inspiratorio, rapporto inspiratorio-espiratorio, PEEP) varierà a seconda della natura della malattia sottostante e della risposta del paziente alla terapia. Scopi dell'IVL 1. Ossigeno: raggiungere pO2 50-100 mmHg Arte. 2. Tenere premuto pCO2 entro 35-45 mm Hg. Arte. 3. Eccezioni: in alcune situazioni, indicatori di pO2 e pCO2 può differire da quanto sopra: 1) nella patologia polmonare cronica, valori di pCO più elevati2 portatile; 2) con gravi difetti cardiaci, sono tollerati numeri di pO più piccoli2; 3) a seconda dell'approccio terapeutico in caso di ipertensione polmonare vengono tollerati valori di pCO maggiori o minori2. 4. Le indicazioni ei parametri di ventilazione devono essere sempre documentati. Tecnica 1. Parametri iniziali di IVL: pressione inspiratoria 20-24 cm di acqua. Arte.; PEER da 4-6 cm di acqua. Arte.; frequenza respiratoria 16-24 per 1 min, tempo di inalazione 0,4-0,6 s, DO da 6 a 10 l/min, MOV (volume di ventilazione minuto) 450-600 ml/min. 2. Sincronizzazione con un respiratore. Di norma, i pazienti sono sincroni con il respiratore. Ma l'eccitazione può compromettere la sincronizzazione, in questi casi può essere necessaria una terapia farmacologica (morfina, promedolo, idrossibutirrato di sodio, miorilassanti). sondaggio 1. Una componente importante dell'indagine sono i test di emogasanalisi ripetuti. 2. Esame fisico. Controllo dell'adeguatezza dell'IVL. Quando si esegue la ventilazione di emergenza con un metodo semplice, è sufficiente osservare il colore della pelle e i movimenti del torace del paziente. La parete toracica dovrebbe espandersi ad ogni inspirazione e cadere ad ogni espirazione, ma se la regione epigastrica si alza, l'aria soffiata entra nell'esofago e nello stomaco. Il motivo è spesso la posizione sbagliata della testa del paziente. Quando si esegue la ventilazione meccanica a lungo termine, è necessario valutarne l'adeguatezza. Se la respirazione spontanea del paziente non viene soppressa dai preparati farmacologici, uno dei principali segni dell'adeguatezza dell'IVL eseguito è il buon adattamento del paziente al respiratore. In presenza di una chiara coscienza, il paziente non dovrebbe avere una sensazione di mancanza d'aria, disagio. I suoni respiratori nei polmoni dovrebbero essere gli stessi su entrambi i lati e la pelle dovrebbe avere un colore normale. complicazioni 1. Le complicanze più comuni della ventilazione meccanica sono: rottura degli alveoli con sviluppo di enfisema interstiziale, pneumotorace e pneumomediastinite. 2. Altre complicazioni possono essere: contaminazione e infezione batterica, otturazione del tubo endotracheale o estubazione, intubazione di un polmone, pneumopericardite con tamponamento cardiaco, diminuzione del ritorno venoso e diminuzione della gittata cardiaca, cronicità del processo nei polmoni, stenosi e ostruzione la trachea. Sullo sfondo della ventilazione meccanica, è possibile utilizzare una serie di analgesici, che dovrebbero fornire un livello e una profondità sufficienti di anestesia in dosi, la cui introduzione in condizioni di respirazione spontanea sarebbe accompagnata da ipossiemia. Mantenendo un buon apporto di ossigeno al sangue, la ventilazione meccanica contribuisce al fatto che il corpo affronta la lesione chirurgica. In molte operazioni sugli organi del torace (polmoni, esofago) viene utilizzata l'intubazione bronchiale separata, che consente di disattivare un polmone dalla ventilazione durante gli interventi chirurgici per facilitare il lavoro del chirurgo. Questa intubazione impedisce anche al contenuto del polmone operato di fuoriuscire nel polmone sano. Durante gli interventi alla laringe e alle vie respiratorie viene utilizzata la ventilazione ad alta frequenza a getto transcatetere, che facilita l'esame del campo chirurgico e permette di mantenere un adeguato scambio gassoso con trachea e bronchi aperti. In condizioni di anestesia generale e rilassamento muscolare, il paziente non è in grado di rispondere alla conseguente ipossia e ipoventilazione, pertanto è importante controllare il contenuto di gas nel sangue (monitoraggio continuo della pressione parziale di ossigeno e pressione parziale di anidride carbonica) per via percutanea utilizzando sensori speciali. In caso di morte clinica o agonia, la ventilazione meccanica è una componente obbligatoria della rianimazione. È possibile interrompere l'esecuzione dell'IVL solo dopo che la coscienza è completamente ripristinata e la respirazione spontanea è completa. Nel complesso della terapia intensiva, la ventilazione meccanica è il metodo più efficace per il trattamento dell'insufficienza respiratoria acuta. Viene effettuato attraverso un tubo che viene inserito nella trachea attraverso il passaggio nasale inferiore o tracheostomia. Di particolare importanza è la cura delle vie respiratorie, il loro adeguato drenaggio. La ventilazione meccanica ausiliaria viene utilizzata in sessioni di 30-40 minuti per il trattamento di pazienti con insufficienza respiratoria cronica. L'ALV è utilizzato in pazienti in stato di coma (trauma, chirurgia cerebrale), nonché con danno periferico ai muscoli respiratori (poliradicoloneurite, lesione del midollo spinale, sclerosi laterale amiotrofica). L'ALV è anche ampiamente utilizzato nel trattamento di pazienti con trauma toracico, vari avvelenamenti, incidenti cerebrovascolari, tetano e botulismo. Lezione n. 16. Terapia infusionale La terapia infusionale è un'iniezione a goccia o un'infusione endovenosa o sottocutanea di farmaci e fluidi biologici al fine di normalizzare l'equilibrio idroelettrolitico, acido-base del corpo, nonché per la diuresi forzata (in combinazione con diuretici). Indicazioni per la terapia infusionale: tutti i tipi di shock, perdita di sangue, ipovolemia, perdita di liquidi, elettroliti e proteine a seguito di vomito indomabile, diarrea intensa, rifiuto di assumere liquidi, ustioni, malattie renali; violazioni del contenuto di ioni basici (sodio, potassio, cloro, ecc.), acidosi, alcalosi e avvelenamento. I principali segni di disidratazione del corpo: retrazione dei bulbi oculari nelle orbite, cornea opaca, pelle secca e anelastica, palpitazioni caratteristiche, oliguria, urina concentrata e giallo scuro, la condizione generale è depressa. Controindicazioni alla terapia infusionale sono l'insufficienza cardiovascolare acuta, l'edema polmonare e l'anuria. Le soluzioni cristalloidi sono in grado di compensare la carenza di acqua ed elettroliti. Applicare una soluzione di cloruro di sodio allo 0,85%, soluzioni di Ringer e Ringer-Locke, una soluzione di cloruro di sodio al 5%, soluzioni di glucosio al 5-40% e altre soluzioni. Vengono somministrati per via endovenosa e sottocutanea, per via orale (con grave disidratazione) e flebo, in un volume di 10-50 ml/kg o più. Queste soluzioni non causano complicazioni, ad eccezione del sovradosaggio. Gli obiettivi della terapia infusionale sono: ripristino del BCC, eliminazione dell'ipovolemia, garantire un'adeguata gittata cardiaca, mantenere e ripristinare la normale osmolarità plasmatica, garantire un'adeguata microcircolazione, prevenire l'aggregazione dei globuli, normalizzare la funzione di trasporto dell'ossigeno del sangue. Le soluzioni colloidali sono soluzioni di sostanze macromolecolari. Contribuiscono alla ritenzione di liquidi nel letto vascolare. Vengono utilizzati emodez, poliglucina, reopoliglyukin, reogluman. Con la loro introduzione sono possibili complicazioni, che si manifestano sotto forma di reazione allergica o pirogena. Vie di somministrazione: per via endovenosa, meno spesso per via sottocutanea e gocciolante. La dose giornaliera non supera i 30-40 ml/kg. Hanno una qualità disintossicante. Come fonte di nutrizione parenterale, vengono utilizzati in caso di prolungato rifiuto di mangiare o impossibilità di alimentarsi per via orale. Vengono utilizzate idrolisi del sangue e della caseina (alvezin-neo, poliammina, lipofundina, ecc.). Contengono aminoacidi, lipidi e glucosio. A volte c'è una reazione allergica all'introduzione. Velocità e volume di infusione. Tutte le infusioni in termini di velocità di infusione volumetrica possono essere suddivise in due categorie: che richiedono e non richiedono una correzione rapida del deficit di BCC. Il problema principale potrebbero essere i pazienti che necessitano di una rapida eliminazione dell'ipovolemia. cioè, la velocità di infusione e il suo volume devono garantire le prestazioni del cuore al fine di fornire correttamente la perfusione regionale di organi e tessuti senza una significativa centralizzazione della circolazione sanguigna. Nei pazienti con un cuore inizialmente sano, tre punti di riferimento clinici sono più informativi: PA media > 60 mmHg. Arte.; pressione venosa centrale - CVP> 2 cm di acqua. Arte.; diuresi 50 ml/ora. In casi dubbi, viene eseguito un test con un carico in volume: si versano 15-20 ml di una soluzione cristalloide in 400-500 minuti e si osservano le dinamiche di CVP e diuresi. Un aumento significativo della CVP senza un aumento della diuresi può indicare insufficienza cardiaca, il che suggerisce la necessità di metodi più complessi e informativi per valutare l'emodinamica. Mantenere entrambi i valori bassi suggerisce ipovolemia, quindi viene mantenuta una velocità di infusione elevata con ripetute valutazioni passo-passo. Un aumento della diuresi indica oliguria prerenale (ipoperfusione dei reni di origine ipovolemica). La terapia infusionale nei pazienti con insufficienza circolatoria richiede una chiara conoscenza dell'emodinamica, un monitoraggio di monitoraggio ampio e speciale. I destrani sono sostituti del plasma colloidale, il che li rende altamente efficaci nel rapido recupero del BCC. I destrani hanno specifiche proprietà protettive contro le malattie ischemiche e la riperfusione, il cui rischio è sempre presente durante gli interventi chirurgici maggiori. Gli aspetti negativi dei destrani comprendono il rischio di sanguinamento dovuto alla disaggregazione piastrinica (caratteristica soprattutto della reopoliglucina), quando si rende necessario l'uso di dosi significative del farmaco (> 20 ml/kg), e un temporaneo cambiamento delle proprietà antigeniche del sangue. I destrani sono pericolosi per la loro capacità di provocare una "bruciore" dell'epitelio dei tubuli renali e quindi sono controindicati nell'ischemia renale e nell'insufficienza renale. Spesso provocano reazioni anafilattiche, che possono essere piuttosto gravi. Di particolare interesse è una soluzione di albumina umana, poiché è un colloide naturale di un sostituto del plasma. In molte condizioni critiche accompagnate da danno dell'endotelio (principalmente in tutti i tipi di malattie infiammatorie sistemiche), l'albumina è in grado di passare nello spazio intercellulare del letto extravascolare, attirando acqua e peggiorando gli edemi dei tessuti interstiziali, in primis i polmoni. Il plasma fresco congelato è un prodotto prelevato da un singolo donatore. La FFP viene separata dal sangue intero e congelata immediatamente entro 6 ore dal prelievo di sangue. Conservato a 30°C in sacchetti di plastica per 1 anno. Data la labilità dei fattori di coagulazione, FFP deve essere infuso entro le prime 2 ore dopo un rapido scongelamento a 37°C. La trasfusione di plasma fresco congelato (FFP) comporta un alto rischio di contrarre infezioni pericolose, come HIV, epatite B e C, ecc. La frequenza delle reazioni anafilattiche e pirogene durante la trasfusione di FFP è molto alta, quindi compatibilità secondo il sistema ABO dovrebbe essere preso in considerazione. E per le giovani donne, va considerata la compatibilità Rh. Attualmente, l'unica indicazione assoluta per l'uso della FFP è la prevenzione e il trattamento del sanguinamento coagulopatico. FFP svolge due importanti funzioni contemporaneamente: emostatico e mantenimento della pressione oncotica. La FFP viene anche trasfusa con ipocoagulazione, con sovradosaggio di anticoagulanti indiretti, con plasmaferesi terapeutica, con DIC acuta e con malattie ereditarie associate a carenza di fattori di coagulazione del sangue. Gli indicatori di una terapia adeguata sono una chiara coscienza del paziente, pelle calda, emodinamica stabile, assenza di tachicardia grave e mancanza di respiro, diuresi sufficiente - entro 30-40 ml/h. 1. Trasfusione di sangue Complicanze della trasfusione di sangue: disturbi post-trasfusione del sistema di coagulazione del sangue, gravi reazioni pirogene con sindrome ipertermica e scompenso cardiovascolare, reazioni anafilattiche, emolisi eritrocitaria, insufficienza renale acuta, ecc. La base della maggior parte delle complicazioni è la reazione di rigetto da parte del corpo di tessuto estraneo. Non ci sono indicazioni per la trasfusione di sangue intero in scatola, perché il rischio di reazioni e complicanze post-trasfusione è significativo, ma il più pericoloso è l'alto rischio di infezione del ricevente. In caso di emorragia acuta durante l'intervento chirurgico e un adeguato reintegro del deficit di BCC, anche una forte diminuzione dell'emoglobina e dell'ematocrito non minaccia la vita del paziente, poiché il consumo di ossigeno in anestesia è significativamente ridotto, l'ossigenazione aggiuntiva è accettabile, l'emodiluizione aiuta prevenire il verificarsi di microtrombosi e mobilizzazione degli eritrociti dal deposito, aumentare la velocità del flusso sanguigno, ecc. Le "riserve" di globuli rossi che una persona ha per natura superano notevolmente le reali necessità, soprattutto in stato di riposo, in quale è il paziente in questo momento. Raccomandazioni per la prescrizione di trasfusioni di sangue di donatori ed eritrociti durante l'intervento chirurgico. 1. La trasfusione della massa eritrocitaria viene eseguita dopo il ripristino del BCC. 2. In presenza di una grave patologia concomitante, che può portare alla morte (ad esempio, l'anemia grave è scarsamente tollerata nella malattia coronarica grave). 3. In presenza dei seguenti indicatori del sangue rosso del paziente: 70-80 g / l per l'emoglobina e il 25% per l'ematocrito e il numero di globuli rossi è di 2,5 milioni. Le indicazioni per la trasfusione di sangue sono: sanguinamento e correzione dell'emostasi. Tipi di eritrociti: sangue intero, massa eritrocitaria, EMOLT (massa eritrocitaria separata dai leucociti, piastrine con soluzione salina). Il sangue viene somministrato per via endovenosa mediante flebo, utilizzando un sistema monouso alla velocità di 60-100 gocce al minuto, in un volume di 30-50 ml/kg. Prima della trasfusione di sangue, è necessario determinare il gruppo sanguigno e il fattore Rh del ricevente e del donatore, condurre un test per la loro compatibilità e al letto del paziente viene eseguito un test biologico per la compatibilità. Quando si verifica una reazione anafilattica, la trasfusione viene interrotta e iniziano le misure per eliminare lo shock. Il concentrato piastrinico standard è una sospensione di piastrine centrifugate due volte. La conta piastrinica minima è 0,5 x 1012 per litro, i leucociti - 0,2 x 109 per litro. Le caratteristiche emostatiche e la sopravvivenza sono più pronunciate nelle successive 12-24 ore di preparazione, ma il farmaco può essere utilizzato entro 3-5 giorni dal momento del prelievo di sangue. Il concentrato piastrinico è usato per trombocitopenia (leucemia, aplasia del midollo osseo), trombopatia con sindrome emorragica. 2. Nutrizione parenterale Nelle malattie gravi accompagnate da gravi disturbi dell'omeostasi, è necessario fornire al corpo energia e materiale plastico. Pertanto, quando la nutrizione attraverso la bocca è compromessa o completamente impossibile per qualche motivo, è necessario trasferire il paziente alla nutrizione parenterale. In condizioni critiche di varie eziologie, i cambiamenti più significativi si verificano nel metabolismo delle proteine: si osserva una proteolisi intensiva, specialmente nei muscoli striati. A seconda della gravità del processo in corso, le proteine del corpo vengono catabolizzate nella quantità di 75-150 g al giorno (le perdite proteiche giornaliere sono mostrate nella Tabella 11). Ciò porta a una carenza di aminoacidi essenziali, che vengono utilizzati come fonte di energia nel processo di gluconeogenesi, con conseguente bilancio azotato negativo. Tabella 11 Perdita proteica giornaliera in condizioni critiche
La perdita di azoto porta ad una diminuzione del peso corporeo, poiché: 1 g di azoto \u6,25d 25 g di proteine (aminoacidi) \uXNUMXd XNUMX g di tessuto muscolare. Entro un giorno dall'esordio di una condizione critica, senza una terapia adeguata con l'introduzione di una quantità sufficiente di nutrienti essenziali, le proprie riserve di carboidrati si esauriscono e l'organismo riceve energia da proteine e grassi. A questo proposito, vengono effettuati cambiamenti non solo quantitativi, ma anche qualitativi nei processi metabolici. Le principali indicazioni per la nutrizione parenterale sono: 1) anomalie nello sviluppo del tratto gastrointestinale (atresia esofagea, stenosi pilorica e altri, periodo pre e postoperatorio); 2) ustioni e lesioni del cavo orale e della faringe; 3) ustioni corporee estese; 4) peritonite; 5) ileo paralitico; 6) fistole intestinali alte; 7) vomito indomabile; 8) coma; 9) malattie gravi accompagnate da aumento dei processi catabolici e disturbi metabolici scompensati (sepsi, forme gravi di polmonite); 10) atrofia e distrofia; 11) anoressia da nevrosi. La nutrizione parenterale deve essere effettuata in condizioni di compensazione per disturbi volemici, idroelettrolitici, eliminazione dei disturbi del microcircolo, ipossiemia e acidosi metabolica. Il principio di base della nutrizione parenterale è quello di fornire all'organismo un'adeguata quantità di energia e proteine. Ai fini della nutrizione parenterale, vengono utilizzate le seguenti soluzioni. Carboidrati: il farmaco più accettabile utilizzato a qualsiasi età è il glucosio. Il rapporto tra carboidrati nella dieta quotidiana dovrebbe essere almeno del 50-60%. Per un utilizzo completo, è necessario mantenere la velocità di somministrazione, il glucosio deve essere fornito con gli ingredienti: insulina 1 unità per 4 g, potassio, coenzimi coinvolti nell'utilizzo dell'energia: piridossalfosfato, cocarbossilasi, acido lipoico e ATP - 0,5-1 mg/kg al giorno per via endovenosa. Se somministrato correttamente, il glucosio altamente concentrato non provoca diuresi osmotica e un aumento significativo dei livelli di zucchero nel sangue. Per la nutrizione dell'azoto vengono utilizzati idrolizzati proteici di alta qualità (aminosol, amminone) o soluzioni di aminoacidi cristallini. Questi farmaci combinano con successo aminoacidi essenziali e non essenziali, sono poco tossici e raramente causano una reazione allergica. Le dosi dei preparati proteici somministrati dipendono dal grado di violazione del metabolismo proteico. Con i disturbi compensati, la dose di proteine somministrata è di 1 g/kg di peso corporeo al giorno. Lo scompenso del metabolismo proteico, manifestato da ipoproteinemia, una diminuzione del rapporto albumina-globulina, un aumento dell'urea nelle urine quotidiane, richiede l'introduzione di dosi maggiori di proteine (3-4 g/kg al giorno) e terapia anti-catabolica. Ciò include gli ormoni anabolici (retabolil, nerabolil - 25 mg per via intramuscolare 1 volta in 5-7 giorni), la costruzione di un programma di nutrizione parenterale in modalità iperalimentazione (140-150 kcal/kg di peso corporeo al giorno), gli inibitori della proteasi (kontrykal, trasylol 1000 U/kg al giorno per 5-7 giorni). Per un'adeguata assimilazione della materia plastica, ogni grammo di azoto introdotto deve essere provvisto di 200-220 kcal. Le soluzioni di aminoacidi non devono essere somministrate con soluzioni concentrate di glucosio, poiché formano miscele tossiche. Controindicazioni relative all'introduzione di aminoacidi: insufficienza renale ed epatica, shock e ipossia. Le emulsioni grasse contenenti acidi grassi polinsaturi vengono utilizzate per correggere il metabolismo dei grassi e aumentare il contenuto calorico della nutrizione parenterale. Il grasso è il prodotto più ipercalorico, tuttavia, per il suo utilizzo, è necessario mantenere dosi e velocità di somministrazione ottimali. Le emulsioni grasse non devono essere somministrate insieme a soluzioni concentrate di glucosio poliionico, né prima e dopo di esse. Controindicazioni per l'introduzione di emulsioni grasse: insufficienza epatica, lipemia, ipossiemia, condizioni di shock, sindrome tromboemorragica, disturbi del microcircolo, edema cerebrale, diatesi emorragica. I dati richiesti dei principali ingredienti per la nutrizione parenterale sono riportati nella Tabella 12 e nella Tabella 13. Tabella 12 Dosi, dosi, contenuto calorico dei principali ingredienti per la nutrizione parenterale
Quando si prescrive la nutrizione parenterale, è necessario introdurre dosi ottimali di vitamine che sono coinvolte in molti processi metabolici, essendo coenzimi nelle reazioni di utilizzazione dell'energia. Tabella 13 Dosi di vitamine (in mg per 100 kcal) necessarie durante la nutrizione parenterale
Il programma di nutrizione parenterale, svolto in qualsiasi modalità, dovrebbe essere redatto in termini di rapporto equilibrato di ingredienti. Il rapporto ottimale tra proteine, grassi, carboidrati è 1: 1,8: 5,6. Per la scomposizione e l'inclusione di proteine, grassi e carboidrati nel processo di sintesi è necessaria una certa quantità di acqua. Il rapporto tra il fabbisogno di acqua e il contenuto calorico del cibo è di 1 ml H2O - 1 kcal (1: 1). Calcolo del fabbisogno energetico del riposo (ERP) secondo Harris-Benedict: Uomini - EZP = 66,5 + 13,7 x peso, kg + 5 x altezza, cm - 6,8 x età (anni). Donne - EZP = 66,5 + 9,6 x peso, kg + 1,8 x altezza, cm - 4,7 x età (anni). Il valore EZP, determinato dalla formula Harris-Benedict, è in media di 25 kcal/kg al giorno. Dopo il calcolo, vengono selezionati il fattore di attività fisica (PFA) del paziente, un fattore di attività metabolica (FMA) basato sullo stato clinico e un fattore di temperatura (TF), con l'aiuto del quale il fabbisogno energetico (E) di un particolare il paziente sarà determinato. I coefficienti per il calcolo di FFA, FMA e TF sono riportati nella Tabella 14. Tabella 14 Coefficiente per il calcolo di FFA, FMA e TF
Per determinare il PE giornaliero, il valore EZP viene moltiplicato per FFA, FMA e TF. 3. Terapia di disintossicazione In caso di grave intossicazione, è necessaria una terapia di disintossicazione attiva, volta a legare e rimuovere le tossine dal corpo. A tale scopo vengono spesso utilizzate soluzioni di polivinilpirrolidone (neocompensan, gemodez) e gelatinolo, che adsorbono e neutralizzano le tossine, che vengono poi escrete dai reni. Queste soluzioni vengono somministrate goccia a goccia in una quantità di 5-10 ml/kg di peso corporeo, aggiungendovi una soluzione di vitamina C e cloruro di potassio in una quantità minima di 1 mmol/kg di peso corporeo. Mafusol, che è un efficace antiipoxant e antiossidante, ha anche una spiccata proprietà disintossicante. Inoltre, migliora la microcircolazione e le proprietà reologiche del sangue, che contribuisce anche all'effetto disintossicante. Con vari avvelenamenti, uno dei metodi più efficaci di disintossicazione è la diuresi forzata. I liquidi per via endovenosa ai fini della diuresi forzata sono prescritti per i gradi gravi di avvelenamento e per quelli più lievi, quando il paziente si rifiuta di bere. Controindicazioni alla diuresi forzata sono: insufficienza cardiovascolare acuta e insufficienza renale acuta (anuria). L'esecuzione della diuresi forzata richiede una contabilità rigorosa del volume e della composizione quantitativa del fluido iniettato, la nomina tempestiva di diuretici, un chiaro controllo clinico e biochimico. Come soluzione principale per il carico d'acqua, si propone: glucosio 14,5 g; cloruro di sodio 1,2 g; bicarbonato di sodio 2,0 g; cloruro di potassio 2,2 g; acqua distillata fino a 1000 ml. Questa soluzione è isotonica, contiene la quantità richiesta di bicarbonato di sodio, la concentrazione di potassio in essa contenuta non supera quella consentita e il rapporto tra la concentrazione osmotica di glucosio e sali è 2: 1. Nella fase iniziale della diuresi forzata, si consiglia inoltre di introdurre soluzioni plasma-sostitutive ed eventuali disintossicanti: albumina 8-10 ml/kg, hemodez o neocompensan 15-20 ml/kg, mafusol 8-10 ml/kg, refortan o infucol 6-8 ml/kg kg, reopoligliuchina 15-20 ml/kg. La quantità totale di soluzioni iniettate dovrebbe superare di circa 1,5 volte il fabbisogno giornaliero. Autore: Kolesnikova MA
▪ Comportamento organizzativo. Culla
Pelle artificiale per l'emulazione del tocco
15.04.2024 Lettiera per gatti Petgugu Global
15.04.2024 L'attrattiva degli uomini premurosi
14.04.2024
▪ I ratti rilevano la tubercolosi ▪ SSD ultra affidabili della serie PX03SN di Toshiba ▪ Il verde che circonda una persona rallenta il processo di invecchiamento
▪ sezione del sito Rivelatori di intensità di campo. Selezione dell'articolo ▪ articolo Tempo di spargere pietre, tempo di raccogliere pietre. Espressione popolare ▪ articolo Quale pianta può fungere da barometro? Risposta dettagliata ▪ articolo Come asciugare le scarpe. Consigli di viaggio ▪ articolo Il permanganato di potassio purifica l'acqua. Esperienza chimica
Homepage | Biblioteca | Articoli | Mappa del sito | Recensioni del sito www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

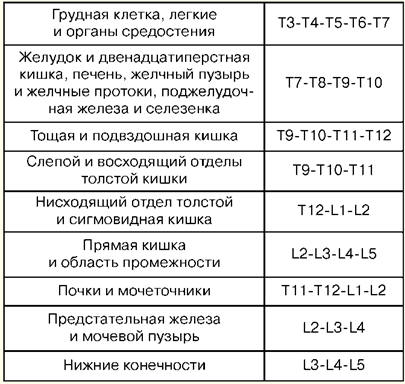












 Vedi altri articoli sezione
Vedi altri articoli sezione 